金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
时间分辨荧光技术有基于时域和基于频域两种测量方法。由于时间分辨结果数据包含有比稳态荧光数据更多的信息,近年来,时间分辨荧光技术已成为生物化学与生物物理领域的主要研究工具之一。荧光寿命成像技术可以同时获得分子状态以及空间分布的信息,在生物学和医学领域也得到了越来越广泛的应用。以下将从原理、仪器及应用等方面,简要介绍时间分辨荧光以及荧光寿命测量技术。
1荧光及荧光寿命的基本原理分子吸光后去活化的原理与过程,可以直观的用Perrin2Jablonsky图表示(图1是一种简化表示)。简言之,分子中处于单线态基态电子能级S0的电子,依据Frank2Condon规则吸收一定波长的光子后,被激发至单线态激发态电子能级(一般是S1态)中的某一振动能级,这一过程约10-15s;在经历短暂的振动弛豫过程后(约10-12~10-10s),会有大量电子在S1态的最低振动能态积累。这一状态的电子会有几种释放能量,回到基态S0态的途径,包括振动弛豫在内的这些途径被统称为去活化的过程。若能量释放的过程中伴随着光子的放出,则称为辐射去活;若只是通过碰撞等途径释放能量,而没有光子放出,则称为无辐射去活。
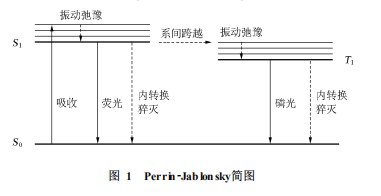
荧光发射即为一种常见的辐射去活过程,它通常是指电子发生自S1态至S0态的跃迁,同时放出光子的过程,这一过程的时间通常在10-10~10-7s。利用光学仪器检测荧光发射的强度随时间的变化,即可得到体系的荧光寿命信息。
无辐射去活过程有以下几种途径:内转换指的是电子在具有相同多重度的电子能态间发生跃迁的过程,时间通常在10-11至10-9s;系间跨越指的是电子在不同多重度的能态间发生跃迁的过程,如单线态S1至三线态T1的跃迁,其时间通常在10-10~10-8s;荧光猝灭指的是激发分子通过分子间的相互作用和能量转换,从而释放能量的过程,也称作外转换。这些无辐射去活过程在决定体系的荧光寿命时起非常重要的作用。
此外,电子跃迁至T1态后,也有一定几率以放出光子的形式跃迁至S0态,称作磷光发射;或再次系间跨越回S1态,并放出一个光子回到S0态,称作延迟荧光。限于篇幅,这两类发光情况不在此作讨论。
2荧光衰减曲线及荧光寿命在激发光源的照射下,一个荧光体系即向各个方向发出荧光;当光源停止照射时,荧光不会立即消失,而是会逐渐衰减至0。基于以上原理,可以对一个理想体系的荧光衰减进行严格的数学推导。
对于荧光物质A的稀溶液,设其浓度为[A](mol·L-1),假设所有A分子所处的环境近似,则溶液中所有A分子的荧光衰减途径相同。有一束时间很短的脉冲光,若其持续时间与过程中涉及的速率常数相比可忽略不计,则可认为其时间宽度为0,这种理想的线光源被称作δ2脉冲。以δ2脉冲激发上述溶液,由于光吸收与振动弛豫的时间很短,则可认为在时间为0时,一定数量的A分子就通过吸收光子,而到达了激发态S1,浓度用[1A3]表示。这些处于激发态的分子,会通过辐射(在这里即指荧光)或无辐射的途径返回基态S0,其速率常数分别用kSr和kSnr表示。此过程可与一级反应类比,激发态分子的衰减速率可用式(1)表示:
-d[1A3]dt=(kSr+kSnr)[1A3](1)
对式(1)进行积分,即可得到时间t时激发态分子浓度与初始激发态浓度[1A3]0间的关系:
[1A3]=[1A3]0exp-tτS(2)
式中的τS称作激发态S1的寿命,用式(3)表示:
τS=1kSr+kSnr(3)
荧光强度IF与激发态分子的浓度以及荧光辐射去活的速率常数成正比:
IF(t)=kSr[1A3]=kSr[1A3]0exp-tτS(4)
用荧光仪器测量时,观测到的荧光强度IF还与仪器的各参数有关。因此,荧光强度与激发态寿命的关系可简单表示为:
I(t)=αexp-tτ(5)式(5)
表明,以δ2脉冲作为激发光源的单一体系中,荧光强度呈单指数衰减。而观测到的荧光寿命τ与S1态的寿命τS等价,不仅受荧光发射速率的影响,还受各种非辐射过程的影响,所以直接测得的表观荧光寿命也称作自然寿命。
对于复杂体系,由于其中各荧光物质的性质或所处微观环境不同,整个体系的荧光衰减曲2线为多个指数衰减函数的加和,称多指数衰减:
I(t)=∑iαiexp-tτi(6)
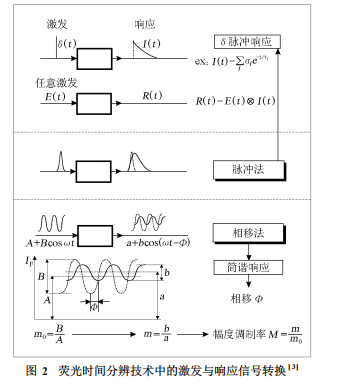
以上的荧光衰减曲线,是基于激发光源为理想线光源δ2脉冲的情况下得到的(图2)。实际上,任何实际光源都有一定的宽度,因此在实际应用中,上述表达式还需要做进一步修正。若将激发光源的强度表示为时间的函数E(t),则检测到的信号R(t)可表示为E(t)与δ2脉冲响应I(t)间的卷积分:
R(t)=E(t)ªI(t)=∫t0E(t′)I(t-t′)dt′(7)
根据以上理论推导得到的结论,可设计荧光寿命的检测仪器,解析测量结果,进一步得到体系的动力学信息。
3时间分辨光谱的测量
3.1原理与方法时间分辨光谱是一种瞬态光谱,是激发光脉冲截止后相对于激发光脉冲的不同延迟时刻测得的荧光发射,反映了激发态电子的运动过程(即荧光动力学)。一般测量的是荧光衰减谱,即固定检测的激发波长λex和发射波长λem,记录荧光强度随时间的变化。通常可采用两种时间分辨技术实现这一测量:基于时域的脉冲法与基于频域的相移法。
脉冲法采用很短的脉冲光源,而相移法采用可以给出各种频率简谐波的调制光源。两者得到的信号虽然都如式(7)所示,为激发光与δ2脉冲响应卷积的结果。但很显然,由于激发光源的不同,两者得到的信号有很大差别。脉冲法得到的荧光发射强度首先增加,达到峰值后开3始逐渐衰减(图2),当激发光的强度可以忽略后,衰减情况就变得与δ2脉冲响应的衰减曲线I(t)一致。因此,若要得到真实的δ2脉冲响应参数,需要对测量得到的荧光信号进行去卷积的运算。
相移法的激发光源为正(余)弦函数形状的简谐波,它与I(t)的卷积结果仍为一个正(余)弦函数,且激发光与信号光的频率一致,只是存在相位上的差别,以及平衡位置与幅度上的变化。相位上的变化用相移Φ表示,而平衡位置与幅度上的变化则用调制因子M表示(M=m/m0,具体见图2)。由于这些参数都可以直接通过激发光与信号光的比较来得到,因此相移法不需要通过去卷积的手段来处理获得的数据。脉冲法与相移法在理论上等价,但在检测的方法与仪器设计上却有诸多不同。
3.1.1脉冲法的测量与仪器
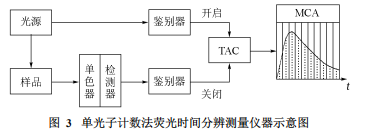
在目前针对荧光寿命或荧光衰减的检测中,脉冲法是最常使用的技术,其中单光子计数法(Time2CorrelatedSingle2PhotonCounting,TCSPC)是较普遍使用的手段。单光子计数法的基本原理是,在某一时间t检测到发射光子的概率,与该时间点的荧光强度成正比。令每一个激发脉冲最多只得到一个荧光发射光子,记录该光子出现的时间,并在坐标上记录频次,经过大量的累计,即可构建出荧光发射光子在时间轴上的分布概率曲线,即荧光衰减曲线。该过程类似于在光的衍射中,让一个个单一的光子经过狭缝,即可累计出衍射图像。
单光子计数法仪器示意图如图3。其中一个重要的部件称作时幅转换器(TAC),它可以将两个电信号间的时间间隔长度记录下来。激发光源发射一束短的脉冲光,同时被转换为一个电信号,启动TAC的记录;样品被脉冲光激发后,放出的光子同样被转换为一个电信号,终止TAC的记录。这样被TAC记录下来的时间间隔信号会以电脉冲的形式传达给多通道分析器(MCA),并在MCA对应的时间通道内记录一个点。经过大量的累计,就会形成荧光衰减曲线。计数越多,得到曲线的精确度越高,通常衰减曲线的峰值计数要达到103~104左右。另外,如果需要对所测曲线解卷积,就需要记录激发脉冲的曲线形状。这时,只要在相同的检测条件下,将样品换作光散射的溶液(常用硅胶悬浊液)即可。
时间分辨率是荧光寿命测量仪器的重要参数,它决定了仪器所能测量到的最短荧光寿命。在时间分辨荧光光谱仪中,无论是脉冲法或相移法,时间分辨率都是由激发光源与检测器共同决定的。在TCSPC法中,激发光源的选择非常重要,既可以选用各种气体闪光灯,也可选用脉冲激光器。闪光灯的成本相对较低,给出的脉冲基本在纳秒级,脉冲频率不高(104~105Hz),因此数据采集时间较长,在测定过程中还可能出现光强度漂移的情况,影响测量的效率与准确性。脉冲激光器则可以给出皮秒级的脉冲,且脉冲频率可以非常高,但其价格也比较昂贵。检测器方面,一般采用光电倍增管(PMT),也可采用微通道板检测器(MCP),后者的响应时间更快,且干扰较小。采用脉冲激光器与MCP的仪器,理论上可以检测到10~20ps的荧光寿命。
除了TCSPC法之外,频闪技术也用于脉冲法。该方法的激发光源同样是一连串的脉冲光,但是通过控制PMT的检测时间范围,每次只测量特定时间段内的荧光强度,即将衰减曲线分割为许多小段进行测量,最后再拼合起来。这样的测量方法避免了使用昂贵的部件,因为数据采集相对迅速,所以不需要使用高频率的闪光灯或激光器。但其时间分辨率比单光子计数法差,而且测量低荧光强度的样品时,难度更大。TCSPC法具有灵敏度高,动力学线性响应范围宽,统计学参数明确等优势。但由于TAC只记录激发脉冲后的第一个发射光信号,如果某一个激发脉冲产生了两个发射光子,则只有第一个光子会被记录下来,这样得到的荧光曲线会扭曲,使短时间处的信号频次堆积得偏高,这被称为“堆积效应”。因此,必须控制发射光的脉冲数远远小于激发光的脉冲数(比例小于0.01~0.05),这意味着大量的分子是通过非辐射的方式去活的,这种情况下一束脉冲光发射出多个光子的概率很小。但这也意味着计数频率非常低,需要相当长时间的计数才能满足准确测量的要求,因此TCSPC法耗时较长。另外,对测量结果解卷积的过程也容易引进误差,特别是对于荧光寿命较短的体系,这个问题尤为显著。
3.1.2相移法的测量与仪器
历史上第一台测量荧光寿命的仪器采用的是相移法。其测量原理比较直接,即激发光源给出正(余)弦信号,检测荧光发射信号与其的变化并进行相关计算。激发光源可以是激光器或是配有单色器的氙灯,之后通过光电调制器(通常为Pockel盒)将光源的连续光转换为正(余)弦光。除此之外,高频激光器所发出的脉冲序列可看作自调制的简谐信号,因此也可用作激发光源[6]。和TCSPC法相比,若采用的激发光源与检测器相同,则两种方法的时间分辨率近似。
基于上述原理所设计的相移法仪器的示意图如图4。激发光透过Pockel盒被调制并照射样品,所产生的荧光发射信号通过单色器,最后进入PMT。Pockel盒由一个频率生成器驱动,PMT的检测信号也被另一个频率生成器调制,而且这两个频率生成器之间是锁频的,频率差保持在几十赫兹,以达到用外差法检测的目的。这样就把检测信号转向低频区,其检测的准确度会比在高频区准确得多。
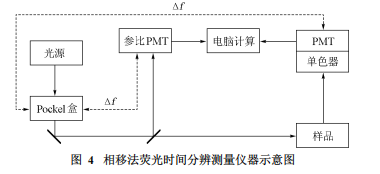
在测量过程中,激发光被同时分束照射参比PMT,样品信号与参比PMT接收的信号比较,得到发射荧光信号的相移φF与幅度调制率mF。之后,将样品换为散射溶液(通常为硅胶悬浊液),测量其的光信号相对于参比PMT的相移φR与幅度调制率mR。最后得到样品的绝对相移与调制因子分别为:Φ=φF-φR,M=mF-mR。这样,就提供了两个参数来计算荧光寿命,计算方法分别用以下两式表示:
5τΦ=1ωtanΦ(8)τM=1ω1M2-11/2(9)
对于一个只有单一荧光寿命的样品,式(8)和式(9)两种算法得到的结果一致。如果结果有较大差异,则说明该样品为含有多种荧光寿命的复杂体系,此时需要在多个激发频率下进行测量后汇总结果进行拟合计算。
3.1.3脉冲法与相移法比较
首先,这两种方法在原理上是完全等价的,所提供的信息也完全相同。从数学上可以证明,调制得到的简谐信号仅仅是δ2脉冲的Fourier变换形式,即两者所得到的结果只是时域与频域间的数学变换。从仪器的角度讲,两者最新一代的仪器都采用脉冲激光作为激发光源,微通道板(MCP)PMT作为检测器。两者内部的电子器件虽然有不同,但仪器的时间分辨率主要受限于检测器的时间响应,而这一参数在两种技术中都是一样的。另外,两种仪器所采用的光学器件也基本相同。因此,要达到同样的时间分辨率,两种技术所采用测量仪器的成本也越来越接近。
但是,正由于两者分别对应时域与频域上的测量,使得两者在测量及数据处理的方法上都有很大的差异,主要表现在以下几个方面:(1)脉冲法给出的是直观的荧光衰减曲线视图,而相移法给出的Fourier变换图形则不够直观。(2)单光子计数脉冲法灵敏度高,即便体系的荧光强度很低,也可以通过加长采集时间解决。在相移法中,为了得到准确的相角与幅度值,所测量的荧光强度一定要足够强,使得其灵敏度偏低。(3)在TCSPC法中,光子随机分布的误差服从泊松分布,这对测量结果的数据处理与判断有很大帮助。而在相移法中,则很难估计所测得的相移和幅度调制率的误差。(4)对于荧光时间分辨光谱的记录和荧光时间分辨各向异性光谱的测量,采用脉冲法会更加直接简便。(5)相移法的测量结果不需要去卷积。在脉冲法中,当测量的荧光寿命不够长时,常常需要去卷积计算。这就要求必须准确测量仪器本身的激发信号,否则对于荧光寿命很短的体系,计算所得到的结果与实际会有很大偏差。(6)从数学的角度讲,对荧光寿命的解析,采用相移法会更加简单。(7)尽管脉冲法通常要耗费很长时间采集数据,但这两者采集数据所花费的时间要视具体样品的情况而定。对于单一荧光寿命的体系,相移法更为迅速。如果体系由很多的荧光寿命的物种组成,这两种方法所耗费的时间会相差不多。但需要强调的一点是,相移法能够在某一特定频率快速得到荧光寿命信息的能力,使它在荧光寿命成像等研究领域中具有较大优势。
3.1.4数据处理方法
将测量结果数据进行处理与拟合,即可得到荧光寿命的信息。拟合数据时,脉冲法以单一或多个寿命的指数衰减曲线为模型,相移法则以相移与幅度调制率对不同检测频率的曲线为模型。两种方法都常用非线性最小二乘法进行拟合,获得数据与拟合曲线间的差异,给出的判据χ2r越接近1,说明拟合结果越理想。脉冲法的判据χ2r计算方法如式
:χ2r=1ν∑Ni=1R(ti)-Rc(ti)σ(i)2(10)
R(ti)与Rc(ti)分别代表某一时间上的测量数据与计算拟合数据,N为所有数据点的个6数,ν为自由度,σ(i)为第i个数据点的标准偏差。对于TCSPC法,测量误差遵循泊松分布,σ(i)约等于[R(ti)]1/2,所以式(10)可转化为:
χ2r=1ν∑Ni=1(R(ti)-Rc(ti))2R(ti)
在相移法中,则比较实际测量的相移与幅度调制率和拟合曲线的偏差。这两个量既可以单独分析,也可同时分析。同时分析的计算式如式(12),其中各数据的数理意义与脉冲法类似。
χ2r=1ν∑Ni=1Φ(ωi)-Φc(ωi)σΦ(ωi)2+∑Ni=1M(ωi)-Mc(ωi)σM(ωi)2(12)
除了χ2r外,另一个重要的衡量指标为残差权重,若拟合较为理想,数据的残差权重应在0附近随机分布。
W(ti)=R(ti)-Rc(ti)σ(i)(13)
对一个未知样品,一般可先根据样品情况或已有经验,假设它有n个荧光寿命,进行拟合计算。若计算出的χ2r与1相差很远,说明之前的假设不合理,可改变荧光寿命的个数进行校正。而对系荧光寿命的测量与解析当体系中含有多种荧光物质时,由于各物质的荧光发射光谱可能会拟合结果的最终解释,还要视样品本身的情况而定。
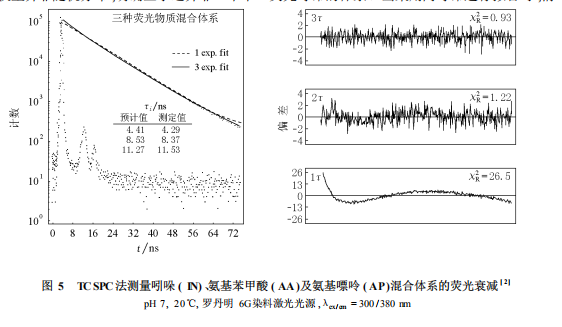
3.2荧光寿命测量的应用3.2.1混合体出现重叠和干扰的情况,单独依靠通常的荧光发射光谱手段可能无法得到体系准确的信息。而利用荧光时间分辨技术,可以通过荧光寿命的差异,解析出体系中荧光物质的组成情况,从而提供有价值的信息。图5所示为利用TCSPC法对一个混合体系的测量实例[2]。对一个由吲哚、氨基苯甲酸和氨基嘌呤组成的混合体系,若按单一寿命进行拟合,所得结果的χ2r=26.5,与1相去甚远,而且残差权重并非随机分布,明确显示这并非一个单一荧光寿命的体系。当采用两寿命进行拟合时,情况有很大改善,但仍不够理想。而采用3个寿命进行拟合,则可以得到比较理想的结果,并且拟合所得的各物质荧光寿命,与各单组分的荧光寿命非常接近,说明该方法的可靠性。需要说明的是,即使得到这样的拟合结果,也不能说明体系中一定只有3种荧光寿命,还要根据体系其他的信息进行分析而得出结论。这种人为预先假设荧光寿命个数的方式,是非线性最小二乘法拟合的最大缺陷。
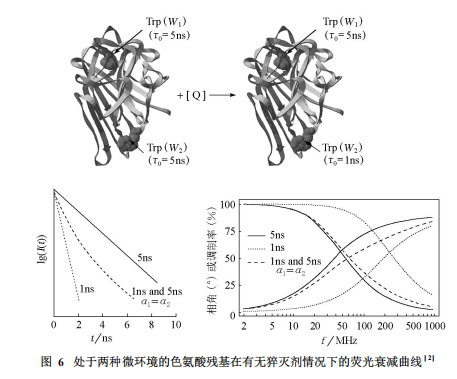
即便是同种荧光团,由于其所处微环境不同,其荧光寿命也可能有很大差别。因此,利用荧光时间分辨技术,可以辨别处于不同微环境的同种荧光团。譬如在一个蛋白质分子中含有两个色氨酸残基,其中一个被包埋在蛋白质分子内部,另一个则暴露在蛋白质分子表面。在通常条件下,两者荧光寿命相同,仅能够检测到一种荧光寿命。但当溶液中存在猝灭剂时,外部的色氨酸残基受到影响,荧光寿命会大大降低;而内部的色氨酸残基被蛋白质分子保护,不与猝灭剂接触,荧光寿命不发生变化。这样就检测到两种荧光寿命,由此可以判断蛋白质分子内含有位于不同微环境下的色氨酸残基。图6表示,脉冲法与相移法对上述过程检测的结果相同。
3.2.2蛋白质的结构解析利用体系中某一荧光团的荧光寿命解析蛋白质或其他大分子的结构,是时间分辨荧光技术的重要应用领域之一。该方法基于荧光共振能量转移(FRET)原理:若存在两个荧光团,其中一个荧光团(给体)的荧光发射光谱与另一个荧光团(受体)的荧光吸收光谱有足够的重叠,且两个荧光团的距离足够近、跃迁偶极方向近似平行时,就会发生由给体向受体的能量转移,导至两荧光团的荧光性质变化。其中,给体的荧光寿命会有明显减小。这是由于荧光衰减的速率常数中,又多出了荧光共振能量转移,即FRET的贡献,如式(14)。
8τS=1kSr+kSnr+kFRET(14)
式(14)中表示FRET速率常数的kFRET项可由式(15)求出。式(15)中A可认为是常数;κ2为方向因子,可由两荧光团的偶极方向算出;r为两荧光团间的距离。
kFRET=A·κ2·r-6(15)kFRET
随着荧光团间距离的增加而迅速减小,通过测量荧光寿命的变化,可以清楚地了解到荧光团间距离变化的情况。通过检测蛋白质分子内色氨酸残基或衍生化荧光团的荧光寿命情况,可进行蛋白质结构的分析及蛋白质结构变化时的动力学研究。
Gray与Winkler等[8]利用丹磺酰氯标记细胞色素c,并利用其与亚铁血红素的FRET,测量其荧光寿命的变化,从而给出了蛋白质的几种典型构型,并提出了蛋白质折叠过程中的结构变化过程。Udgaonkar等[9]利用色氨酸的荧光寿命变化,研究了barstar蛋白在展开过程中结构的变化。该工作的数据处理没有采用最小二乘法,而采用了另一种处理所得荧光寿命数据的方法:最大熵值法(MEM)。该算法不是拟合出几个独立的荧光寿命,而是给出荧光寿命的分布情况。由于最大熵值法不需要预先假设体系中存在几种荧光寿命,所以可以得到更为具体与准确的荧光寿命信息。
另外,采用偏振光源测量荧光衰减曲线,可以得到时间分辨的荧光各向异性光谱。经数据分析,可得到蛋白质内荧光团的旋转动力学信息,从而判定荧光团所处环境的刚性等信息,这对判断蛋白质的结构细节很有帮助。Udgaonkar等[10,11]利用时间分辨荧光各向异性光谱,还得到了barstar蛋白质在各种构型下更为详细的结构信息,与FRET方法的结论相互印证。
最近,随着分子力学与计算机分子模拟技术的发展,开始有研究将分子模拟与荧光寿命相结合,利用模拟出的蛋白质结构来计算色氨酸的荧光寿命,并与实验数据对照,对已有理论和实验结果进行重新检验。Clark等[12]对四环素阻遏蛋白复合物体系进行了分子结构模拟,通过对分子中色氨酸残基荧光寿命的计算,对多指数衰减的实验现象进行了解释,并对现有的理论提出了质疑。这一尝试直接将复杂的现实分子与直观的计算机模拟相联系,若未来该方法能够更加完善,必然会对分子层面的物理和化学研究带来很大便利。
3.2.3荧光寿命成像(FLIM)
时间分辨荧光成像,或称荧光寿命成像(FLIM)是对细胞、生物组织和微流控系统等样品进行大范围整体观测的重要方法。将普通的时间分辨荧光仪器的检测器换为CCD,即可实现荧光寿命的宽场成像[13]。由于荧光寿命与荧光团的浓度无关,而对其所在的微环境非常敏感,因此通过荧光寿命成像,可以获得样品内部物质的空间分布和局部微环境细节。另外,对样品进行动力学监控,也可得知样品内部的化学反应和物质运输情况。
荧光寿命成像可用于反应监控和分析。如在微流控系统中应用荧光寿命成像,可以获取反应的动力学参数。Matthews等研究者构造了一个Y型的微流控流路,分别通过Y的两支路加入荧光物质和猝灭剂,然后在节点及之后的管路上用荧光寿命成像检测流路内的荧光寿命分布。结合三维的有限差分法分析,可以得到猝灭反应(如罗丹明6G和碘化钾,22氨基吖啶酮和苯甲酰氯)的动力学常数(图7)[14]。
利用荧光寿命成像还可获取样品的一些物理性质。由于荧光分子在不同粘度的介质中构型变化速率不同,所以会表现出不一样的荧光寿命。根据此原理可以测量细胞内的黏度。Kuimova等使用几种含硼的分子转子(molecularrotor)测定了SK2OV23细胞内介质的黏度[15]。分子转子与细胞共同培养以使其进入细胞内部,之后采用单光子计数法(TCSPC)测定分子转子的荧光寿命。实验发现,此类分子转子的转动扩散时间在黏度为0.028~0.950Pa·s的范围内都与黏度呈线性关系,从而确定SK2OV23细胞的平均黏度为0.140±0.040Pa·s。

蛋白质和多肽中的色氨酸和酪氨酸残基可以发射荧光,因此蛋白质和多肽是一类很好的荧光寿命成像探针。在与不同的底物结合时,蛋白质和多肽的构象会发生变化,从而会使色氨酸和酪氨酸残基的荧光寿命发生改变。Schuttpelz等利用这一性质,采用p53抗原表位多肽检测p53抗体,检测范围可达到nmol至pmol级,可与传统ELISA方法相比拟[16]。
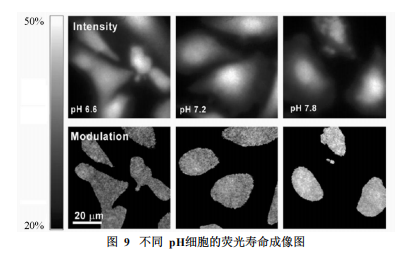
在细胞检测方面,荧光寿命成像可以获得细胞内被测物质的具体空间分布。Skala等利用NADH与FAD所具有的不同荧光寿命对细胞内的NADH和FAD分布进行了检测(图8),并发现了癌前细胞与正常细胞在氧化还原比率,NADH和FAD荧光寿命上的不同[17]。这一结果对细胞新陈代谢过程以及癌症转化机理等方面的研究有一定的促进作用。借助不同荧光寿命对pH敏感的荧光团,对细胞进行整体成像,即可得到细胞内pH的分布情况(图9)[18]Fluorescence,MEF),可以有效地提高荧光检测的灵敏度。ZhangJian等利用此性质在20nm的银颗粒外修饰上ConA和AlexaFluor647,获得了金属等离子耦合探针[19]。经过修饰之后,荧光强度提高了近30倍,同时荧光寿命显著降低,稳定性也有大的增强。此类探针有望用于细胞表面物质分布的研究。

体外诊断技术交流群:546848508
|
-
|
 /3
/3 