登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
本帖最后由 萝卜涨价了 于 2018-9-27 编辑
一、原理
限制性片段长度多态性PCR技术的理论依据是首先利用PCR扩增目的基因,然后用限制性内切酶酶解样品DNA,产生大量的限制性酶切片断。将限制性酶切产物进行含有溴化乙锭的琼脂糖凝胶电泳分离,在紫外灯下即可分辨各种限制性片段的大小及其位置。或者将限制性酶切产物与探针杂交进行放射自显影,从而区分各种片段。由于目标DNA之间存在有同源性和变异性,当用同一种限制性内切酶酶解不同品种或同一品种的不同个体时,不同酶切产物中就会含有相同或不同的长度片段,从而解读出目标样品之间在DNA分子水平的实际差异,这种方法就是PCR-RFLP。这种DNA分子水平的差异,可能是由于内切酶识别序列的改变而引起,也可能涉及部分片段的缺失、插入、易位、倒位等,见图14-8
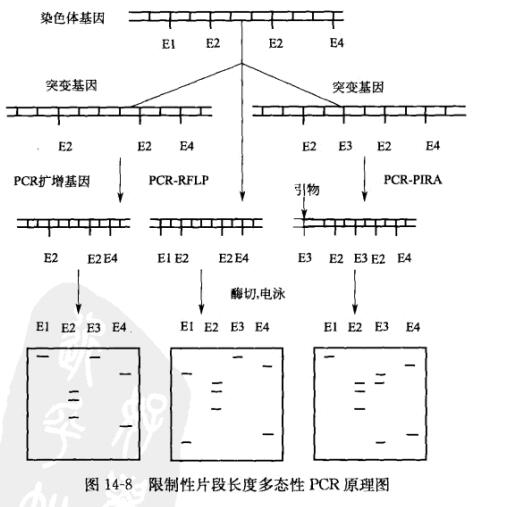
引物介导的限制性分析PCR( PCR- primer introduced restriction analysis,PR-PIRA)是PCR-RFLP技术的延伸:在设计引物时引入错配碱基,从而消除或产生新的酶切位点,该错配的结果最终表现在酶解的限制性片段长度的差异。 PCR-PIRA主要的分析对象是已知基因,用相应的计算机软件可以分析基因上可能产生的酶切位点的错配,从而产生人为的RFLP。 PCR-RFLP和 PCR-PIRA的主要区别在于后者的引物设计时人工地引人酶切位点,而在实验材料和方法上没有区别。因此本节主要介绍 PCR-RFLP。
二、材料
1.PCR所用材料
DNA模板提取试剂(针对不同的模板有不同的提取方式,因此应选择不同的试剂)、引物、Taq酶、三磷酸脱氧核甘酸(dNTP)和反应缓冲液。
2.RFIP所用试剂
限制性内切酶及缓冲液、琼脂糖凝胶电泳试剂[琼脂糖、TBE或TAE缓冲液、溴化乙锭EB)]和聚丙烯酰胺凝胶电泳试剂[丙烯酰胺:亚甲基双丙烯酰胺=29:1、TBE缓冲液、上样液(0.25%溴酚蓝,40%蔗糖水溶液)、过硫酸铵、NN,N,N四甲基乙二氨( TEMED)等]。
三、操作方法
1.引物设计
根据选择的目标基因设计合适的扩增引物。
2.制备模板DNA
①破碎细胞(动物、植物或微生物),离心取上清。
②加入等体积的酚氯仿异戊醇(25:24:1),充分混匀后12000/min离心10min
③取上清液加入二倍体积预冷的无水乙醇,轻轻摇匀,室温放置5min,12000/min离
④用70%预冷的乙醇洗涤一次,干燥,加入适量体积的TE缓冲液溶解,4℃保存。
3.PCR反应扩增DNA
反应体系:
dNTP(2. 5mmol/L) 4.0UL 引物2(0.2g/l) 2.0UL
10× Tag dna聚合酶缓冲液5UL DNA模板(0.1g/ml) 2.0UL
Tag dnA聚合酶(5U/dl) 0. 2ul dd H2O 31.8UL
MgClz(25mmol/L) 3UL 终体积 50UL
引物1(0.2g/pl) 2.0Ul
PCR反应条件:95℃样品变性5min,进行30个循环反应(95℃变性lmin、复性、72℃延伸),最后进行延伸反应。复性的温度和时间应根据具体情况而定,延伸的时间也要根据片段的长短而定
4.扩增产物的酶解
酶解反应体系:扩增产物DNA(1四g/μl)10μl,酶切缓冲液(10×)2μl,限制性内切酶(5U/pl)2pul,dH2O6l。终体积为20μl
37℃酶切过夜
5.扩增产物的检测
(1)电泳根据不同片段选择不同的凝胶电泳,如琼脂糖凝胶电泳(当片段>500bp时),或聚丙烯酰胺凝胶电泳(当片段<500bp时)。
(2)染色用0.2mg/L的溴化乙锭染色20min,紫外灯下检测结果,照相。
6. PCR-RFLP结果的分析
PCR-RFLP经凝胶电泳后,不同的样品可以分离出几条乃至十几条大小不同的条带,根据样品之间条带大小和所处的位置,就可以判别两个样品之间亲缘关系的远近及差异,也可以了解所扩增的基因在不同的物种中的保守区和易变区。通过设定表示亲缘关系远近的定值(如60%),当样品之间的相似度在此定值之上,可将它们列为同一物种。
四、注意事项
①在PCR的引物设计时,尽量选择基因两侧的保守区,这样可以减少因引物设计而引起的扩增难度。
②在PCR扩增时,Mg2对Taq酶的活性影响较大,从而直接影响扩增效率的高低。反应混合液中的EDTA、磷酸根均会影响Mg2+的有效浓度。因此,应先在不同的MgCl浓度下扩增DNA,选择理想的酶离子浓度,选择范围一般在0~4mmol/L。
③二甲基亚砜(DMSO)是一种PCR促进剂,可以降低在PCR过程中Taq酶的用量,降低对扩增引物的要求和增加PCR产物的量。因此在确定了MgCl2浓度的条件之后,可以考虑使用DMsO,但应选择合适的DMSO浓度,选择的范围一般在5%~20%。
④限制性内切酶在适宜的反应条件下会完全按照它本身固有的性质在特异性碱基序列上切断DNA片段。但反应体系的pH值和反应温度等发生改变,以及所提取的DNA含有乙醇等,均会改变限制性内切酶的酶解反应特性,从而产生非特异性酶解DNA片段,这种现象称为酶的星号活性现象。该现象将影响对目的基因的判定,造成假阳性。在导至星号活性的因素当中,反应液中的甘油浓度、乙醇浓度、被酶解的DNA的质量和浓度最为重要。
⑤完全酶解是 PCR-RFLP中的重要一步,若酶切不完全,虽对常见基因型的判断影响不大,但对稀有变异的个体会造成误检或漏检,并增加结果判定的难度,失去RFIP方法的优势。因此在酶解过程中,不同的酶解时间对于结果的判定会产生影响。一般情况下37℃2~3h就可以酶解完产物,但在 PCR-RFLP分析中宜采用酶解4h或过夜
⑥RFIP酶解片段在进行电泳分离的过程中,要根据片段的大小选择不同的琼脂糖浓度。因酶切可能产生小于100bp的片段,所以琼脂糖的浓度应比一般电泳时的浓度高,大约在2%5%范围内。如果产生的片段大部分小于500b,可用聚丙烯酰胺凝胶电泳进行分离。如果酶解产生的片段浓度较低,可用杂交的方式来增加检测的灵敏度1。
五、应用
1. PCR-RFLP在生物分类学中的应用
生物体死亡之后,其DNA被释放到自然环境中。由于自然环境的演化过程能沉积和保留一定数量的这类物质,如湖泊的沉积物、琥珀等,就有可能快速扩增得到期望的目的基因或DNA片段,并运用 PCR-RFLP技术对生物的遗传物质进行分析,从而了解生物的进化过程。CarlWoese等通过比较核糖体RNA序列之间的差异,建立起以分子顺序为基础的种系发生树。此方法能将所有的生物联系起来,并重建生物进化的历史过程。
对沉积于环境中的微生物进行分离和培养是研究微生物圈和微生物多样性的难题之一,传统的方法很难解决这一难题。使用 PCR-RFLP技术对16 S rRNA、18 SIRNA或5 SrRNA等基因进行扩增和分析,就能很好地研究环境样品中微生物群落和微生物的多样性。如Iim等对蕈状支原体和植原体的16 SrNA序列分析得出它们的同源性为72%,说明支原体和植原体在进化上存在较高的亲缘关系,但可能由于某种原因,在进化过程中使得支原体和植原体在寄主特异性和培养特性显出多样性。研究结果提示,在目前植原体尚不能人工培养的情况下,可借鉴支原体的人工培养方法,进行植原体的代谢研究及人工介质培养的选择。
不同种生物之间存在差异,同一种生物群体内个体之间也存在差异。生物群体中个体间差异的产生,一方面由于营养、气候和疾病等造成,另一方面主要是由于遗传因素而引起。若单纯以表型分类,不能区分同一种生物的单个性状、单个基因、甚至单个碱基之间的差异,借助PCR RFLP技术就可以对这种差异进行研究。
2. PCR-RFLP在研究人类遗传学疾病上的应用
某些人类的遗传性疾病是因为某一基因的碱基序列中发生突变,使之缺失或形成某一限制性内切酶的识别序列。通过 PCR-RFLP技术,用限制性内切酶酶切病人的基因,所得到的多态性片段就可以帮助我们从基因水平进行疾病分析。如血友病甲是一种常见的出血性疾病,患者体内缺乏一种血液凝固初期所必需的凝血因子(FVⅢ)。FVⅢ缺陷的方式有多种,其中一种是由于基因第14个外显子的第336位氨基酸的编码基因发生突变,使CGC突变成TGC,导至半胱氨酸替代了精氨酸,并同时产生了一个新的PstI酶切位点。这个位点的突变导至FVⅢ的功能丧失由于该突变不会影响蛋白的正常合成,它的抗原抗体反应检测显示正常,因此无法通过抗原抗体反应准确诊断该疾病。而采用 PCR-RFLP或 PCR-RIPA的分析方法不但可以对患者进行疾病诊断,还可以对胚胎早期做出诊断,这样就可以根据情况来釆取措施,如终止妊娠,以达到优生优育。
另外, PCR-RFLP也可直接作为基因分型。例如HLA的基因分型,可用于器官的移植和免疫学。
|
 /3
/3 