登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
作者丨鲸鱼 来源丨医学界肿瘤频道 界哥一觉醒来,听说液体活检又出大新闻了,这个小网红,最近挺能闹腾啊,听说这次能一次检出8大癌症?先不管,端起小板凳抢到第一排再说。 什么什么?Science首页!哇哇,一不小心拿了个生命科学界的奥斯卡!我收回刚才的话,“网红”这个词已经配不上它了,这是一个International大明星啊!果断路转粉!
所以到底是怎么回事呢?容界哥先戴上500度近视眼镜,不然我听不见Science喊麦。

1月18日,由约翰·霍普金斯大学肿瘤学家NickolasPapadopoulos领衔在线发表在Science上的研究指出,他们开发了一项名为CancerSEEK的液体活检技术,对8种常见肿瘤检测的中位敏感性达到了70%(P < 10-96),特异度高达99%。对卵巢癌和肝癌的敏感性最高,随后则是胃癌、胰腺癌、食道癌和结直肠癌,检出敏感性均达到了60%以上。 CancerSEEK技术通过检测血液样本中体细胞的基因突变,而这些突变仅在克隆增值异常的细胞中存在,以此诊断肿瘤的发生。其不仅能检出肿瘤组织的来源,据说还不太贵……
听起来很恢弘嘛,液体活检强势来袭,莫非组织活检饭碗不保?
说起来很惭愧,界哥就爱扒历史、玩穿越,学贯中西博古通今(古装剧不是白看的),所以老铁们系好安全带,前方就是时光隧道,老司机踩油门啦!
图2 最早开展活检的阿拉伯医生Albucasis[2] 然而对于大部分患者来说,不论是“挖块肉”的组织活检,还是“扎一针”的细针穿刺,都是十分恐怖的一件事。别的不说,听起来就疼。加上组织活检也有其局限性。

确诊恶性肿瘤,病理学检查总是最终的金标准。然而,病理石蜡切片的结果总是千呼万唤始出来,术中快速冰冻检查也不能用于肿瘤的早期诊断。准确性最高,但时效性却不佳。 毕竟,大部分尚未发生转移的恶性肿瘤都可以通过手术治愈[3],早诊断、早治疗,才是活下去的王道。
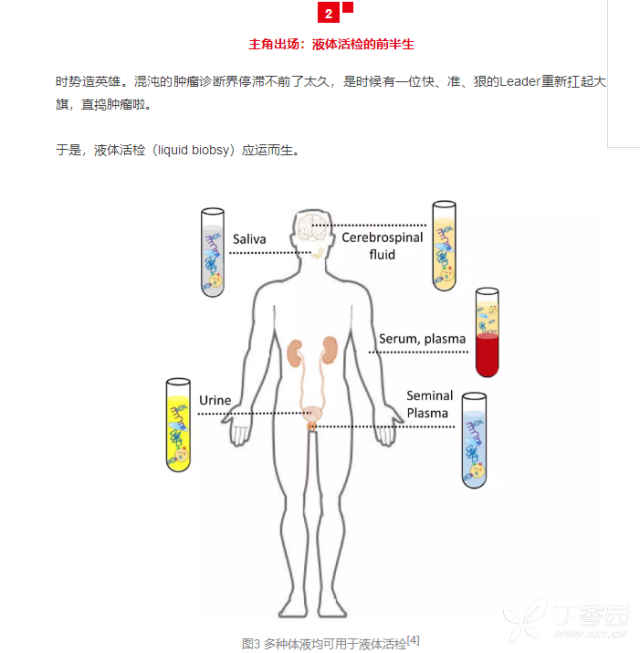
这项一项通过抽取人体的脑脊液、唾液、血液、尿液、精液等体液用于肿瘤诊断的技术,目前液体活检的项目主要是血液中的循环肿瘤细胞(CTCs)、循环肿瘤DNA(ctDNA)、循环RNA和外泌体(exosome)等。 这些物质均可以通过肿瘤周边的血管进入血液循环,通过抽取血液样本检测这些物质,可以用于肿瘤的早期诊断、疗法选择、预后判断和疗效监测等。
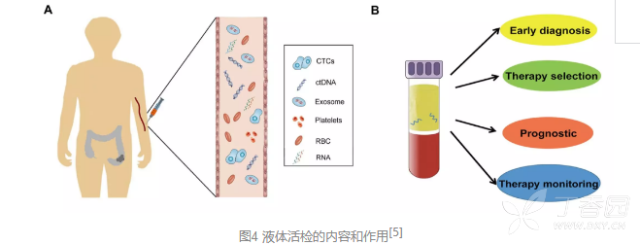
但电视剧里的英雄桥段都是美化过的,英雄不是生下来就可以气贯山河、力挽狂澜,他也有漫长的嗷嗷待哺的婴幼儿时光,也有淘气砸破邻居家窗户的小少年时代。 所以,液体检测一路走来,也诸多坎坷。
即便是目前唯一应用最广,用于诊断前列腺癌的血液中前列腺特异性抗原(PSA),也依然争议不断、命运多舛:

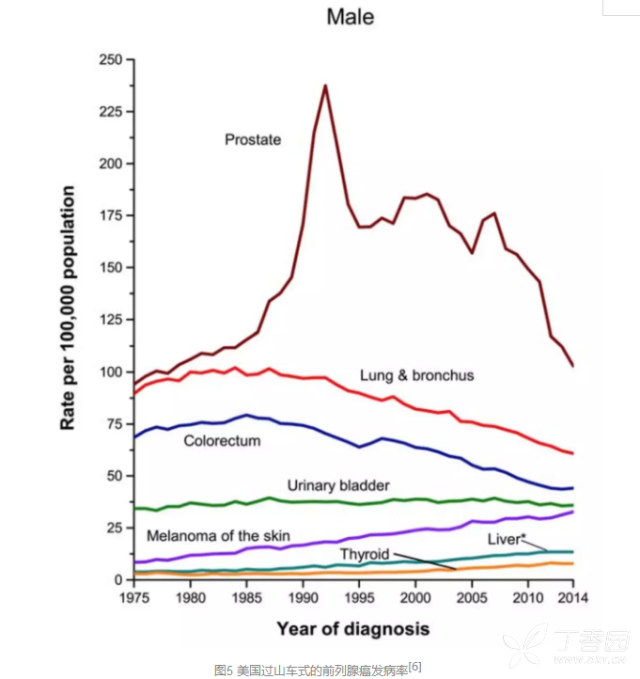
那么,究竟是什么问题让液体活检充满争议,迟迟无法推广呢?难在又要特异、又要敏感。 不是大家不想推广液体活检用于肿瘤检测,而是想要达到这一点太难了!特异性、敏感性,缺一不可;不仅要检测出肿瘤,更要回答肿瘤组织来源在哪里。
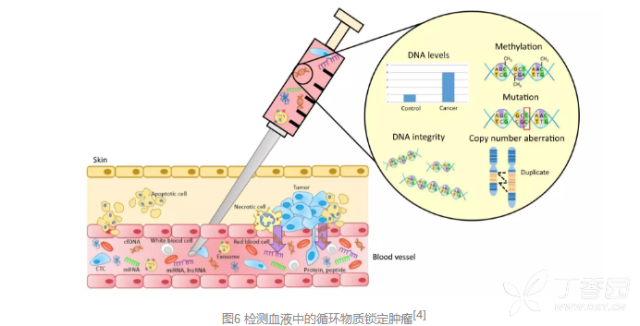
作为一种早期诊断的手段,自然需要有很高的特异性,否则没病的人被误诊为肿瘤,还不把人吓死?
同时,诊断的敏感性也不可或缺。由于早期肿瘤组织留在血液中的“线索”很少,受到技术手段的限制,要求检测出极微量的物质还有困难。然而,若不能检测出早期的肿瘤,那液体活检还有什么意义呢?
最后,则是要确定肿瘤的组织来源。不同的肿瘤可以有相同的基因突变,因此检测到循环血液中的突变并不能确定是什么肿瘤。

CancerSEEK的问世注定是不平凡的举动,它似乎预示着我们的“小少年”液体活检,要接受成年的洗礼了! Science发表的这项研究不仅很好地权衡了特异性和敏感性的两难,还能告诉我们肿瘤的组织来源。
在开发过程中,研究人员发现,通过联合检测多个基因突变扩增产物,能够更好地检测出肿瘤,提高敏感性。然而,这样的提升不是永无止境的,在纳入越来越多扩增产物用于检测的过程中,敏感性的提升变得越来越小,最后到检测大约60个扩增产物的时候,敏感性的提升进入了一个平台期。
也就是说,此时再检测更多的扩增产物已经无助于敏感性的提升,甚至会进一步降低特异性,影响诊断效率不说,还大大提高了成本。
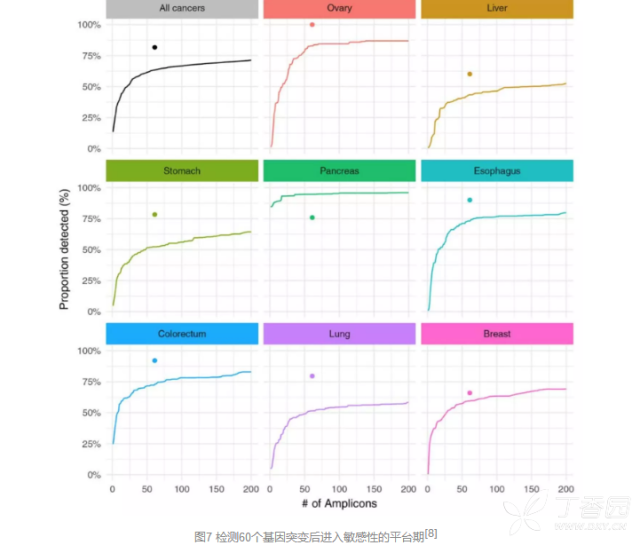
因此,为了兼顾敏感性与特异性,研究人员最终选取了16个癌症相关基因突变作为检测目标。 据估计,通过这些基因突变的61个扩增产物,可以识别出从肝癌(41%)到胰腺癌(95%)的一系列常见肿瘤。而在实践中,研究人员则发现这一检测手段的表现要好于预期,可以识别出60%肝癌,甚至100%的卵巢癌。
肿瘤检测需要解决的第二个问题则是肿瘤来源的问题。
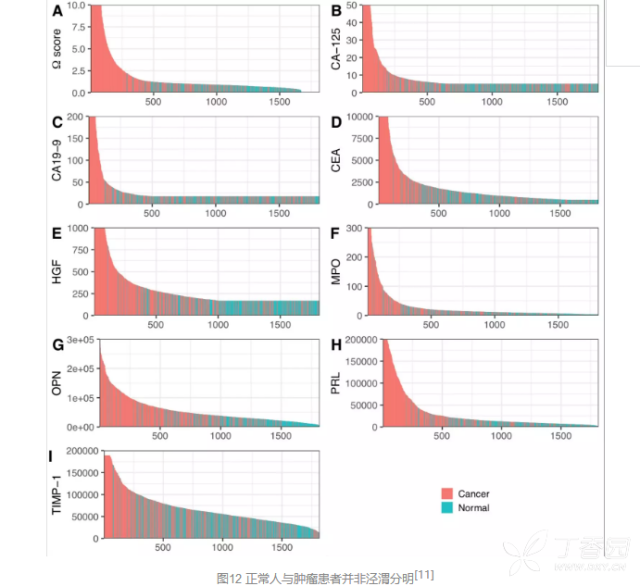
为了检测8种常见的肿瘤,研究人员从41种这些肿瘤的产物中精选出8种对于鉴别健康人和肿瘤患者特别有效的蛋白质,与先前的16个基因突变的61种扩增产物联合应用,获得极高的特异性(> 99%),在接受检测的812名健康人中仅有7人被“误诊”为肿瘤患者,假阳性率不足1%。
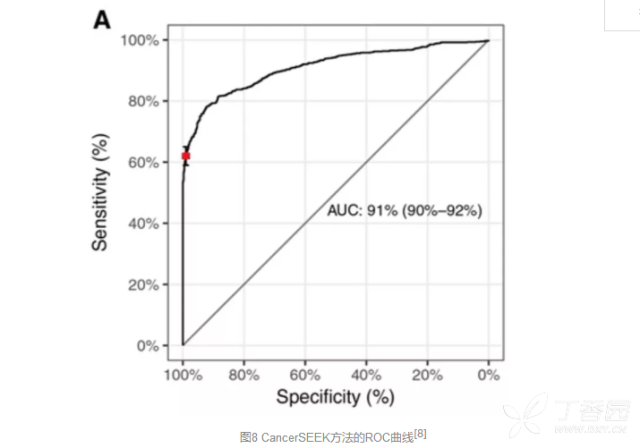
为了确定这一方法的敏感性,研究人员招募了1005名被诊断为I~III期卵巢癌、胃癌、胰腺癌、食道癌、结直肠癌、肺癌或乳腺癌的患者以及812名健康人作为对照,评估了他们血液样本中8种蛋白质的水平以及基因突变。 结果发现,CancerSEEK技术对于肿瘤检测的中位敏感性达到了70%(P < 10-96)!
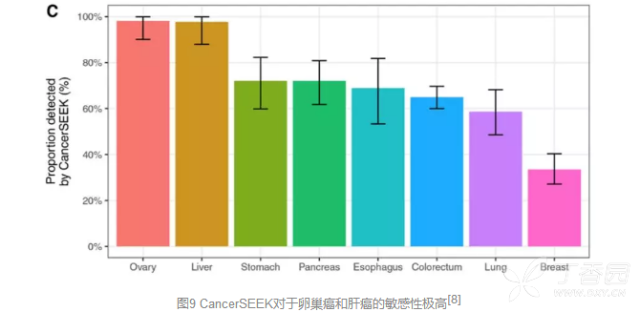
其中这一方法对于卵巢癌和肝癌的敏感性最高,随后则是胃癌、胰腺癌、食道癌和结直肠癌,均达到了60%以上。
对于肺癌(<60%)和乳腺癌(33%)的敏感性虽然稍差,但好在这些肿瘤还是能够通过胸部LDCT或乳腺摄片等其他手段来早期检测。
这项技术的另一个亮点是运用了机器学习(machine learning)方法,对于血液样本检测发现肿瘤蛋白升高或出现ctDNA基因突变的阳性患者进行肿瘤类型的识别。 结果发现,83%的肿瘤被锁定到了最可能的两种类型中,63%的肿瘤被直接正确定位。
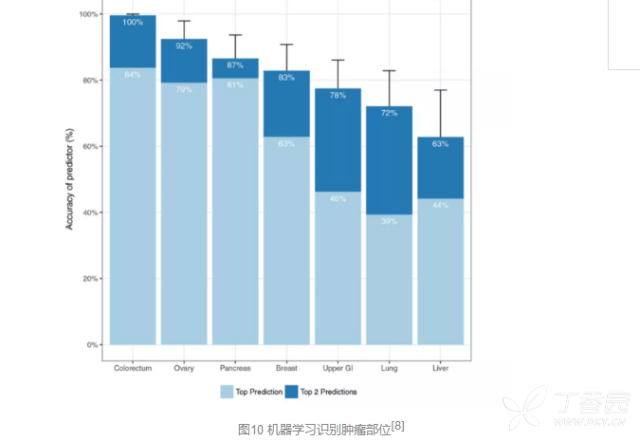
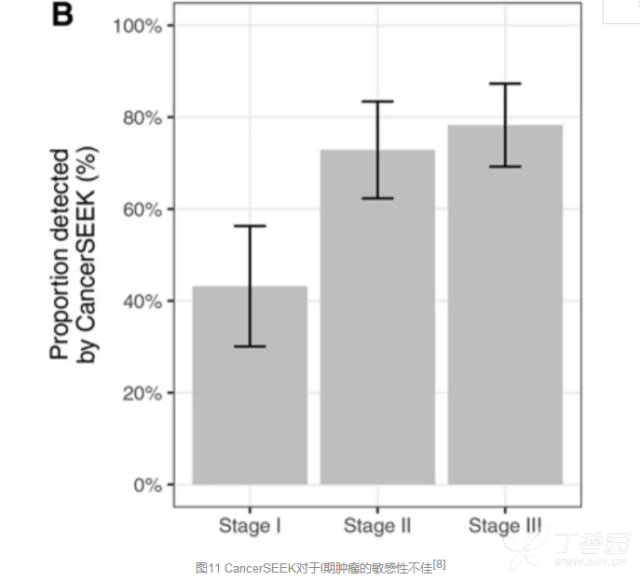
当然,没有一个人能360°无死角,这项技术也不免有小瑕疵。 分析其对于不同分期肿瘤的敏感性发现,这一方法对于II期和III期肿瘤的敏感性分别达到了73%和78%,但是对于更早期的I期肿瘤的敏感性则不尽如人意,仅有43%。在I期肿瘤的诊断中,敏感性最佳的肝癌达到了100%,然而对于I期食道癌的敏感性仅有20%。
总体上,CancerSEEK对于早期肿瘤的识别能力相比II期和III期肿瘤还是薄弱了些。
不过,这一技术的目标并不是单打独斗地确诊肿瘤,而是希望医生借助这些信息,选择更为合适的筛查和随访手段,为患者提供个性化的诊治,节约成本,提高效率。 当然,如果有朝一日液体活检技术能够被推广,我一定会兴奋地跑进医院: 来来来,赶紧给我抽管血测一测!

外行看热闹,内行看门道。作为一个水军,欢呼够了,也想听听专业人士的评论。无疑,这项技术未来在肿瘤早期检测上可能大有作为,但相关的评论[9]和报道[10]还是理性地分析了这项技术存在的局限性。

研究人员自己在文末[8]也提出,虽然这项技术检测多种肿瘤的成本可能低于500美元,甚至比检测单一肿瘤,比如通过结肠镜检测结直肠癌要更低,并且一次检测就能覆盖2017年占美国肿瘤死亡人数60%的八种肿瘤。 然而,为了证明其的确适用于临床还需要进行的大人群、前瞻性研究——五年内对五万名女性进行CancerSEEK检测以确定其在真实世界中的效用[9]。
实际上,即使CancerSEEK技术真的进入市场,肿瘤的诊断可能会首先“抽管血”,但不会是仅仅“抽管血”。
对于肿瘤的诊断,“拍张照”、“抽管血”都很难单独一锤定音,即使是最为准确的“挖块肉”也不仅仅是用肉眼观察组织,在显微镜下观察细胞那么简单,而是需要参考其他诸多检查的结果,甚至要把病人叫到面前好好地问问病史,摸摸肚子才能审慎地下结论。 各种检测手段并没有孰优孰劣,它们有的准确性高,但时效性欠佳;有的能够在很早就检测出疾病,但却更可能出现假阳性的结果。这些手段只有互相取长补短,选择最为合适的检查才能发挥出它们最大的效用。
界哥嘚啵嘚
吓出一身冷汗,还好懒癌不在检测之中,不然入职体检报告就露馅了……
参考文献
[1] Anderson, M. J. B., & Webb, A. J. (1987). Fine‐needleaspiration biopsy and the diagnosis of thyroid cancer. British Journal ofSurgery, 74(4), 292-6. [3] R. L. Siegel, K. D.Miller, A. Jemal. (2017). Cancer Statistics,2017. CA Cancer J. Clin. 67, 7–30. doi:10.3322/caac.21387. [4] Meo, A. D., Bartlett, J., Cheng, Y., Pasic, M. D.,& Yousef, G. M. (2017). Liquid biopsy: a step forward towards precisionmedicine in urologic malignancies. MolecularCancer,16(1), 80. doi: 10.1186/s12943-017-0644-5. [5] Shiyu Jia, Rui Zhang, Ziyang Li, & Jinming Li. (2017). Clinical andbiological signi cance of circulating tumor cells, circulating tumor DNA, andexosomes as biomarkers in colorectal cancer. Oncotarget, 2017, Vol. 8, (No. 33), pp: 55632-55645. doi:10.18632/oncotarget.17184. [6] Siegel R. L., Miller K. D., Jemal A. (2018). Cancer Statistics,2018. Ca A Cancer Journal for Clinicians, 2018;68:7–30. doi: 10.3322/caac.21442. [7] Noninvasive blood test may allow earlier detectionof eight common cancer types, Science, Jan 19, 2018. Available at: http://www.sciencemag.org Last assessed on 2018-01-20. [8] Cohen JD, Li L, …& Papadopoulos N. (2018).Detection and localization of surgically resectable cancers with amulti-analyte blood test. Science, published online January 18, 2018, eaar3247. doi: 10.1126/science.aar3247. 来源:医学界肿瘤频道
|  /3
/3 