2025年8月2日,由中国医药生物技术协会生物诊断技术分会主办,第二期生物诊断前沿技术专题会在江苏省无锡市惠山生命科技园召开。专题会聚焦CRISPR免扩增与非核酸检测技术。 生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。 本期分享同泽合信创始人欧阳卓君报告:《基于CRISPR的检测产品临床应用探索和注册申报路径》。 欧阳卓君,同泽合信(北京)医药科技有限公司创始人,拥有医学检验和公共卫生教育背景,10余年IVD临床试验和注册申报的项目管理和执行经验,带领团队成功交付了数百项的转化服务,包括肿瘤筛查第一证、新冠检测第一证、单分子测序仪第一证等。任中国医药生物技术协会理事、生物诊断技术分会常务委员、中国医疗器械行业协会IVD分会委员、疫苗行业协会标准化工作委员会委员等。以下为欧阳卓君的部分报告内容: 注:报告由生物诊断平台整理汇编,内容仅供学习参考。 基于CRISPR的检测产品临床应用探索和注册申报路径 目前CRISPR诊断技术仍处于临床应用探索阶段,尚未进入成熟期。 受新型冠状病毒疫情暴发影响,全球已有4款CRISPR诊断产品获得紧急授权,且均针对新冠检测,尚未实现大规模商业化成功。 在技术发展方面,研究者们已在免预扩增技术、多重检测技术、非核酸检测技术以及床旁检测技术等CRISPR检测领域取得进展,这些技术改进都是为了更好地满足临床需求。 在临床试验方面,通过检索国内外临床试验注册平台,目前与CRISPR诊断技术相关的临床研究数量仅有数十项。 从数据看,结核分枝杆菌检测是该技术应用相对较多的应用领域,其他应用方向还包括肠道病毒、烟曲霉等病原体检测,以及部分肿瘤相关检测。 尽管已有这些早期临床研究验证了CRISPR技术的应用潜力,但目前尚未形成正式的临床指南或专家共识推荐该技术用于临床诊断。国家药监局相关技术文章也指出,CRISPR诊断技术尚未找到其专属应用领域。 因此,从目前的应用现状看,CRISPR诊断技术发展迅速,但想要应用于临床诊断仍需明确其专属的应用场景及差异化的检测性能。 1、“转化三角” 模型 在产品研发转化过程中,我们提出了"转化三角"模型,该模型包含三个核心要素:临床需求、技术突破与合规验证。 首先,任何产品的开发都必须基于明确的临床需求,确保其能够解决实际诊疗问题。 其次,技术突破是实现临床需求的关键,需要通过创新性的技术手段来满足特定场景下的检测要求。然而,仅证明技术能够满足临床需求并不足够,还需要通过合规验证来获得监管认可。 合规验证要求研发者按照监管流程开展工程化研发、注册临床试验和注册检验等工作,确保产品符合相关技术标准与法规要求。 2、IVD新产品转化流程及注册申报资料
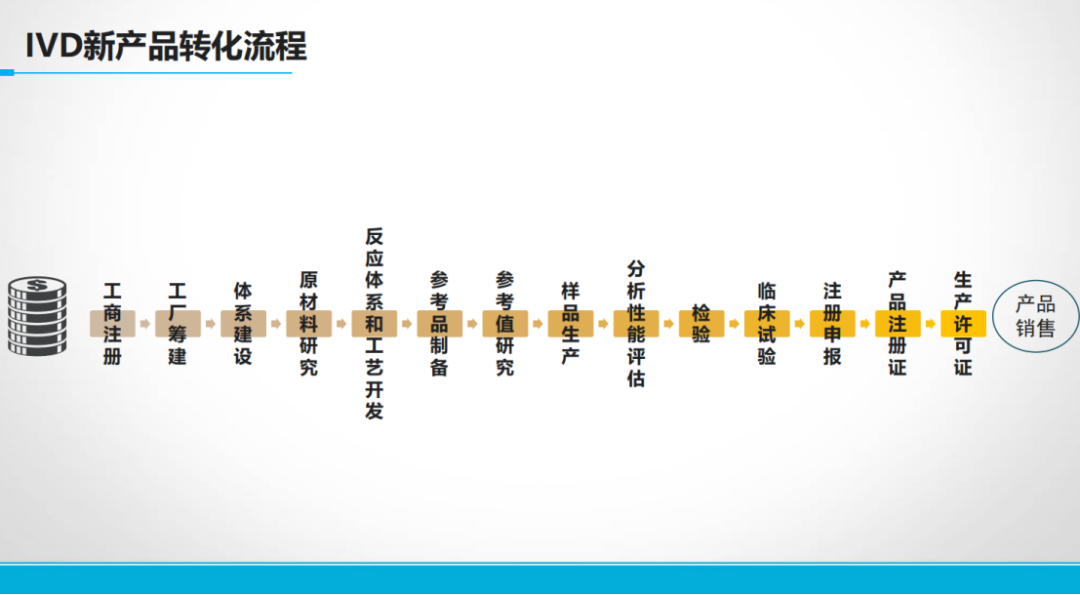
IVD新产品转化流程具有严格的顺序性和规范性。新产品转化过程中,需要遵循既定的注册流程和规则开展注册申报。 注册申报资料是研发工作的集中体现,例如产品说明书中的各项内容均需基于具体研究数据。检测结果的解释需依据阳性判断值研究,检测方法需明确样本要求、反应体系和检测流程等关键参数。每一份技术文件都应当反映研发过程中的质量控制与验证结果。 3、CRISPR技术转化中的关键点 监管机构对CRISPR等新技术的应用持审慎态度。 2021年国家药监局发布的文章指出,CRISPR诊断技术是否具有专属应用场景仍需进一步观察。监管审评过程中需重点关注向导RNA设计、信号剪切验证、脱靶效应等性能指标。 此外,产品内标设计也需符合特定要求,例如在RNA检测中,若选择管家基因作为内参,则引物/探针的设计必须确保仅能检测到mRNA而非gDNA(扩增产物),以避免质控失效。 针对特定病原体检测,监管机构(如WHO)对靶标设计提出了明确要求,例如新冠病毒和猴痘病毒仅接受双靶标(dual target)或三靶标(triple target)的检测方法。 以上数据表明,不同监管要求和临床需求对产品设计具有直接影响,研发过程中需充分考虑这些因素,以确保产品顺利通过审批并满足临床应用需求。 4、新产品临床研究需以临床价值为导向 临床试验是产品研发过程中耗时较长且投入较大的关键环节,其获批的核心在于充分证明产品的临床价值。 根据监管机构的分类标准,产品临床试验可分为两种类型: 对于已有同类产品上市的情况,只需参照现有产品证明其有效性即可,因为临床价值已通过同类产品得到验证; 而对于尚无同类产品获批的情况,则必须以临床价值为导向,通过科学合理的研究设计来验证产品在检测速度、灵敏度等方面的核心优势,从而获得监管认可。 临床价值的定义较为广泛,除检测性能外,还包括检测时间、可及性等多个维度。关键在于选择恰当的临床价值指标,并通过严谨的试验设计加以验证。 以今年年初获批的首个基于数字PCR平台的血流感染检测试剂盒为例,该产品的临床价值主要体现在两个方面: 然而,仅证明检测速度的优势并不足以获得监管认可。 当新技术的检出率高于金标准时,其结果通常会被认为是因特异性降低而产生的假阳性。此时需证明这种“假阳性”是产品高性能的体现。 “不好证真”是创新IVD产品上市的挑战 参考FDA类似检测产品的验证方案,需通过构建多层次的证据体系来证实检测结果的可靠性。 对于新方法阳性而血培养阴性的样本,采用了以下多级验证方式:可提供两周内采集的另一份血样再次进行血培养验证或对原始样本进行测序验证。 通过这种综合性的证据链,最终证实了新技术检出的"假阳性"实际为真阳性,从而获得了监管批准。 这一案例表明,针对创新产品的临床试验设计需要充分考虑监管要求,通过科学严谨的多维度验证来证明产品的临床价值。 创新产品研发中,产品优效性验证是关键 相对已有方法,创新产品会带来临床价值的显著提升。以数字PCR技术为例,学术界和监管机构普遍认为其灵敏度优于传统qPCR技术,故在产品申报时仍需通过严谨的优效性研究予以证实。 对于数字PCR仪,申报方可以深度测序作为参照系统,将考核产品与之比较获得阳性符合率,同时以市售荧光PCR产品为对照进行平行比较,通过优效性检验证明灵敏度优势。 这一验证过程不可或缺,因为技术审评不仅基于申报方陈述,更需依据专家共识和指南文件进行判断。 新方法的灵敏度不一定越高越好 值得注意的是,并非所有检测场景都需要追求高灵敏度。 临床价值的评估应当综合考虑实际诊疗需求,例如在宫颈癌筛查中,检测方法的重点在于区分癌前病变患者(CN2+及以上),而非单纯识别HPV感染。过高的灵敏度可能导至阳性预测值下降,反而影响临床决策。 此外,可及性因素同样至关重要。以结核病诊断为例,即时检测(POCT)试剂虽然灵敏度可能低于实验室检测方法,但其更高的可及性能够显著提升整体防控效果。 因此,创新产品设计过程中,需要充分结合产品的临床价值定位,在考虑提升检测灵敏度的同时,也需要同步关注检测的可及性。 世界卫生组织(WHO)对非痰液结核检测的推荐标准(灵敏度≥65%)正是这一理念的体现。 同时,在产品设计时,应当合理设定灵敏度目标值,并充分考虑目标人群的多样性,包括HIV感染者、无法采集痰液样本的患者等特殊群体。通过科学的临床试验设计,在满足监管要求的同时,最大化产品的临床实用价值。 针对创新医疗器械注册申报周期长、投入大的问题,监管机构已通过多种途径提供加速审批支持。 以Intelligenome产品为例,该产品于今年年初获得FDA"突破性医疗器械"称号后,即可享受FDA的优先评审和临床方案指导等支持。 同样,中国的创新医疗器械产品在审批流程中也能获得相应政策支持,实际审批时间较非创新产品会有一定缩短。 通过对比创新与非创新产品的审批时长差异可见,进入创新通道的产品平均审批时间为17个月,而未进入创新通道且尚无同类产品的则平均约需25个月。
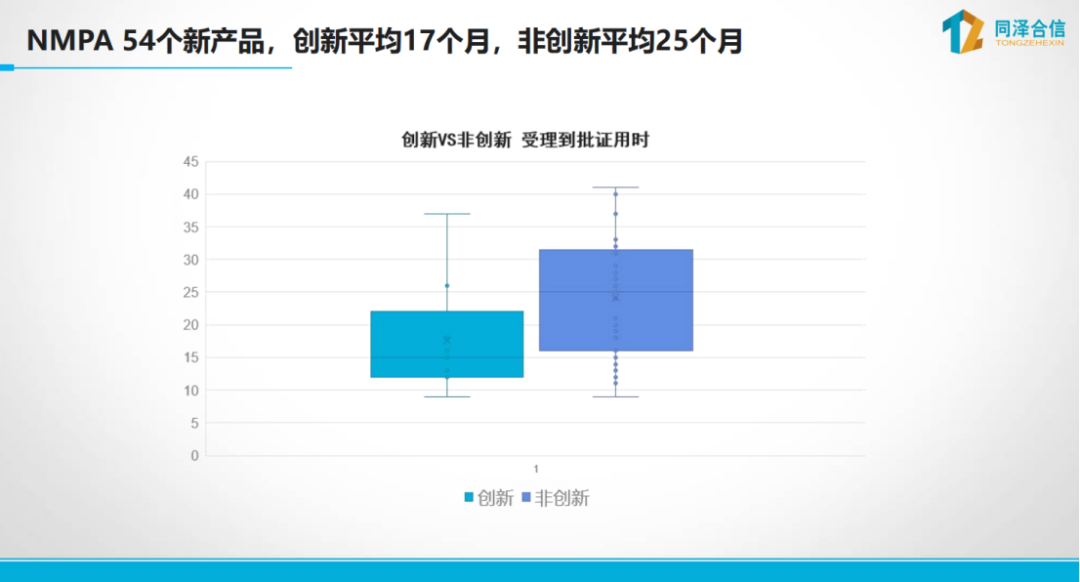
同泽合信以往成功案例中,武汉凯德维斯的创新产品仅用6个月便完成从受理到获批的全流程,创下国内最快纪录;诺辉健康的肠癌早筛产品作为同类首个获批产品,耗时9个月完成审批。 监管部门还通过多项政策优化注册流程,包括实施注册人制度、允许委托研发与生产、接受自检或第三方机构检测报告等。 在已有成熟产品中,也可能豁免临床试验或接受境外临床数据等。注册人制度的实施尤其重要,它实现了注册主体与生产主体的解绑,为研发机构提供了更大的灵活性。 需要强调的是,尽管存在多种加速途径,但监管机构始终坚持"标准不降低、流程不减少"的原则。 创新产品的审批提速主要源于监管部门的优先资源配置和专业指导,而非降低技术要求。 因此,企业应当充分理解监管要求,结合专业经验与科学管理工具提升申报效率。 在具体实施过程中,可参考"转化三角"理念,整合临床需求、技术突破与合规验证三大要素,借助专业团队的经验积累和案例库支持,系统性地优化注册申报策略,从而实现更高效的转化路径。
|  /3
/3 