|
2016年10月20日, 国家食品药品监督管理总局医疗器械技术审评中心(CMDE)发布关于《医疗器械技术审评咨询管理规范》及试运行的通知,《规范》自发布之日起实施。《规范》规定申请人或注册人不得私自进入非咨询接待的办公区域咨询答疑。。。为确保对外咨询工作平稳过渡,《规范》将与原来周四公开日的方式同步试运行三个月。
今年5月20日,CMDE发布关于公开征求《医疗器械技术审评咨询管理规范》意见的通知。与征求意见稿相比,正式稿中删除了网上咨询最多1次的规定;除此之外,两稿几乎无差别。以下是小编对《医疗器械技术审评咨询管理规范》的简要整理,供参考:
Scope? 咨询范围?主要针对提出注册申请及处于发补状态的医疗器械注册项目,申请人或注册人收到我中心发出的补正资料通知单后,在补回资料前,针对通知单相关内容进行沟通和答疑。咨询中不对申请人或注册人拟提交的补充资料具体内容进行确认。注册申请的技术审评结论以申请人或注册人正式提交的补充资料为依据。
不适用范围?按照《医疗器械应急审批程序》、《创新医疗器械特别审批程序(试行)》或其他有关规定办理的项目,其注册技术审评咨询工作另行安排。
How?如何咨询? 《规范》为申请人提供了3种咨询途径:现场咨询、网上咨询、电话咨询。同时CMDE将汇总共性问题,每季度进行发布。根据《规范》要求,凡进行现场咨询和网上咨询的,需要通过中心官方网站(www.cmde.org.cn)审评咨询专栏提交咨询申请。以下是3种咨询方式的对比:
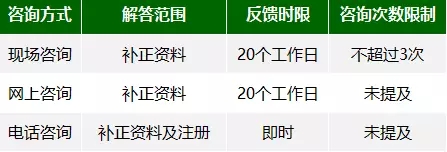
再来看每种咨询方式的具体情况:
现场咨询 次数限制:每个符合要求的受理号申请现场咨询的机会原则上不超过3次。 现场咨询时间:周四9:00-11:30、13:30-16:30进行。原则上针对每个咨询申请的答疑时间不超过半小时。 答复时限:原则上应在收到预约申请之日起20 个工作日内完成现场咨询。 申请流程:
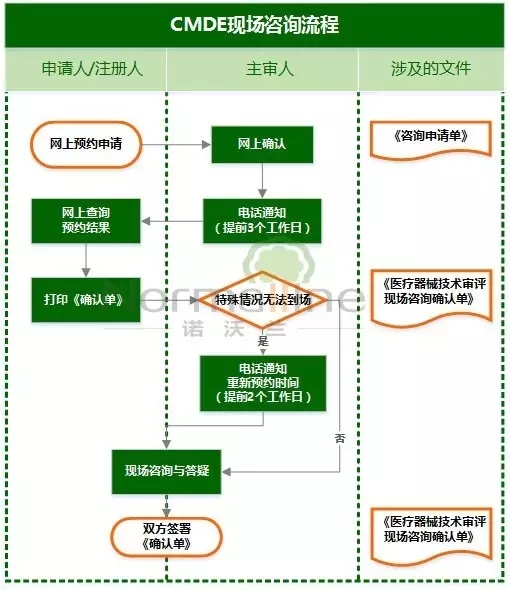
特殊情况: 1,主审人遇特殊情况无法在预约时间到场答疑,原则上应提前 2 个工作日与预约申请人进行沟通,重新确认现场咨询时段。
2,主审人因病假、调岗等原因长时间无法进行现场答疑的,审评部负责人应做好相应的调整工作。
网上咨询 适用情况:解决相对简单、易于答复的注册咨询问题。 答复时限:原则上应在收到申请之日起 20 个工作日内完成在线答疑。 特殊情况: 1.如有必要,主审人回复意见可先征得审评部负责人(或技术委员会分会)确认后,再行网上提交。
2.如主审人认为现场咨询方式更有利于解决申请人或注册人的咨询问题,可将网上咨询转为现场咨询。
电话咨询 适用情况:主要针对补正资料通知单内容进行咨询,对医疗器械注册技术审评相关的咨询问题可做适当解答。 咨询时间:周一和周三下午15:30~16:30进行 咨询电话:审评人员办公电话可通过中心网站审评人员公示栏目查询。(文末也有详细的名单及联系方式哟!)
特殊情况:如有必要,审评人员可引导申请人或注册人通过中心网站咨询平台进行预约,以现场咨询的方式解决问题。
共性问题解答 适用情形:对一段时间内重复出现、具有共性的咨询问题,主审人应对咨询问题进行汇总分析,各审评部应定期进行总结归纳,经审评部负责人(或技术委员会分会)确认后,统一进行解答。 解答频率:原则上每季度对外发布一次。 特殊情况:审评部负责人(或技术委员会分会)认为需要通过中心技术委员会讨论决定的,按照相关程序经中心技术委员会研究决定后再行发布。
Why?目的?为提高医疗器械注册技术审评咨询工作的质量和效率,规范医疗器械技术审评中心对外咨询工作,结合中心技术审评工作实际情况,制定本规范。 Who & where?监管部门&监管范围?质量管理处负责咨询工作的综合管理,各审评部负责本部门咨询的管理,办公室负责中心网站咨询平台的技术保障工作。
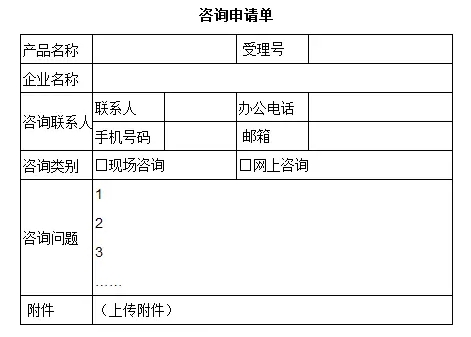
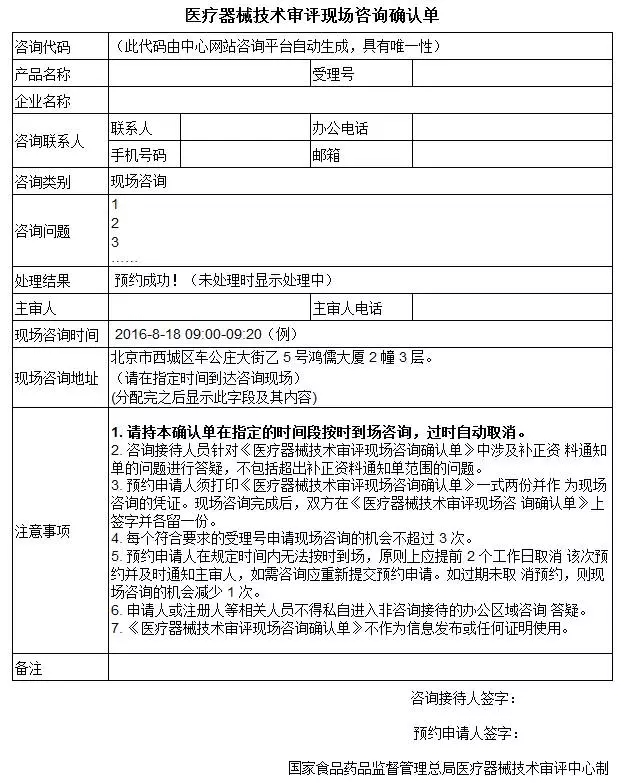
以下是现场咨询需要填写及打印的表单样式(点击屏幕左下方“阅读原文”,可跳转至CMDE官网下载):
咨询申请单
医疗器械技术审评现场咨询确认单
现行的每周四公开日的相关信息如下:
现场咨询时间:每周四上午8:30-11:00,下午1:00-4:00 咨询地点:西城区车公庄大街乙5号鸿儒大厦2幢3层。 咨询现场电话:

医疗器械技术审评中心审评工作人员公示
来源:CMDRA |  /3
/3 