登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
复发和转移是癌症死亡的两个主要原因。因此,早期准确的癌症诊断便显得尤为重要。目前,用于探测癌症的工具主要有哪些?纳米技术的发展又为癌症探测带来哪些进展呢?
小 M 为大家总结了目前癌症的探测工具,我们先一起简单了解下吧~
1. 用于确定癌症分期及其精确位置的一些成像辅助手段:
磁共振成像 (Magnetic resonance imaging, MRI)、正电子发射断层扫描 (Positron emission tomography, PET)、单光子发射计算机断层扫描 (Single photon emission computed tomography, SPECT)、计算机断层扫描 (Computed tomography, CT) 和光学成像等。
2. 光学成像:用于癌细胞在分子水平的可视化。
用于光学成像的荧光探针可以被设计成可激活的,这意味着它们只会在某些条件下“打开”。这种探针被设计成只有在与目标组织结合后才会发出信号,这大大提高了检测疾病的灵敏度和特异性。
3. 传统的成像方法
如血管造影、CT、MRI 和放射性核素成像,依赖于造影剂,如碘、钆和放射性同位素。
此外,2023 年化学家 Moungi G. Bawendi、Louis E. Brus 和物理学家 Alexei I. Ekimov 因“发现和合成量子点”荣获诺贝尔化学奖。这使得荧光量子点进入了更多人的视野中。
图 1. 2023 年荣获诺贝尔化学奖的科学家。 
量子点 (Quantum dots,QDs),一种发光纳米晶体 (Nanocrystals, NCs),可为治疗药物、蛋白质、肽、寡核苷酸和基因的受控递送后的生物系统成像提供多功能平台。这些具有综合成像和载体功能的工程荧光探针已成为分子诊断和治疗分子递送的“好帮手”!
图 2. 量子点结构。
Tips:关于量子点,你需要了解哪些?
1)量子点是近乎球形的 NC,实际上是由半导体材料组成的。这些半导体是由 Ⅱ~Ⅵ 族或 Ⅲ~V 族元素组成的发光纳米晶体,一般为球形或类球形,稳定直径在 2~10 nm,能够接受激发光产生荧光的一类半导体纳米颗粒。
2)在元素周期表中的所有基团中,最有趣的是 II-VI,因为它们具有独特的光学和电子性质。包括 (CdSe)、 (CdSe)、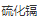 (CdS)、 (CdS)、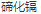 (CdTe)、 (CdTe)、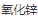 (ZnO)、 (ZnO)、 (ZnS)、 (ZnS)、 (ZnSe) 和 (ZnSe) 和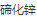 (ZnTe) 等材料。其中研究较多的主要是 CdX (x=S、Se、Te)。 (ZnTe) 等材料。其中研究较多的主要是 CdX (x=S、Se、Te)。
3)量子点具有宽连续吸收光谱、窄发射光谱、高光稳定性等独特的发光特性和电子特性。其发射波长可以通过改变它们的大小和组成来调节 (量子点尺寸的减小导至能隙的增大,导至发射波长的蓝移),这也代表单个光源同时激发所有颜色的量子点[1]。因此量子点的应用十分广泛。

▐ 近红外荧光特性
生物化合物和组织 (如血液、脂肪和皮肤) 都能特定地吸收和散射不同程度的任何入射光。因此动物体内的自发荧光本身会干扰标记目标荧光效果,II-VI 族和 IV-VI 族量子点具有近红外荧光性质,近红外 Ⅱ 区荧光 (波长 1000~1700 nm) 存在着更高的空间分辨率、更深的穿透生物基质的深度、较低的光学吸收和散射,可以很好的避免机体自发荧光干扰[2]。
图 3. 代表性的量子点核心材料的发射波长信号[2]。
(A)代表性的量子点核心材料作为其发射波长叠加在光谱上的函数缩放。(B)六种不同量子点色散的吸收和发射。黑线表示 510-nm 发射量子点的吸收。
▐ 荧光稳定性高
量子点由于其独特的晶体结构具体极高的稳定性,6PEG-Ag2S QD 在磷酸盐缓冲盐水 (PBS) 中可溶且物理稳定 10 个月以上 (图 4A)。808 nm 激发时,在 1.0-1.4 μm NIR-II 区域保持高荧光 (图 4B)。6PEG-Ag2S QD 溶液的紫外/可见/近红外吸收光谱显示,在较短波长处的吸收增加 (图 4C)。6PEG-Ag2S QD 溶液的光致发光与激发 (PLE) 光谱显示,Ag2S QD 的发射集中在 1200 nm 处 (图 4D),与激发无关。测定 6PEG-Ag2S QD 量子点的荧光量子产率约为 15.5%[3]。

图 4. 具有支化 PEG 涂层的 NIR-II Ag2S 量子点[3]。
此外,采用 808 nm 激光二极管连续照射 6PEG-Ag2S QD 溶液,测试其光稳定性。NIR-II 的光致发光 (PL) 强度在前 200 s 有所下降,但在连续照射 0.5 h 后稳定并保持在初始 PL 强度的 50% 以上。荧光信号值可保留 3 年以上。

一般来讲,癌症治疗效果和诊断成像功能都可以通过一个具有高度多功能性的单载纳米结构系统来实现。纳米载体必须经过适当的设计,使其能够方便地装载以进行药物控制释放,表现出更好的血液循环和更高的生物利用度,并绕过多药耐药机制。图 5 表示治疗性载体的标准结构及其靶向配体细胞穿透配体纳米粒子 (成像/检测) 治疗组件聚合物。
图 5. 经典量子点作为治疗载体的模型[1]。 具有不同几何形状表示的所有可能的附着物,即绿色荧光球作为检测组件 (纳米颗粒 [NPs] 的无侵入性成像),靶向配体如抗体,肽,转移蛋白,叶酸 (梯形头基团),治疗组件如核酸,药物,热药,光敏剂 (星形头基团),细胞穿透配体,如极性和非极性氨基酸,适体 (箭头基团),以及主要由聚乙二醇,蛋白质和葡聚糖包裹的聚合物。
注意:相同的几何形状代表相同类别的成分,作为多个靶向配体或穿透配体,可以在纳米颗粒表面功能化,用于多路应用。不同的颜色被用来区分。
▐ 量子点探针在肿瘤血管生成中的应用
肿瘤血管生成是肿瘤的标志,在不同类型的实体瘤中普遍存在,如果没有血管生成提供肿瘤生长所需的氧气和营养物质,肿瘤只能生长到 2-3 mm 的直径,因此,抑制肿瘤血管生成是肿瘤治疗的一种有效策略。
Chenghua Song 等人提出了一种新型纳米药物 (T&D@RGD-AgS),将广谱内皮抑制剂 TNP-470 和化疗药物 Doxorubicin(DOX) 封装到磷脂聚乙二醇(PEG)-Ag2S 量子点中,并通过简单的自组装过程与靶向肿瘤血管的特异性识别肽环 (Arg-Gly-Asp-d-Phe-Cys) (cRGD) 结合,协同肿瘤治疗。通过荧光信号值判断 T&D@RGD-Ag2S 靶向肿瘤血管的能力[4]。
图 6. T&D@RGD-Ag2S 的肿瘤脉管系统靶向测定[4]。 (A) 为肿瘤供血的肿瘤血管的明场和 NIR-II 荧光图像。(B) 注射 T&D@RGD-Ag2S (上) 和 T&D@Ag2S (下) 的 U87-MG 荷瘤裸鼠的 NIR-II 荧光时程。(C) 随着时间的推移,TBR 由 NIR-II 荧光强度确定,使用以下公式:TBR =(肿瘤强度 - 噪声强度平均值)/(背景强度 - 噪声强度平均值)。所选区域如图 B 所示。(D) 小鼠注射 T&D@RGD-Ag2S(上) 和 T&D@Ag2S (下) 24 小时后获得的组织和器官的离体明场和荧光图像。
如图所示,T&D@RGD-Ag2S 经静脉注射后进入循环,在 U87-MG 载瘤裸鼠的肿瘤周围,10 分钟内观察到 T&D@RGD-Ag2S 强烈的荧光信号 (图 6A)。同时,观察到肿瘤区域 T&D@RGD-Ag2S 积累的稳定增加 (图 6B-C)。各种组织和器官的离体图像进一步证实了与非靶向组相比,靶向组肿瘤中纳米颗粒的积累更高 (图 6D),这表明 cRGD 在纳米系统靶向递送中的重要作用。
此外,利用 Ag2S 量子点近红外 II (NIR-II) 荧光成像原位监测 T&D@ RGD-Ag2S 抑制肿瘤生长和降低血管密度的治疗效果。这种肿瘤血管靶向策略可以扩展为治疗广泛肿瘤的一般方法,并有望在未来的临床应用中得到应用。
MCE 相关产品

参看文献:
[1] Tripathi SK, et al. Quantum Dots and their Potential Role in Cancer Theranostics. Crit Rev Ther Drug Carrier Syst. 2015;32(6):461-502.
[2] Medintz IL, et al. Quantum dot bioconjugates for imaging, labelling and sensing. Nat Mater. 2005 Jun;4(6):435-46.
[3] Hong G, et al. In vivo fluorescence imaging with Ag2S quantum dots in the second near-infrared region. Angew Chem Int Ed Engl. 2012 Sep 24;51(39):9818-21.
[4] Chenghua Song, et al. Enhanced Nanodrug Delivery to Solid Tumors Based on a Tumor Vasculature-Targeted Strategy. Adv. Funct. Mater. 2016, 26, 4192–4200.
|  /3
/3 