登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×

癌细胞为了躲避免疫系统的追杀,进化出了许多多多多不同的策略来逃逸免疫。近期,研究揭示了癌细胞逃避免疫的新策略!跟小 M 一起来看下吧! 
Section.01 线粒体转移的"双向奔赴"
肿瘤微环境 (TME) 中的代谢重编程对抗肿瘤免疫反应至关重要,且线粒体在代谢重编程中起着重要作用。
先前,Tanmoy Saha 等人首次研究了癌细胞和免疫细胞之间的线粒体运输[1],发现癌细胞可以通过纳米管介导“偷走”免疫细胞线粒体。线粒体的丢失和功能障碍导至 T 细胞衰竭,这是 T 细胞免疫疗法的主要障碍。不过,研究人员发现,骨髓基质细胞 (BMSC) 与 T 细胞也可建立纳米管连接,并利用其将基质细胞线粒体移植到 CD8+ T 细胞中,使其变身“超强 T 细胞”,介导更强劲的肿瘤消退[2]。
图 1. 纳米管介导线粒体转移[1][2]。 (A) MitoTracker-Green 标记的线粒体从免疫细胞转移到癌细胞; (B) 细胞间纳米管介导线粒体从 BMSC 运输到 CD8+ T 细胞。
随着不断探索,人们对肿瘤免疫的研究也陆续有了新进程:从线粒体转移是从免疫细胞到癌细胞的单向运输,到发现线粒体也可以从癌细胞转移到 TME 的 T 细胞中,形成 ”双向奔赴”。然而,这一过程的发生与肿瘤免疫之间的影响尚不清楚[3]。
Section.02 Nature 发文: mtDNA 功能再升级!
近期,Nature 刊发日本千叶癌症研究中心等团队的重磅研究,首次揭示肿瘤细胞通过线粒体向 T 细胞传递突变的线粒体 DNA (mtDNA),导至 T 细胞代谢异常、功能衰竭,进而逃避免疫攻击的全新机制[4]。这一发现为理解肿瘤免疫逃逸提供了全新视角,并为逆转免疫治疗耐药提供了潜在靶点。 图 2. 线粒体在细胞间的双向转移[5]。
具体来说,Ikeda 等人研究了线粒体在癌细胞和免疫系统 T 细胞之间的转移,研究对象包括小鼠和人类细胞。作者报告称,T 细胞通过一种名为隧道纳米管的结构将线粒体转移到癌细胞中。作为交换,癌细胞通过释放细胞外囊泡将线粒体转移到 T 细胞中,这些囊泡会被细胞吸收。这些来自癌细胞的线粒体被 USP30 蛋白包裹,这种蛋白可以防止线粒体降解。这使得癌细胞的线粒体能够取代 T 细胞的线粒体。T 细胞进入一种称为衰老的生长停滞状态,从而削弱其杀死癌细胞的能力[5]。
1. 临床样本分析研究人员从黑色素瘤和非小细胞肺癌 (NSCLC) 患者的肿瘤组织中分离肿瘤浸润淋巴细胞 (TILs),通过全 mtDNA 测序鉴定突变,鉴定出 TILs 与肿瘤细胞的 mtDNA 共享突变。 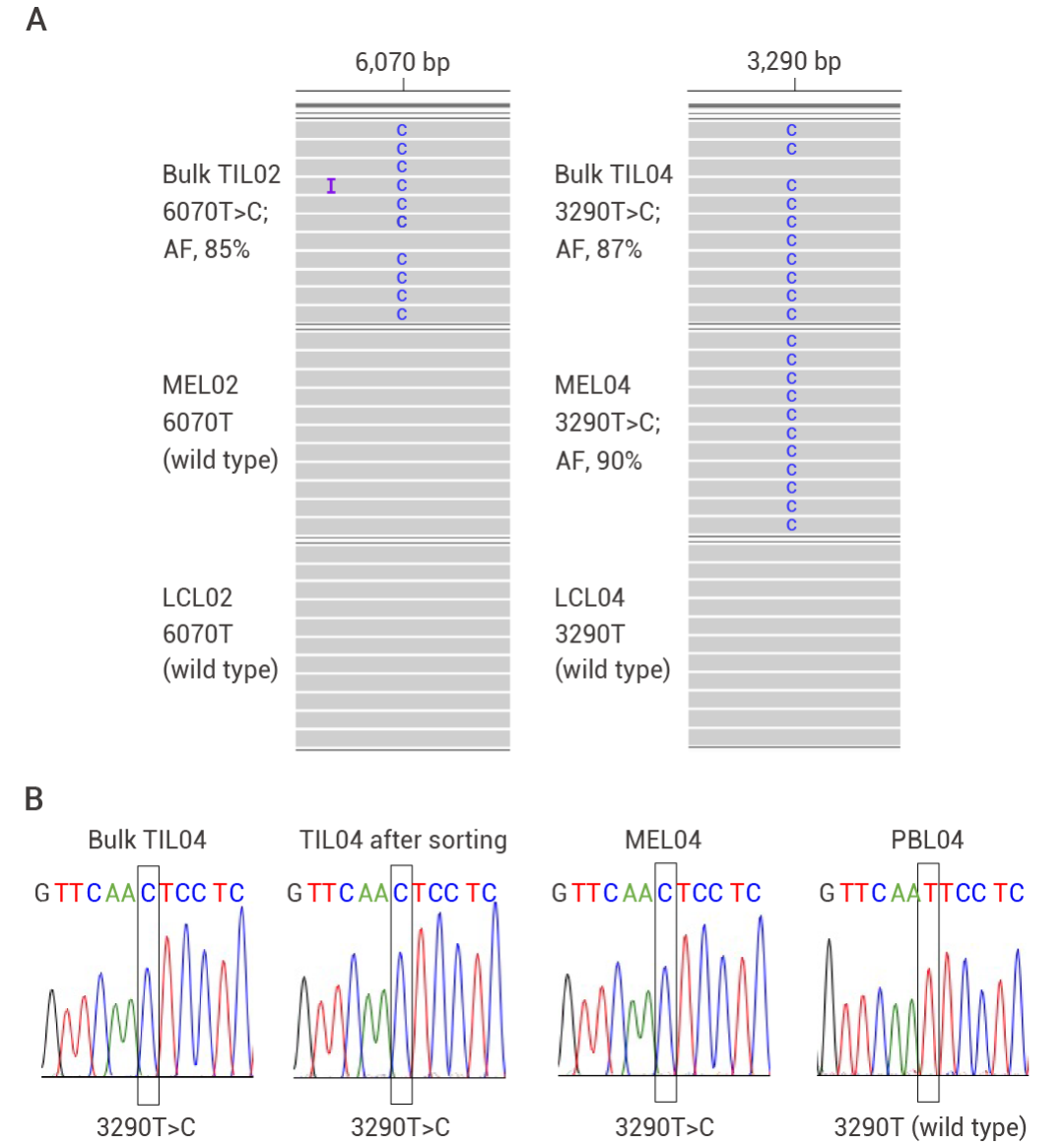
图 3. TILs 中与癌细胞相同的突变[4]。
2. 癌细胞的线粒体转移研究人员通过在含有突变 mtDNA 和 WT mtDNA 的黑色素瘤细胞系中的表达线粒体特异性荧光蛋白 MitoDsRed,在与 TIL 共培养 24 小时后,发现 mtDNA 逐渐从癌细胞转移至 TIL。这一结果表明癌细胞和 T 细胞之间产生同样的 mtDNA 突变是由线粒体转移造成的。
已有研究证明,细胞间的隧道纳米管 (TNTs) 和细胞外囊泡 (EVs) 能够帮助线粒体转移。研究人员发现在加入 TNT 和 EV 抑制剂的条件下,均能够大大降低线粒体的转移,这说明线粒体可以通过 TNT 介导的细胞间直接接触和 EV 介导的间接接触进行转移。综上所述,TILs 能够通过直接或间接的方式从癌细胞中获得突变 mtDNA。 图 4. mtDNA 突变的线粒体从癌细胞转移到 TILs[4]。
3. 线粒体发生同质性随后研究人员验证了转移的线粒体是否会发生同质性。通过将 TIL 与癌细胞共培养,并通过 mtDNA 测序以及荧光标记的延时成像,验证了部分 T 细胞的线粒体发生了同源替换以及线粒体的转移。并结合 MitoDsRed 的表达情况,进一步证明 T 细胞的原位线粒体的减少是与癌细胞共培养的结果。
TME 中的癌症来源的活性氧 (ROS) 会诱导周围细胞的线粒体发生自噬。研究人员发现,在与癌细胞共培养时会加剧 T 细胞的线粒体自噬,加入 NAC (一种 ROS 抑制剂) 后,降低 T 细胞线粒体自噬水平,但不影响线粒体从癌细胞转移到 T 细胞。去泛素化酶 USP30 能够抑制泛素化介导的线粒体自噬并附着在线粒体上,研究人员发现 USP30 在黑色素瘤中高表达,且在具有突变 mtDNA 的 T 细胞中的表达量也有所增加,USP30 染色结果证明,USP30 能够和线粒体一同从癌细胞转移到 TIL 中。
以上结果表明,T 细胞中的原位线粒体会因 TME 中的 ROS 发生自噬,但 T 细胞中有突变 mtDNA 的线粒体不会发生自噬,最终导至线粒体发生同质性。
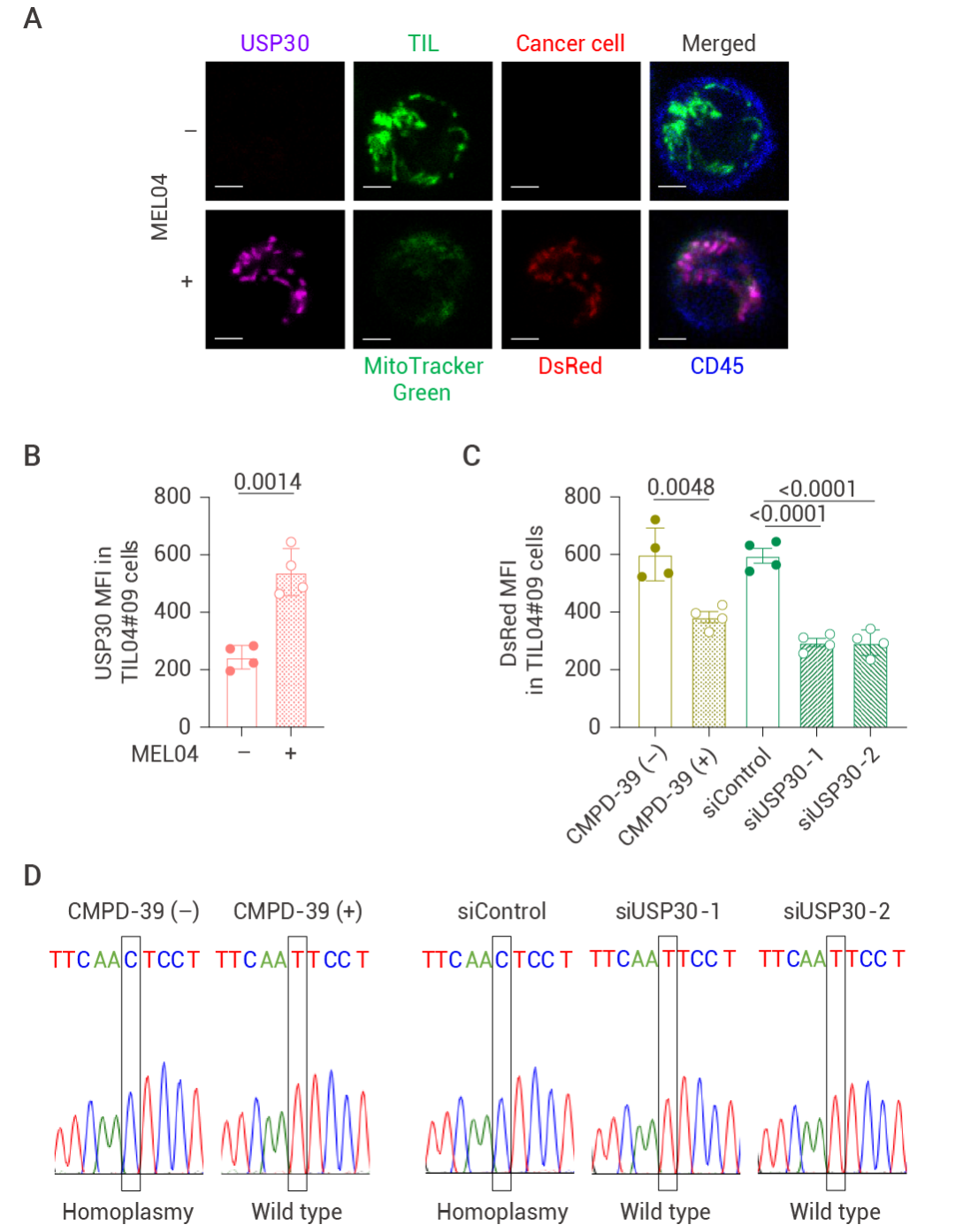
图 5. USP30 在癌细胞转移的线粒体中赋予线粒体自噬抗性[4]。
4. 突变 T 细胞的线粒体功能障碍研究人员随后通过通量分析仪以及基因表达水平研究发现,在 mtDNA 突变的细胞中线粒体氧化磷酸化相关分子 ND4,ND5,ND6,ND1,CYTB,COX1 和 ATP6 的表达量降低,细胞基础呼吸减少,产生的 ATP 减少,电子传递链上复合物活性降低,以上结果表明 mtDNA 突变的细胞线粒体功能受损。此外,突变的 mtDNA 增加了以及衰老相关分子的表达、降低细胞分裂能力,损伤记忆 T 细胞形成、诱导部分中央记忆细胞的凋亡、降低细胞中的活化标志物的含量。
5. 体内转移和抗肿瘤免疫随后在体内实验中,研究人员将 mtDNA 未突变的细胞系和 mtDNA 突变的细胞系分别移植到 OT-1 小鼠体内,由于 OT-1 小鼠可在体内激活 T 细胞和 B 细胞反应,随后从小鼠体内分选出 T 细胞以检测其免疫功能。实验结果表明伴有 mtDNA 突变的癌症细胞对 T 细胞活性的降低更为显著。然而,当分选出 T 细胞进行体外培养,荧光强弱显示出 T 细胞损伤的功能也得到了恢复,这一结论也进一步呼应了此前验证的 EV 在线粒体转移的过程中发挥关键作用。此外,在外加 EV 抑制剂 GW4869 时,相关功能抑制表型有所挽救。
总的来说, 体内实验中 TIL 突变的 mtDNA 线粒体可导至 T 细胞功能障碍,最终降低机体的抗肿瘤免疫能力。
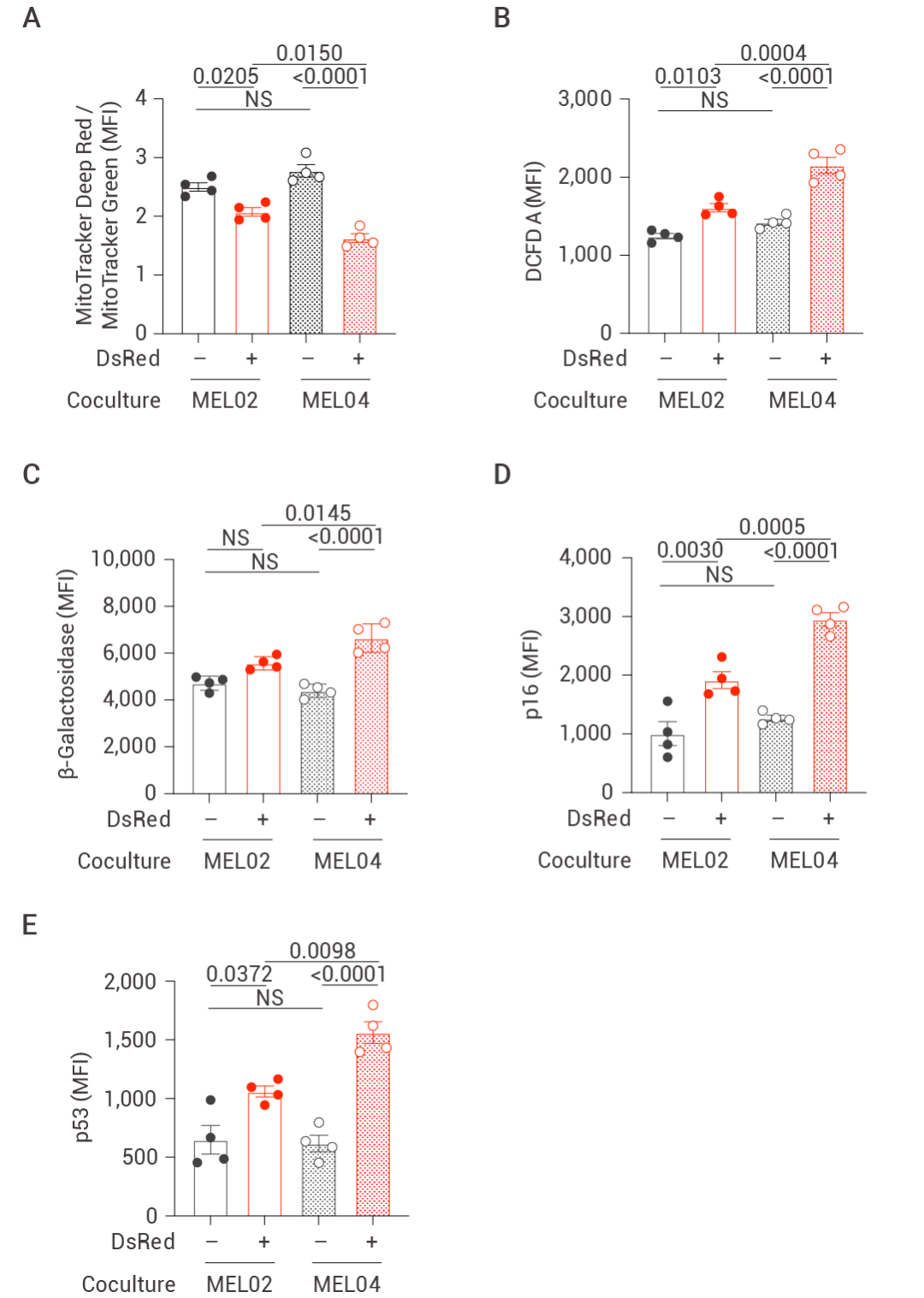
图 6. mtDNA 突变的线粒体转移降低体内抗肿瘤免疫[4]。
Section.03 小结
本文解析了癌细胞如何通过线粒体转移机制实现免疫逃逸,并探讨了其对肿瘤免疫治疗的影响。线粒体转移不仅改变了 T 细胞的代谢状态,还加速了 T 细胞衰竭,最终削弱抗肿瘤免疫力。这一发现为未来癌症免疫治疗提供了新的研究方向,也希望能帮助看到这里的小伙伴拓展新的科研思路~
[1] Saha T, et al. Intercellular nanotubes mediate mitochondrial trafficking between cancer and immune cells. Nat Nanotechnol. 2022 Jan;17(1):98-106. [2] Baldwin JG, et al. Intercellular nanotube-mediated mitochondrial transfer enhances T cell metabolic fitness and antitumor efficacy. Cell. 2024 Nov 14;187(23):6614-6630.e21. [3] Mahmood M, et al. Mitochondrial DNA mutations drive aerobic glycolysis to enhance checkpoint blockade response in melanoma. Nat Cancer. 2024 Apr;5(4):659-672. [4] Ikeda H, et al. Immune evasion through mitochondrial transfer in the tumour microenvironment. Nature. 2025 Feb;638(8049):225-236. [5] Brestoff JR. Mitochondrial swap from cancer to immune cells thwarts anti-tumour defences. Nature. 2025 Feb;638(8049):42-43.
|  /3
/3 