|
申请人对于“预评价”并不陌生,早在2010年11月25日,原国家食品药品监督管理局就颁布了《医疗器械检测机构开展医疗器械产品标准预评价工作规定(试行)》。申请人依据现行法规获得的注册检测报告中都应该包括加盖医疗器械检测机构印章和骑缝章的《拟申请注册医疗器械产品标准预评价意见表》。 2014年8月21日,国家食品药品监督管理总局颁布《医疗器械检验机构开展医疗器械产品技术要求预评价工作规定》与4年前的要求有什么不同呢?请看下表对两个版本进行的比较。 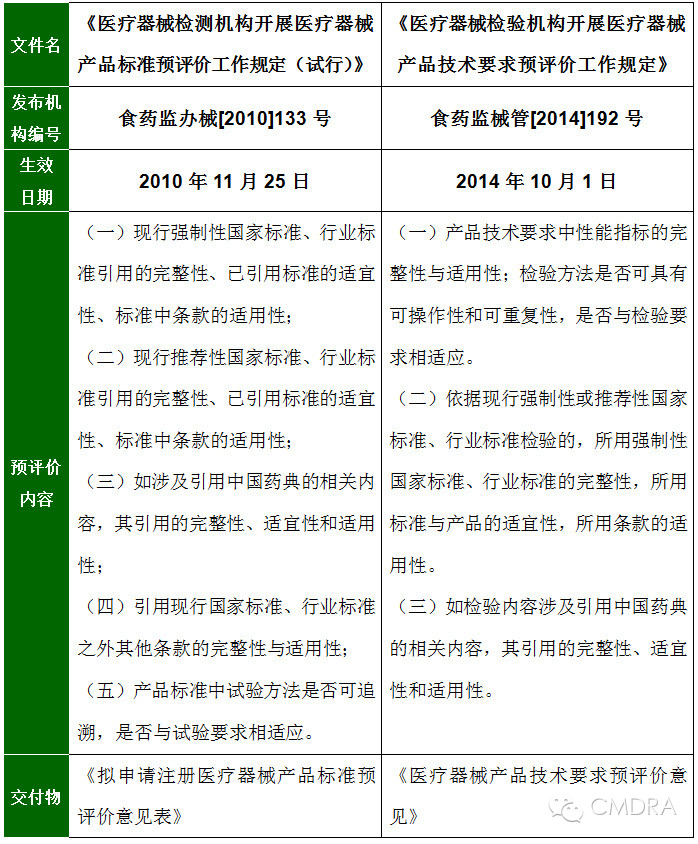
通过比较两个版本的“预评价内容”,可以看出一点非常明显的区别,新版的预评价需要检验机构首先对产品技术要求中全部性能指标的完整性与适用性进行评判。这将为医疗器械产品注册提供更有力的技术支撑,帮助申请人降低产品注册技术审评环节中“补充检验”的风险。
本文转自CMDRA
|  /3
/3 