
微流控技术自20世纪90年代问世以来,经历了爆炸性的发展,现已扩展到化学、生物和医学等众多研究领域,在小型化、便携和低成本的商业开发方面显示出巨大的潜力[1-3]。微流控技术中材料和加工技术的选择至关重要。在本文中,介绍了几种微流控技术中常用材料的进展与演变,通过对不同材料面向应用的利弊进行系统的比较,希望能为选择芯片材料提供指导。根据乔治·怀特赛德的定义,微流体是“利用几十到数百微米的通道处理或操纵少量(10-9到10-18升)流体的系统的科学和技术” [3]。在这样的尺度下出现了一些独特的现象。例如,由于质量和热量的传播距离相对较小,反应在较短的时间内迅速完成;由于微流体通道中的雷诺数较低,所以流动是层流的;由于表面体积比较大,毛细效应变得主导[4]。在微观尺度上,器件材料的表面性质被放大,这可以实现独特的功能,也可能导至宏观尺度上不会遇到的问题,因此材料在很大程度上决定了器件的功能[5]。微流控系统的另一个吸引人的特点是其实现复杂功能的能力,因为设备可以包含复杂的通道结构并与传感器和操作器集成[6-10]。然而,要实现某些功能,应特别注意为设备选择合适的材料,因为它赋予了设备的固有属性,并决定了适用的微加工方法。在过去的二十年里,各种材料被应用到微流体技术中。选择正确的材料是微流控芯片的第一步,通常也是关键的一步。本文介绍了微流控芯片制造所用材料的发展,系统地讨论了它们的优缺点以及适用的加工技术。在“微流体”的概念被引入之前,已经广泛使用并报道了微通道,例如用于气相色谱和毛细管电泳色谱(CE)的玻璃或石英毛细管,以及金属微机械加工的流动反应器。它们对微流体的孵化做出了贡献。在半导体工业微制造技术的启发下,第一代微流控芯片是使用二氧化硅或玻璃制备的。二氧化硅和玻璃通常采用标准光刻技术处理[11]。先将一层薄薄的光致抗蚀剂施加到晶片上并进行紫外线曝光,将透明掩模上的微图案转移到光致抗蚀剂层;然后使用显影光致抗蚀剂来产生用于蚀刻的掩膜,最后在形成微通道后,去除光致抗蚀剂。光敏玻璃(现场很少使用的玻璃)可以用激光直写(LDW)形成微通道[12],然而,LDW速度很慢需要连续处理,并且相关的设备也非常的昂贵。玻璃是光学透明和电绝缘的。作为一种非晶态材料,蚀刻的玻璃通道具有圆形的侧壁[13],除非采用特殊的蚀刻技术。硅和玻璃由于其耐有机溶剂、易于金属沉积、高导热系数和稳定的电渗透迁移率而被广泛使用,尽管后来又推出了许多其他芯片材料。玻璃芯片的一个主要应用是CE。与标准CE相比,片上CE成本更低,更易于并行化,并且直接利用电渗流提供无阀门进样,可以在几秒钟内分离分析物[14]。由于其高导热系数和表面稳定的电渗迁移率,玻璃微通道提供了比其他材料芯片更好的性能。玻璃/硅器件的其他重要应用源于它们的热稳定性和溶剂性。典型的应用包括芯片上的反应[15]、液滴的形成[6]以及溶剂萃取和原位制造[16]。
(A)采用湿法蚀刻和熔合键合方法制造玻璃微芯片;(B)毛细管电泳在玻璃微流控芯片上的快速分离;(C)玻璃芯片上微滴的高温反应;(D)使用层流在玻璃基板上原位蚀刻和沉积金属。然而,玻璃和硅的硬度也限制了它们在微流体中的广泛应用。首先制造成本高;制作过程中涉及危险化学品,需要配备相应的保护设施;其次,芯片很难粘合(通常需要高温、高压和超级清洁的环境)。此外,在玻璃或硅芯片中很难实现有效的阀门。混合芯片(例如,玻璃-弹性体)可以简化阀门制造,但可能会损害玻璃或硅的优势。此外,由于玻璃、硅不透气使得不能用于长期细胞培养。这些限制推动了其他芯片材料的发展,这些材料可以很容易地制造,并与更广泛的生物应用兼容。随着微流控技术的飞速发展,已经越来越多研究与生物及医学研究相结合,其中包括最常用于嵌入细胞等各种应用的材料—水凝胶。水凝胶与细胞外基质相似,它可以建立微通道,用于溶液、细胞和其他物质的输送[9,17]。
(A)在海藻酸钠凝胶中制备的微流控器件,嵌入细胞用于培养;(B)分子通过通道壁扩散到海藻酸钠凝胶中。
水凝胶是三维亲水聚合物链在水介质中延伸的三维网络,其中99%以上的部分都是水。原则上,通过控制聚合物链的聚合度,任何水溶性聚合物都可以用作水凝胶的基质。水凝胶的高度多孔结构及其可控的孔径使各种分子能够在其基质中扩散。与水相似的特性和高渗透性的结合使水凝胶成为封装细胞的绝佳载体,非常适用于细胞的三维培养。然而,营养物质和氧气通过散装凝胶的扩散不足以支持细胞培养环境的厚度,细胞随着梯度的变化可能会有不同的状态,细胞坏死开始发生在几百微米的厚度。在微流体通道加入大量水凝胶,可以观察到物质的快速输运,同时可以提供类似于自然分叉血管的功能,实现大量细胞的三维培养[18,19]。基于细胞培养实验的重要因素之一是基质和细胞的生物相容性。水凝胶具有良好的生物相容性,尽管对动物细胞表现出不同的亲和力[19]。动物来源的水凝胶,如基质和胶原蛋白,包含促进细胞粘附和增殖的因子。相比之下,植物来源的水凝胶,如海藻酸盐和琼脂糖,以及人工合成的水凝胶,如聚乙二醇和聚丙烯酰胺,缺乏细胞粘附位点,然而,粘附位点可以通过可控的方式嫁接回水凝胶结构上去。由于在大分子尺度上的低密度(和低强度),水凝胶在微加工中的分辨率(微米尺度)仅低于其他聚合物(纳米尺度)。此外,封装细胞的水凝胶可能与某些微加工工艺不兼容。目前,主要运用两种方法进行水凝胶的加工制作[20]。一种是直写法,包括激光直写技术(LDW)和移动喷嘴对水凝胶溶液进行凝胶化,这种方法可以低速生成任意的三维结构。另一种加工方法包含两个步骤:构造通道和通道封装。大多数水凝胶在温和的水溶液中凝胶化。因此,它可以由任何不溶于水的材料制成的母版模制备而成。与易于成型相比,粘合具有挑战性。通常,水凝胶不会通过简单的接触而粘附。粘合策略包括在粘合之前通过加热或化学物质熔化粘合表面的薄层,以及在粘合界面处使用第二种连接剂。水凝胶装置的应用大多与细胞相关。与PDMS装置相比,水凝胶更常用于研究组织水平的细胞培养,例如用水凝胶进行三维细胞培养,并用于组织工程的研究[9,21,22]。弹性体通常由缠绕在一起的交联聚合物链组成。当施加外力时,弹性体可以拉伸或压缩,当撤销外力时,它们可以恢复到原始形状。微流体中最常用的弹性体是聚二甲基硅氧烷(PDMS)[23,24]。PDMS的一个显著优势是加工方法简单及成本低[25]。液态PDMS预聚体在温和的温度(40-70℃)下进行热固化,可以从光刻胶模板中以纳米分辨率浇注,这比硅和玻璃模板制备起来更容易、更便宜[26];其低的表面张力极大地促进了固化后其从模板上剥离。通过简单的表面处理,PDMS芯片可以与另一个PDMS、玻璃或其他基板可逆地共形密封。也可以通过等离子体氧化PDMS表面或使用一层薄薄的PDMS作为粘合剂,将PDMS不可逆地结合到PDMS、玻璃或硅上。制造的便利性以及下面讨论的其他优点使PDMS成为研究实验室中最受欢迎的材料[27]。(A)PDMS中3D微通道的制作;(B)PDMS中用于操纵流体和颗粒的微型气动阀;(C)在PDMS设备上复杂地操作皮升液体;(D)应用PDMS三维结构和PDMS结构变形模拟肺功能。
PDMS的另一个优势是具有高弹性[31]。Quake等人开发了一种基于两层微通道的集成阀门高密度集成了皮升到飞升的固定体积,并实现并行和复杂的片上操作[28,29]。在众多阀门设计中,这种设计已成为目前在微流体领域应用最广泛的方式之一。该设计已被用于各种应用,例如,作为按需过滤器[28,32]或实现可控变形[30]。与玻璃、硅和其他硬材料(例如,聚甲基丙烯酸甲酯和聚碳酸酯)不同,PDMS具有良好的透气性,这对于在密封的微通道中长期培养细胞至关重要,其表面也能与细胞培养兼容。与大规模培养相比,微流控芯片提供了一个可控的微环境,可以很容易地实现梯度和振荡以及复杂的介质更换方案[33]。由于这些特点,PDMS芯片被广泛应用于生物相关研究,主要是细胞培养、细胞筛选和生化分析[34,35]。其中能够处理皮升和飞升体积,使其在单细胞分析中具有独特的优势[29,36]。尽管PDMS很受欢迎,但它也有明显的局限性[37]。在分子水平上,PDMS是覆盖有烷基的Si-O骨架组成的多孔基质,这种结构允许气体渗透,有利于细胞培养,但同时也导至了与有机溶剂不兼容,无法支持某些定量实验,小的疏水分子或生物分子被吸附到通道壁上,以及通过通道壁蒸发的水改变了溶液的浓度等问题。虽然已经提出了各种改性策略,但仍不能完全克服这些缺点[38-40]。因此,PDMS材料在水溶液中的应用受到限制。在引入微流体之前,热固性树脂(如SU-8光刻胶和聚酰亚胺)已经用作负性光刻胶,后来它们被用于制造微通道结构[41]。当加热或辐射时,热固性分子交联形成坚硬的网络,在分解之前不会软化。也就是说,热固性树脂一旦被加工就不能重塑。通常情况下,这些材料即使在高温下也是稳定的,耐大多数溶剂,并且光学透明。通过适当的键合方法,微流控芯片可以完全在热固性材料中制造出来。热固性材料的一大优势是使用光聚合进行真正的3D微加工[42]。另一个优势是具有高强度,这可以制造高深宽比和独立的结构[43]。由于热固性材料具有较高的刚性,不适合制造上述隔膜阀,此外,由于它们成本较高,限制了其在微流体中的应用。
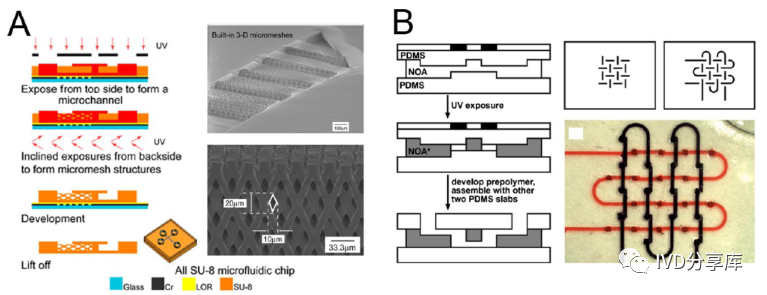
(A)微通道完全由SU-8制成,具有原位制造的3D精细结构;(B)热固性NOA制备三维微流控通道。
与热固性塑料不同,热塑性塑料可以在固化后重塑。由于热塑性塑料在工业上的广泛应用,已经积累了丰富的经验。热塑性塑料在玻璃化转变温度(Tg)时明显软化,使其可在此温度附近加工。它们可以通过重新加热多次重塑,这对于其成型和粘接很重要。用于微流控芯片的典型热塑性塑料有聚甲基丙烯酸甲酯(PMMA)、聚碳酸酯(PC)、聚苯乙烯(PS)、聚对苯二甲酸乙二酯(PET)和聚氯乙烯(PVC)。通常热塑性塑料表现出比PDMS略好的溶剂相容性,对醇的耐受性较好,但与大多数其他有机溶剂如酮和碳氢化合物不相容。由于它们对气体几乎不透气,其密封的微通道和微腔不适合长期进行细胞研究。此外,隔膜阀在这些材料中因材料的刚性很难实现。

(C)高温转移模塑法热塑性塑料的微细加工;(D)完全使用聚四氟乙烯PFA制造的微流控芯片。
与弹性体和热固性塑料不同,热塑性塑料通常采用固体材料,通过热压成型制造。热压成型可以以高速度和低成本生产数千个复制品,但它需要金属或硅模板以在高温下使用,以允许充分的塑料流动。该材料更有利于商业生产,但对于原型使用来说并不经济。由Whiteside和Xia开发的使用转移模塑的快速成型技术,使用PDMS作为复制中间体,能够将微图案从易于复制的光刻胶转移到热塑性塑料上。这项技术仅限于玻璃化温度低于150℃的热塑性塑料,因为PDMS在较高的温度下成型时会释放气体。通过调整固化配方和改进工艺,可以将PDMS用于传递模塑的最高工作温度提高到350℃,这足以满足几乎所有现有热塑性塑料的要求[44,45]。热塑性塑料不能与其他表面形成共价接触[46,47]。封闭其通道的典型策略包括热粘法和胶粘法。热塑性塑料的热粘法通常需要比玻璃更温和的条件,即在没有洁净室环境的情况下,温度和压力更低。根据热塑性塑料的应用,可以通过动态涂层或表面接枝对热塑性塑料表面进行改性[46]。共价修饰表面对于热塑性塑料通常比PDMS更稳定。例如,经过氧气等离子体处理后,它们的表面可以保持亲水性长达几年。此外,它们可以很容易地与用于柔性电路的电极集成。一个相关的应用是数字微流控,它可以通过电润湿来操纵液滴[48]。两种特殊的全氟化聚合物,全氟烷氧基(Teflon PFA)和氟化乙烯丙烯(Teflon FEP)是可热加工的,可用于微流体结构。所有特氟龙对化学品和溶剂都是极端惰性的,最终不粘和防污。重要的是,它们是光学透明的,足够柔软,可以制作隔膜阀,并且对气体具有适度的渗透性。尽管它们的熔化温度很高(超过280℃),但利用上面提到的高温热塑技术,我们可以在其中生成具有纳米分辨率的精细微结构,并将它们热粘合以形成各种微流体装置。全特氟龙芯片表现出与有机溶剂的出色兼容性、出色的防污染性能以及细胞培养的适应性。在引入纸基芯片之前,大多数微流体装置都设计为密封通道。然而,纸基芯片打破了这个设计方法[39]。纸基芯片是由纤维素制成的高度多孔的基底,具有出色的吸液功能。当纸上的某些区域被疏水改性时,滴加至纸上的水溶液会在毛细效应下精确地被引导通过亲水区域。纸基微流控芯片在便携式设备开发和低成本分析方面具有很大的前景,特别是在基于生物测定的个性化医疗中的应用[39,40]。纸基微流控芯片的加工制造很简单。一般来说,任何在纸上构造疏水图案的方法都是可行的。目前主要的制造方法可以分为两种[51]。利用光刻方法将聚合物溶液固定到纸上,然后去除通道以外区域形成的涂层。这种方法的分辨率相对较高,但价格昂贵,而且一旦被聚合物溶液覆盖,通道区域的特性可能已经改变。相比之下,运用更简单设备的印刷(切割)方法可以直接产生疏水屏障,无需将通道区域预先暴露于试剂中。由于通道区域存在织物基底,纸基芯片适用的检测方法相对有限。已报道的检测策略包括比色法、发光法和电化学检测法[51]。其中,比色法是最常用的检测方法,因为其对设备的要求最低,而且可以捕获检测区域的图像[52]。以纸作为芯片的制造材料具有以下几个优点:(1)微通道可充当被动泵分配器,无需电源或外部组件;(2)通道具有较大的表面积体积比,有利于表面相关的应用,只需干燥浸泡区域即可用于试剂的储存;(3)纸是微流控芯片中最便宜的材料之一,印刷制作方便、成本较低;(4) 纸可以很容易的堆叠,形成多层微流体通道或实现三维细胞培养[31];(5)纸可以滤除样品中的颗粒,例如,从血液中去除血细胞。

纸基微流控芯片(A)纸芯片上的生物测定;(B) 多层通道制造。
同时,纸基芯片也具有较大的挑战:(1)检测的灵敏度较低,因为通道的织物基质会阻挡内部信号并在运输过程中稀释样品;(2)具有低表面张力的液体可能无法很好地限制在由疏水性定义的通道中;(3)很少有典型的微流体应用(例如 CE、液滴和层流)在纸芯片上得到证明;(4)高密度集成难以实现,目前报道的最小通道宽度约为200μm,而20μm宽的通道在其他材料中很常见;(5)缺乏集成小型阀门的便捷策略;(6)液体容易从通道中蒸发仍然是一个问题。上述多种材料可以组合成一个混合芯片以发挥各种材料的优势。一般来说,二次材料应该实现新的功能,而不会在很大程度上损害一次材料的预期性能。硬芯片之间夹入软膜可以形成隔膜阀。通道需要承受操作阀门的压力(超过几十千帕)。最常用的组合是玻璃和PDMS结合,因为玻璃中的蚀刻通道自然是圆形的,这是隔膜阀的理想轮廓[54]。将通道与带有金属电极图案的基板结合起来。玻璃通常用于将金属电极集成到基于聚合物的设备中。如果需要光学检测,则采用涂有氧化铟锡 (ITO) 的玻璃,因为它易于通过光刻图案化以形成透明的电极[55]。结合不同的材料可以调节某些区域的通道壁的渗透性。一种多孔的“可渗透材料”被用作通道壁的一部分,作为整体流动的屏障,但允许通过扩散进行质量传递。此装置已用于协助芯片上细胞的培养和提取。该策略可以扩展到在静态溶液中产生浓度梯度。通过在水凝胶的两侧施加溶液的浓度差,可以在其中形成梯度,这种梯度可以转移到连接水凝胶的微通道的游离溶液中[56]。植入光固化材料可以实现原位制造多种结构[57]。这种策略有助于在微通道中生成复杂的结构和运动组件。根据材料的特性,触发信号可以是化学的、热的、电的或光学的[58]。此外,这些材料还可以掺杂添加剂以提供所需的功能[59]。目前,纳米材料掺杂的复合材料在微流控领域引起了越来越多的关注[60]。由液体固化的聚合物易于涂料,因此有望用于微流控装置的制备[61,62]。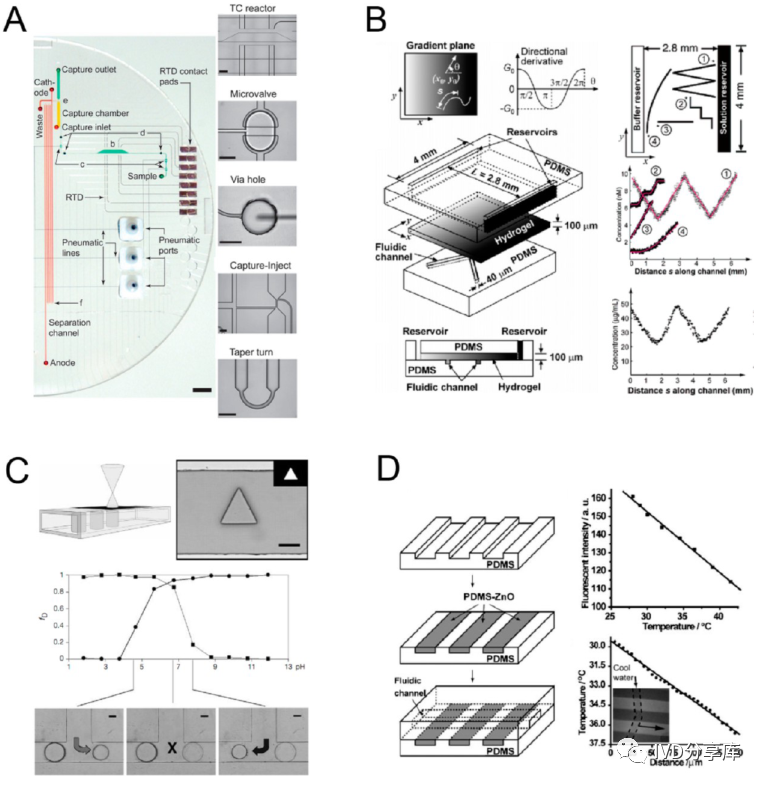
(A)集成阀和电极的玻璃-PDMS混合芯片;(B)用于梯度生成的PDMS-水凝胶混合芯片;(C)原位光固化水凝胶结构作为pH敏感阀,用于自动流量操作;(D)PDMS-ZnO复合材料作为PDMS芯片上的原位温度传感器。
芯片材料的发展反映了微流控技术的两大趋势:强大的微尺度研究平台和低成本、便携的分析。对于实验室研究,选择材料通常需要兼顾原型制作的便利性和设备的性能,而在商业化过程中,主要关注的是生产成本以及使用的易用性和可靠性。这种差异会导至对微流控器件制造材料选择的不同偏好。目前,玻璃、硅和PDMS最常用于实验室的研究,而塑料和纸张更有希望用于商业设备。每种材料都有其优点和缺点。玻璃、硅和聚四氟乙烯是对化学品和溶剂最惰性的材料;PDMS易于原型制作和制造具有各种集成组件的复杂流体回路;普通热塑性塑料非常适合标准微流体装置的商业批量生产;水凝胶更适合生物应用;纸在商业一次性生物测定方面很有前景。最后,所有材料都可以进行修改或组合,以制造更强大的设备来满足特定目标。参考文献:
[1]Reyes, D. R.; Iossifidis, D.; Auroux, P. A.; Manz, A. Micro Total Analysis Systems.1. Introduction,Theory,and Technology. Anal. Chem. 2002,74, 2623-2636.[2]Squires, T. M.; Quake, S. R. Microfluidics- Fluid Physics at the Nanoliter Scale. Rev. Mod.Phys. 2005, 77, 977-1026.[3]Whitesides,G.M. The Origins and the Future of Microfluidics. Nature 2006, 442, 368-373.[4]Janasek, D.; Franzke, J.; Manz, A. Scaling and the Design of Miniaturized Chemical-Analysis Systems. Nature 2006, 442, 374-380.[5]Atencia, J.; Beebe, D. J. Controlled Microfluidic Interfaces. Nature 2005, 437, 648-655.[6]Marre, S.; Jensen, K. F. Synthesis of Micro and Nanostructures in Microfluidic Systems.Chem. Soc. Rev. 2010, 39, 1183-1202.[7]Blazej, R. G.; Kumaresan, P.; Mathies, R. A. Microfabricated Bioprocessor for Integrated Nanoliter-Scale Sanger DNA Sequencing.Proc. Natl. Acad. Sci. U.S.A.2006,103, 7240-7245.[8]Chiu, D. T.; Lorenz, R. M. Chemistry and Biology in Femtoliter and Picoliter Volume Droplets.Acc. Chem. Res. 2008,42, 649-658.[9]Ghaemmaghami, A. M.; Hancock, M. J.; Harrington, H.; Kaji, H.; Khademhosseini, A.Biomimetic Tissues on a Chip for Drug Discovery. Drug Discovery Today 2012, 17, 173-181.[10]Mu, X.; Zheng, W. F.; Sun, J. S.; Zhang, W.; Jiang, X. Y. Microfluidics for Manipulating Cells.Small 2012,9,9-21.[11]Lin, C.-H.; Lee, G.-B.; Lin, Y.-H.; Chang, G.-L. A Fast Prototyping Process for Fabrication ofMicrofluidic Systems on Soda-Lime Glass. J. Micromech. Microeng. 2001, 11, 726-732.[12]Sugioka, K.; Cheng, Y. Femtosecond Laser Processing for Optofluidic Fabrication.Lab Chip2012, 12, 3576-89.[13]Mu, X.; Liang, Q. L.; Hu, P.; Ren, K. N.; Wang, Y. M.; Luo, G. A. Laminar Flow Used as “Liquid Etch Mask” in Wet Chemical Etching to Generate Glass Microstructures with an Improved Aspect Ratio. Lab Chip 2009, 9, 1994-1996.[14]Woolley, A. T.; Mathies, R. A.; Ultra-High-Speed, D. N. A. Fragment Separations Using Microfabricated Capillary Array Electrophoresis Chips. Proc. Natl. Acad. Sci. U.S.A. 1994,91,11348-11352.[15]Yen, B. K. H.; G€ unther, A.; Schmidt, M. A.; Jensen, K. F.; Bawendi, M. G. A Microfabricated Gas-Liquid Segmented Flow Reactor for High-Temperature Synthesis: The Case of Cd-Se Quantum Dots. Angew. Chem., Int. Ed. 2005, 44, 5447-5451.[16]Kenis, P. J. A.; Ismagilov, R. F.; Takayama, S.; Whitesides, G. M.; Li, S. L.; White, H. S.Fabrication inside Microchannels Using Fluid Flow. Acc. Chem. Res. 2000, 33, 841-847.[17]Domachuk, P.; Tsioris, K.; Omenetto, F. G.; Kaplan, D. L. Bio-Microfluidics: Biomaterials and Biomimetic Designs. Adv. Mater. 2010, 22, 249–260.[18]Griffith, L. G.; Swartz, M. A. Capturing Complex 3d Tissue Physiology in Vitro. Nat. Rev. Mol. Cell Biol. 2006, 7, 211–224.[19]Choi, N. W.; Cabodi, M.; Held, B.; Gleghorn, J. P.; Bonassar, L. J.; Stroock, A. D. Microfluidic Scaffolds for Tissue Engineering. Nat. Mater. 2007, 6, 908–915.[20]Tibbitt, M. W.; Anseth, K. S. Hydrogels as Extracellular Matrix Mimics for 3d Cell Culture. Biotechnol. Bioeng. 2009, 103,655–663.[21]Huang, G. Y.; Zhou, L. H.; Zhang, Q. C.; Chen, Y. M.; Sun,W.;Xu,F.;Lu,T.J.Microfluidic Hydrogels for Tissue Engineering. Biofabrication 2011, 3, 012001.[22]Khademhosseini, A.; Vacanti, J. P.; Langer, R. Progress in Tissue Engineering. Sci. Am. 2009, 300,64–71.[23]Mcdonald, J. C.; Whitesides, G. M. Poly(dimethylsiloxane) as a Material for Fabricating Microfluidic Devices. Acc. Chem. Res. 2002, 35, 491-499.
[24]Stroock, A. D.; Whitesides, G. M. Controlling Flows in Microchannels with Patterned Surface Charge and Topography. Acc. Chem. Res. 2003, 36, 597-604.
[25]Mcdonald, J. C.; Duffy, D. C.; Anderson, J. R.; Chiu, D. T.; Wu,H.K.;Schueller,O.J.A.;Whitesides,G.M. Fabrication of Microfluidic Systemsin Poly(dimethylsiloxane).Electro-phoresis2000,21,27-40.
[26]Xia, Y. N.; Whitesides, G. M. Soft Lithography.A n n u .R e v .M a t e r .S c i .1998,28, 153-184.
[27]Wu, H. K.; Odom, T. W.; Chiu, D. T.; Whitesides, G. M. Fabrication of Complex Three-Dimensional Microchannel Systems in PDMS. J. Am. Chem. Soc. 2003, 125, 554-559.
[28]Balagadde, F. K.; You, L. C.; Hansen, C. L.; Arnold, F. H.; Quake, S. R. Long-Term Monitoring of Bacteria Undergoing Programmed Population Control in a Microchemostat. Science 2005, 309, 137-140.
[29]Huang, B.; Wu, H. K.; Bhaya, D.; Grossman, A.; Granier, S.; Kobilka, B. K.; Zare, R. N.Counting Low-Copy Number Proteins in a Single Cell. Science 2007, 315, 81-84.
[30]Huh, D.; Matthews, B. D.; Mammoto, A.; Montoya-Zavala, M.; Hsin, H. Y.; Ingber, D. E.Reconstituting Organ-Level Lung Functions on a Chip. Science 2010, 328, 1662-1668.
[31]Unger, M. A.; Chou, H. P.; Thorsen, T.; Scherer, A.; Quake, S. R. Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science 2000, 288, 1 1 3-116.
[32]Zhou, J. H.; Ren, K. N.; Zhao, Y. H.; Dai, W.; Wu, H. K. Convenient Formation of Nanoparticle Aggregates on Microfluidic Chips for Highly Sensitive Sers Detection of Biomolecules. Anal. Bioanal. Chem. 2011, 402, 1601-1609.
[33]Kastrup, C. J.; Runyon, M. K.; Lucchetta, E. M.; Price, J. M.; Ismagilov, R. F. Using Chemistry and Microfluidics to Understand the Spatial Dynamics of Complex Biological Networks. Acc. Chem. Res. 2007, 41, 549-558.
[34]Khademhosseini, A. Microscale Technologies for Tissue Engineering and Biology. Proc. Natl. Acad. Sci. U.S.A. 2006, 103, 2480-2487.
[35]El-Ali,J.; Sorger,P.K.; Jensen,K.F. Cells on Chips. Nature 2006, 442,403-11.
[36]Ryan, D.;Ren,K.;Wu,H.Single Cell Assays. Biomicrofluidics 2011,5,021501.
[37]Mukhopadhyay,R.When PDMS Isn't the Best. Anal. Chem. 2007, 79, 3248-3253.
[38]Zhou, J. H.; Yan, H.; Ren, K. N.; Dai, W.; Wu, H. K. Convenient Method for Modifying Poly(Dimethylsiloxane) with Poly(Ethylene Glycol) in Microfluidics. Anal. Chem. 2009, 81,6627-6632.
[39]Ren, K. N.; Zhao, Y. H.; Su, J.; Ryan, D.; Wu, H. K. Convenient Method for Modifying Poly(Dimethylsiloxane) to Be Airtight and Resistive against Absorption of Small Molecules. Anal. Chem. 2010, 82, 5965-5971.
[40]Rolland, J. P.; Van Dam, R. M.; Schorzman, D. A.; Quake, S. R.; Desimone, J. M. Solvent-Resistant Photocurable “Liquid Teflon” for Microfluidic Device Fabrication. J. Am. Chem.Soc. 2004, 126, 2322-2323.
[41]Jackman, R. J.; Floyd, T. M.; Ghodssi, R.; Schmidt, M. A.; Jensen, K. F. Microfluidic Systems with on-Line Uv Detection Fabricated in Photodefinable Epoxy. J. Micromech. Microeng. 2001, 11, 263-269.
[42]Sato, H.; Matsumura, H.; Keino, S.; Shoji, S. An All Su-8 Microfluidic Chip with Built-in 3d Fine Microstructures. J. Micromech. Microeng. 2006, 16, 2318-2322.
[43]Zheng, Y. Z.; Dai, W.; Ryan, D.; Wu, H. K. Fabrication of Freestanding, Microperforated Membranes and Their Applications in Microfluidics. Biomicrofluidics 2010,4, 036504.
[44]Ren, K. N.; Zheng, Y. Z.; Dai, W.; Ryan, D.; Fung, C. Y.; Wu, H. K. Soft-Lithography-Based High Temperature Molding Method to Fabricate Whole Teflon Microfluidic Chips. In 14th International Conference on Miniaturized Systems for Chemistry and Life Sciences, 3-7 October 2010, Groningen, The Netherlands, RSC Publishing: London, pp 554-556.
[45]Ren, K. N.; Dai, W.; Zhou, J. H.; Su, J.; Wu, H. K. Whole-Teflon Microfluidic Chips. Proc. Natl. Acad. Sci. U.S.A. 2011, 108, 8162-8166.
[46]Tsao, C.-W.; Devoe, D. L. Bonding of Thermoplastic Polymer Microfluidics. Microfluid. Nanofluid. 2008, 6, 1-16.
[47]Neils, C.; Tyree, Z.; Finlayson, B.; Folch, A. Combinatorial Mixing of Microfluidic Streams.Lab Chip 2004, 4, 342-350.
[48]Fair, R. B. Digital Microfluidics: Is a True Lab-on-a-Chip Possible? Microfluid. Nanofluid.2007, 3, 245-281.
[49]Martinez, A. W.; Phillips, S. T.; Butte, M. J.; Whitesides, G. M. Patterned Paper as a Platform for Inexpensive, Low-Volume, Portable Bioassays. Angew. Chem., Int. Ed. 2007, 46, 1318–1320.
[50]Martinez, A. W.; Phillips, S.T.; Carrilho, E.; Thomas, S. W.;Sindi,H.;Whitesides,G.M. Simple Telemedicine for Developing Regions-Camera Phones and Paper-Based Microfluidic Devices for Real-Time, Off-Site Diagnosis. Anal. Chem. 2008, 80, 3699–3707.
[51]Li, X.; Ballerini, D. R.; Shen, W. A Perspective on Paper-Based Microfluidics: Current Status and Future Trends. Biomicrofluidics 2012, 6, 011301.
[52]Derda, R.; Tang, S. K. Y.; Laromaine, A.; Mosadegh, B.; Hong, E.; Mwangi, M.; Mammoto, A.; Ingber, D. E.; Whitesides, G. M. Multizone Paper Platform for 3D Cell Cultures. PLoS One 2011, 6, e18940.
[53]Blazej, R. G.; Kumaresan, P.; Mathies, R. A. Microfabricated Bioprocessor for Integrated Nanoliter-Scale Sanger DNA Sequencing. Proc. Natl. Acad. Sci. U.S.A. 2006, 103, 7240–7245.
[54]Zhou, J. H.; Ren, K. N.; Zheng, Y. Z.; Su, J.; Zhao, Y. H.; Ryan, D.; Wu, H. K. Fabrication of a Microfluidic Ag/Agcl Reference Electrode and Its Application for Portable and Disposable Electrochemical Microchips. Electrophoresis 2010, 31, 3083–3089.
[55]Qiu, H. B.; Yan, J. L.; Sun, X. H.; Liu, J. F.; Cao, W. D.; Yang, X. R.; Wang, E. K. Microchip Capillary Electrophoresis with an Integrated Indium Tin Oxide Electrode-Based Electrochemiluminescence Detector. Anal. Chem. 2003, 75, 5435–5440.
[56]Wu, H.; Huang, B.; Zare, R. N. Generation of Complex, Static Solution Gradients in Microfluidic Channels. J. Am. Chem. Soc. 2006, 128,4194–4195.
[57]Tentori, A. M.; Herr, A. E. Photopatterned Materials in Bioanalytical Microfluidic Technology. J. Micromech. Microeng. 2011, 21, 054001.
[58]Beebe, D. J.; Moore, J. S.; Bauer, J. M.; Yu, Q.; Liu, R. H.; Devadoss, C.; Jo, B. H. Functional Hydrogel Structures for Autonomous Flow Control inside Microfluidic Channels. Nature 2000, 404, 588–590.
[59]Siegel, A. C.;Tang,S.K.Y.;Nijhuis,C.A.;Hashimoto,M.;Phillips,S.T.;Dickey,M.D.; Whitesides, G. M. Cofabrication- a Strategy for Building Multicomponent Microsystems. Acc. Chem. Res. 2010, 43, 518–528.
[60]Medina-Sanchez, M.; Miserere, S.; Merkoci, A. Nanomaterials and Lab-on-a-Chip Technologies. Lab Chip 2012, 12, 1932–1943.
[61]Zhou, J. H.; Yan, H.; Zheng, Y. Z.; Wu, H. K. Highly Fluorescent Poly (Dimethylsiloxane) for on-Chip Temperature Measurements. Adv. Funct. Mater. 2009, 19, 324–329.
[62]Fang, C. H.; Shao, L.; Zhao, Y. H.; Wang, J. F.; Wu, H. K. A Gold Nanocrystal/ Poly (Dimethylsiloxane) Composite for Plasmonic Heating on Microfluidic Chips. Adv. Mater. 2012, 24,94–98. /3
/3 