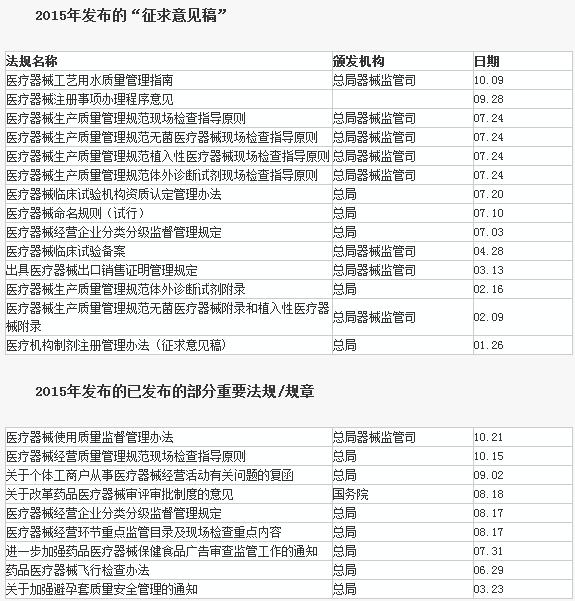
最新汇总指路:https://www.iivd.net/article-23792-1.html 自新版《医疗器械监督管理条例》(国务院令第650号)于2014年6月1日起实施以来,其配套规章及规范性文件陆续出台,大部分于2014年10月1日起正式实施。 以下是国家食品药品监督管理总局已经发布和正在征求意见的系列法规文件,小桔灯网整理如下: |
2014年10月1日后,竞争对手产品技术要求中的哪些信息可以从官方获取?医疗器械获准上市后必须公开的哪些信息?
首先,按照医疗器械产品生命周期与价值链进行切分,产品进入注册/备案环节后,监管部门才会披露相关的信息,具体包含下图中的标记为红色的“注册/备案”、“生产/备案”、“经营/备案”及“使用”四个环节。

结合上图与《医疗器械监督管理条例》,您可从官方获取的产品信息包括:
生命周期所处阶段 | 公开信息 |
注册/备案 | 1.注册、备案相关信息。 |
生产/备案 | 1.许可、备案相关信息。 2.抽查检验、违法行为查处情况等日常监督管理信息。 |
经营/备案 | 1.许可、备案相关信息。 2.抽查检验、违法行为查处情况等日常监督管理信息。 3.已经批准的医疗器械广告目录以及批准的广告内容。 4.虚假医疗器械广告。 |
使用 | 1.医疗器械不良事件评估结果及相应的控制措施。 2.再评价结果表明已注册的医疗器械不能保证安全、有效的。 |
上表中的“相关信息”究竟指哪些内容?还需具体问题具体分析,以“注册/备案”阶段为例,公布信息包括以下两部分:《医疗器械注册证》内容(含变更内容);产品技术要求中性能指标的内容。这一阶段,为了保护申请人利益,公众仅可以查阅注册审批结果,唯申请人可以查询注册审批进度和结果。
本文转自CMDRA
近日,国家食品药品监督管理总局行政受理中心发布了《医疗器械注册管理办法》(总局令第4号)实施过渡期间,受理工作的公告,其中包括两个关键的Deadline:按照原《医疗器械注册管理办法》(原局令第16号)受理的医疗器械注册申请的最后签收时间(2014年9月30日)和最后补正材料时间(2014年10月20日)。详情请参见下列日历。

《公告》正文如下:
对于9月30日已经签收的医疗器械注册项目, 我中心将确保按照行政许可法规定在5个工作日内,即最晚至2014年10月13日处理完毕。9月30日前签收,并在法定时限内受理完毕的项目按《医疗器械注册管理办法》(原局令第16号)等规定办理。
对于9月30日已经签收的、按照《医疗器械注册管理办法》(原局令第16号)等规定提交补正材料的医疗器械注册项目,申请人应当在2014年10月20日前一次性补充材料,符合要求的,予以受理;不符合要求或逾期未补正的,注册申请人再次申报时应按照《医疗器械注册管理办法》(总局令第4号)和相关法规要求提交注册申报材料。
本文转自CMDRA
 /3
/3 