| 传说中最烧脑的恒温扩增技术,当属LAMP和CPA,但细细拆解其原理步骤,也可以豁然开朗。
一、环介导等温扩增技术 环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是2000年由日本荣研株式会社的Notomi等人提出的一种新型核酸扩增技术。 B3/B3c, B2/B2c, B1/B1c, F1c/F1, F2c/F2, F3c/F3①首先,内侧引物FIP(以FIP为例)的3’端F2序列与模板F2c区域结合,引导合成DNA(图1 step1);②同时,外侧引物F3与模板F3c区域结合,引导合成DNA,并置换出内侧引物FIP引导的合成链(图1 step2-3);③被置换出的DNA单链由于5’端含有F1c和F1序列,可互补配对形成环状结构;另外,单链DNA的3’端B2c区域可与内侧引物BIP的B2序列结合引导合成DNA,并被外侧引物B3的合成链置换出来(图1 step4-5);④最终被置换出来的DNA单链序列为5’-B1c-N-B2-N-B1-NNN-F1c-N-F2c-N-F1-3’,其5’端和3’端均含有可自身互补配对成环的序列(B1c/B1和F1c/F1),可形成哑铃状结构(图1 step6);⑤其中,3’端形成环状结构后,便以自身序列为模板引导合成DNA链;同时3’端环状部分的F2c区域为单链状态,可与内侧引物FIP的F2序列结合引导DNA合成,并置换出前面3’端自身引导合成的DNA链(图1 step7);⑥至此,LAMP将进入环介导的循环扩增过程,步骤⑤置换出的DNA单链3’端含有3’-B1-N-B2c-N-B1c-NNNN序列,B1/B1c序列可再次互补配对成环,并以自身为模板引导合成DNA,同时置换出前面合成的DNA链(图1 step8-10);⑦此时将生成一条茎环结构的DNA链(图1 step10)和一条互补的DNA链(图1 step9);⑧其中,茎环结构DNA的环状部分含有B2c区域,可与内侧引物BIP的B2序列结合引导合成DNA,由此便建立了循环过程(图1 step7-11);⑨步骤⑦的另一条互补DNA链将进入延伸和再循环阶段,由内侧引物引导链置换延伸反应,茎环个数逐渐增加, 最后的产物是一系列反向重复靶序列构成的茎环结构和多环花椰菜样结构的DNA片段混合物(图1 step12-20)。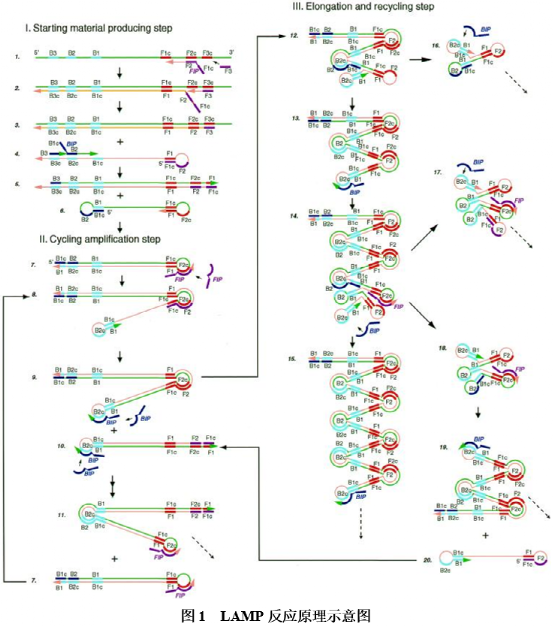
①LAMP关键步骤是形成环状结构,而理解了环状结构的形成过程及其作用,也就理解了LAMP原理。通过上述反应步骤可以知道,环状结构有两个作用,一个是3’端成环后可以自身为模板引导扩增,另一个是环状部分的单链结构可与内侧引物退火结合启动扩增,可见该恒温扩增方法的关键步骤是形成环状结构,引导循环扩增,这可能正是该恒温扩增技术命名的缘由。②Bst DNA聚合酶的链置换功能是该恒温扩增技术的核心,只有置换出单链DNA,才有可能形成环状结构。③从反应过程看,参与循环扩增的引物主要是内侧引物,外侧引物仅在开始时置换出内侧引物的合成链,以便形成单链并互补配对成环,因此在LAMP反应体系中内侧引物的浓度高于外侧引物。
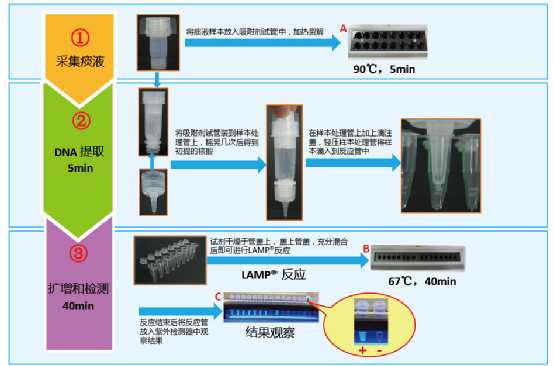
蓝谱生物为该产品从样本采集(咳痰采集专用移液枪/枪头)到样本处理(PURE法)再到结果检测(恒温荧光核酸扩增仪LoopampLF-160),配齐了一套适合该产品实验操作的耗材、试剂和设备。总体上,操作方法相对简单,其中样本处理过程中的耗材设计较为巧妙,最后经LAMP扩增的终产物可在紫外光照射下肉眼观察判读。
博奥生物通过碟式芯片微孔间的间隔,将13种呼吸道病原体的靶标扩增原料进行物理分隔,从而实现了病原体的多联检测。其恒温扩增微流控分析仪,可对LAMP扩增信号进行实时检测,并由软件自动判读结果。该产品美中不足的是,需要将样本进行前处理,经纯化后的核酸方可加入芯片中进行检测,与目前多数厂家推崇的“样本进,结果出”一体机尚存差距。

二、交叉引物扩增技术 1. 发明 交叉引物扩增技术(Cross Priming Amplification,CPA)是由杭州优思达生物公司研发的,中国首个具有自主知识产权的核酸扩增技术。根据体系中交叉引物数量的不同,可分为单交叉扩增(Single crossing CAP)和双交叉扩增(Double crossing CAP)两种。
2. 原理 (1)引物设计:5个区域,1条交叉引物,2条剥离引物,2条检测引物- 5个区域:4s/4a, 1s/1a, 3s/3a, 2s/2a, 5s/5a
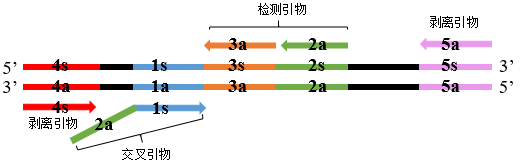
①首先,交叉引物的1s序列与模板1a区域结合启动合成DNA;②同时,剥离引物4s与模板4a区域结合引导合成DNA,并置换出交叉引物引导合成的DNA链;③被置换出的DNA单链含有3s、2s和5s区域,可分别与检测引物3a、2a和剥离引物5a结合引导合成DNA链,同时外侧引物引导的合成链可置换出内侧引物引导的合成链,由此可形成2种单链DNA,其序列结构分别为5’-2s-1a-3a-3’和5’-2s-1a-3a-2a-3’(图2 step1);④其中,由检测引物3a引导合成的单链DNA(5’-2s-1a-3a-3’)的2s区域可与检测引物2a结合延伸,或者其2s-1a区域与交叉引物2a-1s结合延伸,最后均形成双链DNA产物(即1s/3a产物),产物序列为2a/2s-1s/1a-3s/3a;⑤同时,另一条由检测引物2a引导合成的单链DNA(5’-2s-1a-3a-2a-3’),由于自身含有互补序列2s/2a,可通过互补配对形成发夹结构;发夹结构的单链部分含有1a区域,可与交叉引物的1s序列结合启动生成双链DNA产物(即1s/2a产物),产物序列为2a/2s-1s/1a-3s/3a-2s/2a(图2 step2);⑥步骤⑤中生成的1s/2a产物的两条链可分别通过自身的互补配对形成发夹结构,其中正义合成链的发夹结构可继续与交叉引物结合,进入循环(图2 step2);反义合成链的发夹结构可与检测引物3a和2a结合启动合成DNA链,并同样形成1s/2a产物和1s/3a产物;其中1s/2a产物可继续进入循环扩增过程(图2 step3)。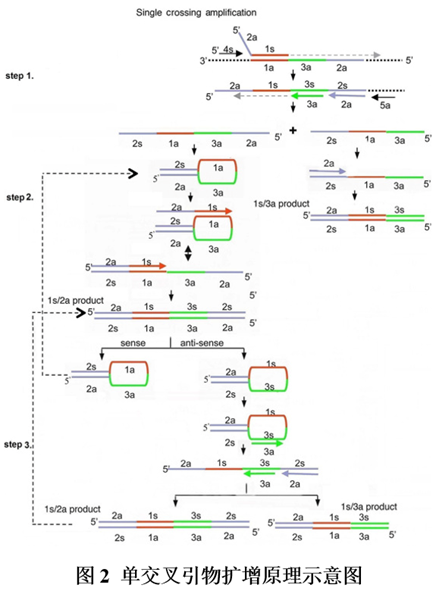
①CPA单交叉引物扩增技术通过1条交叉引物,在扩增过程中形成发夹结构以实现循环扩增过程,最终的产物主要是2种双链DNA(1s/2a产物和1s/3a产物),序列分别为2a/2s-1s/1a-3s/3a-2s/2a和2a/2s-1s/1a-3s/3a。②循环过程中形成的1s/2a产物为双链结构,如何确保该双链DNA再次形成发夹结构是关键步骤之一,这可能在引物设计时,对2a/2s区域的选择有一定的要求。(1)引物设计:4个区域,2条交叉引物,2条剥离引物
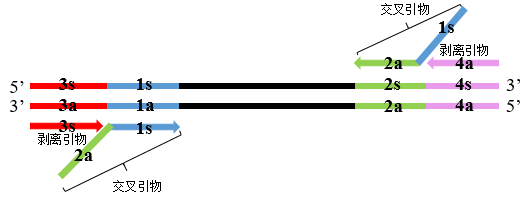
①首先,交叉引物2a-1s(以2a-1s为例)的1s序列与模板1a区域结合引导合成DNA链,同时剥离引物3s引导合成DNA链,并置换出交叉引物的合成链(图3 step1);②被置换出的DNA单链包含2s和4s区域,可分别与交叉引物1s-2a的2a序列和剥离引物4a结合引导合成DNA,其中剥离引物4a引导合成的DNA将置换出交叉引物的合成链(图3 step2);③被置换出的单链DNA序列为5’-1s-2a-NNN-1a-2s-3’,自身含有互补配对序列1s/1a和2s/2a,可形成2种发夹结构;其中2s/2a形成的发夹结构由于存在游离3’端,可继续延伸补平至末端;同时,该单链DNA的3’端1a和2s区域可分别与交叉引物2a-1s的1s序列、交叉引物1s-2a的2a序列结合引导合成DNA链,其中位于外侧的交叉引物1s-2a的合成链序列为5’-1s-2a-1s-NNN-2s-1a-3’(图3 step3-4);④序列为5’-1s-2a-1s-NNN-2s-1a-3’的DNA合成链,3’端的1a和2s区域可继续分别与交叉引物2a-1s的1s序列、交叉引物1s-2a的2a序列结合引导合成DNA链,由此不断往复延伸,引入交叉引物序列,终产物是具有各种二级结构的多分支单链DNA和双链DNA混合物(图3 step5-7)。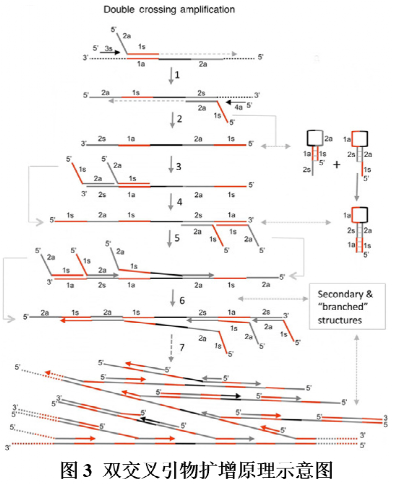
①CPA双交叉引物扩增技术采用2条交叉引物进行反应,扩增效率更高,适用于分子POCT。②扩增产物为多分支的二级结构DNA,对于采用探针法的实时检测效果可能会偏差,但其产生的大量扩增产物可用于终点法检测,比如采用免疫层析的方法对扩增产物进行检测。③基于扩增效率高、大量产物方便免疫层析检测的特点,该技术可用于核酸免疫层析检测。
优思达基于其恒温扩增技术开发了对应的设备和试剂,其中试剂采用的玻璃化保存技术,可实现常温运输和保存;检测管配合仪器使用可完成核酸提取纯化、核酸扩增和结果检测全流程,真正实现了“样本进,结果出”。
优思达的这两款产品是核酸恒温扩增与免疫层析技术的结合,检测结果肉眼即可判读。其中,左边的小装置仅用于核酸扩增产物的层析检测,核酸扩增过程需在外部进行;而右边小装置则是升级版,集合了核酸恒温扩增和免疫层析检测过程,且通过内部微流控设置实现病原体的多联检测。操作简便性可见一斑,其中对于扩增产物的防污染设计更是值得大家关注。
LAMP和CPA两者在扩增原理上是比较类似的,均是在靶序列的多个区域设计多条引物,并都包含了在位置上具有内外之分的引物,采用的聚合酶均是具有链置换功能的Bst DNA聚合酶,终产物也均是不同长度的核酸片段混合物。只是由于引物在具体设计上的差别,导至形成的中间产物是哑铃结构还是发夹结构、终产物是花椰菜结构还是不同长度的DNA抑或是多分支核酸链。等温扩增、反应高效是两者共有的优势。而两者的不足也是相通的,过多的引物数量对多重检测是一个障碍,不管是博奥还是优思达,想要实现一次上样即可检测多个靶标,则需要将样品进行物理分隔才便于进行多靶标扩增检测。
参考资料 [1]Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 2000 Jun 15;28(12):E63. doi: 10.1093/nar/28.12.e63. PMID: 10871386; PMCID: PMC102748. [2] 蓝谱生物官网. [3] 博奥生物官网. [4] Xu G, Hu L, Zhong H, Wang H, Yusa S, Weiss TC, Romaniuk PJ, Pickerill S, You Q. Cross priming amplification: mechanism and optimization for isothermal DNA amplification. Sci Rep. 2012;2:246. doi: 10.1038/srep00246. Epub 2012 Feb 3. PMID: 22355758; PMCID: PMC3271364. [5] 优思达官网.
|  /3
/3 