金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
谢邀。
专业基因检测,免疫治疗知道的不太多,引用一些专业人士的。(原文来自中山大学肿瘤防治中心,我编辑过一些,没有大的改动,不过不记得改了哪些。。。直接把给客户的邮件拿来用,抱歉,我有点懒)
免疫治疗的策略和现有方法包括:过继性细胞治疗和免疫检查点的调节等。
一、 免疫检查点调节
免疫检查点是在免疫系统中的抑制性通路,它们对于维持自身免疫耐受、调节生理性免疫应答的持续时间和幅度起重要作用,从而避免免疫反应对正常附属组织的损伤和破坏。此外,这些检查点可能与肿瘤的免疫逃逸相关。免疫检查点通路由配体/受体的相互作用所调控。CTLA-4是第一个应用于临床的T细胞免疫检查点,其次是PD-1与其主要配体PD-L1。CTLA-4与PD-1表达于淋巴细胞表面,而PD-L1表达于多种肿瘤细胞表面,也可表达于抗原呈递细胞。当T细胞被激活后,细胞膜CTLA-4通过复杂的机制被上调,CTLA-4与CD28竞争性结合CD80和CD86分子,抑制共刺激信号,从而抑制T细胞的功能。而PD-1与其配体PD-L1、PD-L2结合后,通过抑制激活T细胞的激酶信号通路而发挥负调节作用。靶向CTLA-4以及PD-1通路的单克隆抗体可以阻断抑制性免疫信号。它们在临床上对多种肿瘤显示出强大的抗肿瘤效应,Ipilimumab和Nivolumab已被FDA 批准上市,分别用于黑色素瘤和肺鳞癌的治疗。
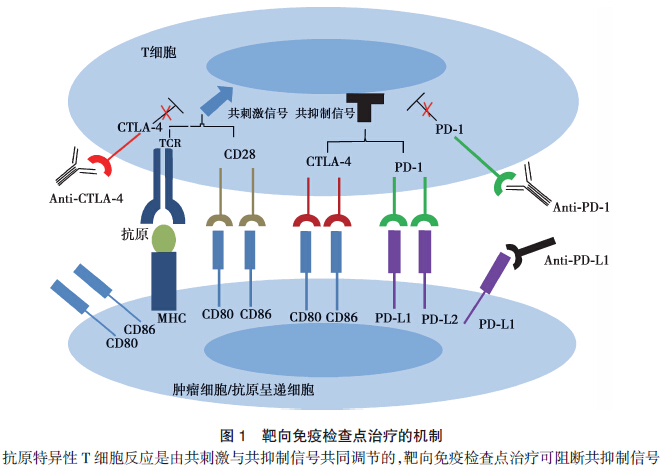
Tremelimumab是一种全人源化的抗CTLA-4单克隆抗体,已在恶性黑色素瘤、肝癌、肠癌、恶性间皮瘤等多种肿瘤中进行评估,并显示出一定的抗肿瘤效应。
Nivolumab是一种抗PD-1的全人源化单克隆抗体,多项临床试验已证实它在多种肿瘤中显示出卓越的疗效。Nivolumab分别于2014年12月、2015年05月批准用于晚期或不可切除的、Ipilimumab(如果BRAF V600突变,BRAF抑制剂)耐药的黑色素瘤和铂类为基础的化疗耐药的转移性肺鳞癌的治疗。目前,一项评估Nivolumab单药和Nivolumab联合Ipilimumab治疗在进展期或转移性实体瘤中的疗效及安全性的Ⅰ/Ⅱ期临床试验(NCT01928394)正在进行中,该研究可入组5种肿瘤:三阴性乳腺癌、胰腺癌、小细胞肺癌、膀胱癌以及胃癌。计划入组410例患者,估计2017年完成。
另一种高特异性的人源化的抗PD-1单克隆抗体Pembrolizumab(MK-3475),在一项大型随机Ⅰ期临床试验KEYNOTE-001(NCT01295827)中,Pembrolizumab在135位转移性黑色素瘤患者的总有效率达38%,另一项Ⅰ期临床试验(NCT01295827)则在173例Ipilimumab耐药的晚期黑色素瘤患者中再次验证了Pembrolizumab的疗效,总有效率为26%。FDA于2014年批准其用于治疗晚期或不可切除的、Ipilimumab(如果BRAF V600突变,BRAF抑制剂)耐药的黑色素瘤。其在非小细胞肺癌中的疗效近期也得到了一项Ⅰ期临床试验的验证。
2012年发表于《新英格兰杂志》的一项多中心Ⅰ期临床试验(NCT00729664),评估了抗PD-L1单克隆抗体MDX-1105(BMS-936559)在多种晚期实体瘤中的疗效,研究总共入组了207例患者,在黑色素瘤、非小细胞肺癌、卵巢癌以及肾细胞癌中,观察到了6%~17%的有效率。
MEDI4736也是一种抗PD-L1单克隆抗体,在2015年ASCO会议中,Segal N等人报道了一项Ⅰ期临床试验(NCT01693562),虽然截止至报道时仅有6周的中位随访时间,但已观察到MEDI4736在多种肿瘤中均具有一定疗效。在今年ASCO会议中,另一种抗PD-L1单克隆抗Avelumab(MSB0010718C)在多种肿瘤中开展的Ⅰ期临床试验(NCT01772004)也被报道,该试验目前已入组超过700例患者,计划入组总病例数1570例,预期在2017年4月试验结束。而另一项由日本学者开展的评估Avelumab用于晚期实体瘤治疗的Ⅰ期临床试验(NCT01943461)也正在招募中。
二、 过继性细胞治疗
将肿瘤特异性T细胞输入进肿瘤患者体内被称为过继性细胞治疗。T细胞被从人体分离,在体外扩增,再大量回输入人体。这是早期过继性细胞治疗采用的模式。1988年,Rosenberg SA等人使用肿瘤浸润的淋巴细胞联合IL-2治疗20例转移性黑色素瘤,在既往IL-2治疗耐药的患者中,总反应率为40%,而在既往未接受过IL-2治疗的患者中,总反应率达60%。
过继性输注的杀伤细胞的特异性对于是否引发免疫反应导致的致命副作用具有重要意义,这在一定程度上限制了常规由人体分离得到的免疫细胞的大剂量使用。使用肿瘤特异性抗原刺激免疫细胞可增加其抗肿瘤特异性。此外,部分肿瘤缺乏MHC-I类分子的表达,通过使NK细胞功能性失活、抗原呈递能力受损等机制使肿瘤产生免疫逃逸。嵌合抗原受体是通过基因改造技术产生的一种融合的分子,它由肿瘤相关抗原结合区域、铰链区域、跨膜区域和胞内区域组成,与T细胞抗原受体不同,嵌合抗原受体对T细胞的激活不依赖于MHC分子。然而,寻找到特异性非常高的肿瘤相关抗原并非易事,并且嵌合抗原受体T细胞治疗可能带来严重的副反应,在一项采用抗HER2/neu CAR T细胞治疗HER2过表达肿瘤的研究中,一位受试者于治疗后5天死于由肺上皮细胞低水平HER2被识别所导致的炎症风暴与呼吸衰竭。最近,表达抗CD-19嵌合抗原受体的T细胞用于急性白血病、弥漫大B细胞淋巴瘤、惰性B细胞淋巴瘤的治疗中取得了成功,在治疗有效的同时副反应尚可耐受。
随着免疫治疗在黑色素瘤、肺鳞癌等肿瘤中取得的巨大成功,对其治疗价值的探索也迅速拓展到其他类型的肿瘤。当我们解答了免疫治疗是否是一种安全有效的治疗手段后,下一个问题则是如何选择最佳的治疗模式。对靶向免疫检查点治疗的探索,已经从单药治疗迈向联合治疗。一项Ⅲ期随机对照临床试验比较了Ipilimumab与Nivolumab单用或联用治疗初诊不可切除的Ⅲ Ⅳ期黑色素瘤,联合组明显增加了3~4级不良反应,同时证实了在PD-L1阴性的患者,联合治疗较任何单药治疗均能明显提高疗效。2015年4月发表在《新英格兰杂志》的一个个案报道,介绍了一例胸壁巨大黑色素瘤患者,在使用单剂量Ipilimumab与Nivolumab联合治疗后,仅3周时间,肿瘤迅速消失,甚至快过机体正常组织修复时间。提示抗PD-1/PD-L1通路与抗CTLA-4联合治疗,在某些亚群肿瘤中可能具备相当高的抗肿瘤效应。此外,对于非免疫原性肿瘤,使用肿瘤特异性疫苗诱导免疫应答,使效应性T细胞趋化至肿瘤微环境,再结合靶向免疫检查点治疗是一种理论上非常合理有效的治疗模式。这一理论在已在研究中得到证实。免疫治疗与化疗的联合应用,已经被多项临床研究所采纳。多种化疗药物均可以诱导肿瘤细胞PD-L1 的上调,促进免疫逃逸,这为化疗与免疫治疗的联合应用提供了部分理论依据。然而化疗的骨髓抑制作用是最常见的副反应,这在一定程度上会削弱免疫治疗的效果,与化疗联合免疫治疗的理念相矛盾。因此,化疗与免疫治疗结合使用的最佳模式可能需要得进一步深入探讨。 |
|
 /3
/3 