金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
今天一起来学习凝胶过滤色谱法。
Textbook on Cloning, Expression and Purification of Recombinant Proteins | SpringerLink
除了在化学、医学和药物研究中发现大量应用外,凝胶过滤色谱法(GFC)也已成为几乎每个生物医学研究实验室的常规工具,特别是蛋白质生物化学。随着重组DNA技术在基础研究中的快速发展和应用,纯化细菌表达蛋白以进一步表征的需求增加了许多。凝胶过滤层析通常在最后或精制纯化步骤中采用,以获得高度纯化的蛋白质,这些蛋白质随后用于生物物理和结构研究。GFC的通用性和健定性在于蛋白质分子在分离过程中不像离子交换色谱和亲和色谱那样粘附在色谱柱上。这给了GFC一个显著的优势,因为它允许蛋白质在有利于它们未来的应用或储存的缓冲条件下洗脱。由于GFC有根据大小或分子量分离分析物的功能,它也被用作确定大分子的分子量和低聚物性质的分析工具。本章描述了凝胶过滤色谱的理论、仪器和应用,并详细讨论了几个重要的协议和故障排除提示。
凝胶过滤色谱(GFC)或者粒径排除色谱法(SEC)是一种常用的蛋白质纯化技术,根据其流体动力学体积或大小的差异分离大分子(1).凝胶过滤色谱的一般原理相当简单,其中惰性凝胶介质是由具有稳定物理性质的球状珠子组成的多孔基质。当不同粒径分布的分析物混合物作用于柱上时,大于孔径的分子不能进入珠内。因此,它们首先通过珠子和洗脱液之间的间隙。另一方面,小于凝胶孔径的分子在较晚的时间点扩散到孔中并被洗脱,这是根据它们的分子量的大小(图1)。
虽然该色谱技术广泛应用于重组蛋白在研究实验中进行提纯,它也能通过放大该过程使其适用于工业过程。依据流动相中使用的溶剂的类型,它也被称为分子排异、分分子筛、凝胶渗透和凝胶排异色谱法(3)。
GFC区别于其他两种主要的色谱技术(即离子交换色谱和亲和色谱)的特征是蛋白质分子和溶剂之间没有相互作用,如流动相。这使得这种方法在缓冲液的选择上相当灵活,由于它对于柱子的分辨率没有任何不利的影响。GFC通常用于蛋白纯化的最后一步,这种特性能够使其将蛋白保留在适合纯化后的一些结构和功能研究的缓冲液中。除了凝胶孔径,其他决定色谱柱分辨率的因素有柱床高度、流速、样本体积以及蛋白分子量的大小(4,5)。想要获得最好的分辨率,可以通过使用合适的流速(慢或中速),长而窄的柱子,小孔径的凝胶个样本体积(总柱体积的1-5%)。除了根据分子量分离蛋白外,GFC的另一个重要的应用是脱盐(7).由于GFC通常是蛋白质纯化的最后一步,因此负载的蛋白质可以在感兴趣的缓冲液中洗脱。负载样品中的盐组分很容易被分离由于其与大分子之间巨大的体积差。因此,多达柱床总体积30%的样品可以被安全地加载到在柱子上,且不太可能出现峰值重叠。
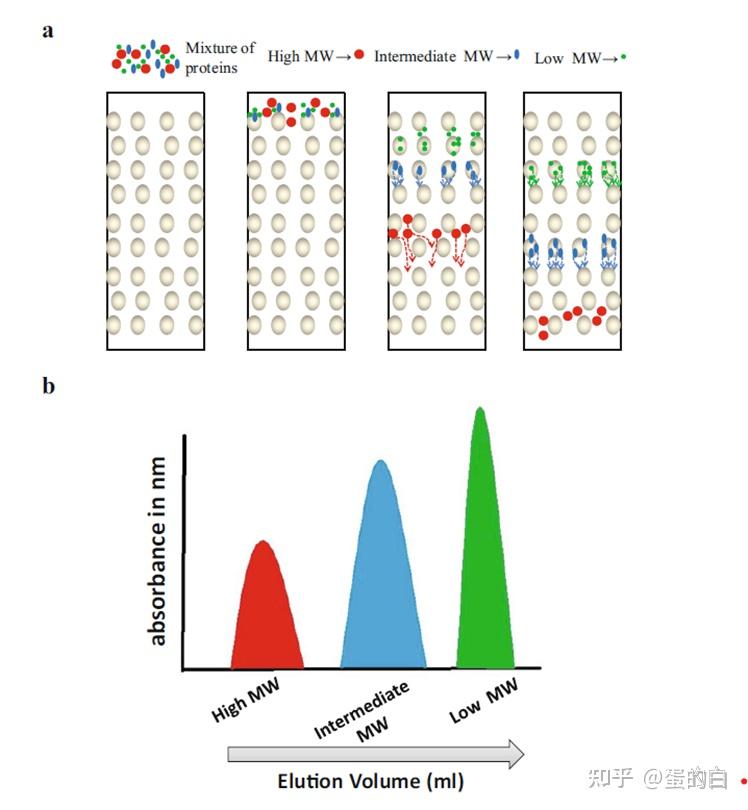
图1 凝胶过滤色谱分离原理图示(a)上柱的蛋白混合物(显示为不同颜色)。根据大小的不同,蛋白分子从不同的途径通过凝胶。高分子量的蛋白(红色)由于过大不能经过小球而只能通过小球之间的空间被最先洗脱下来,小分子(绿色)进入小球,移动最慢而被最后洗脱下来。(b)依据洗脱缓冲液体积的不同大小
由于分离技术是线性地依赖大分子的分子量,依据此原理,该方法用于检测感兴趣蛋白的分子量及其寡聚特性。
参考文献:
1. Sun T, Chance RR, Graessley WW, Lohse DJ. A study of the separation principle in size
exclusion chromatography. Macromolecules. 2004;37:4304–12. Error: DOI Not Found
ma030586k.
2. Fekete S, Beck A, Veuthey JL, Guillarme D. Theory and practice of size exclusion chromatography
for the analysis of protein aggregates. J Pharm Biomed Anal. 2014;101:161–73.
3. O’Fágáin C, Cummins PM, O’Connor BF, et al. Gel-filtration chromatography. In: Methods in
molecular biology (Clifton, NJ). Amsterdam: Nature Publishing Group; 2011. p. 25–33.
4. Afeyan NB, Fulton SP, Gordon NF, et al. Perfusion chromatography: an approach to purifying
biomolecules. Bio/Technology. 1990;8:203–6. https://doi.org/10.1038/nbt0390-203.
5. Granath KA, Kvist BE. Molecular weight distribution analysis by gel chromatography on
sephadex. J Chromatogr A. 1967;28:69–81. https://doi.org/10.1016/s0021-9673(01)85930-6.
6. Gritti F, Guiochon G. The current revolution in column technology: how it began, where is it
going? J Chromatogr A. 2012;1228:2–19. https://doi.org/10.1016/j.chroma.2011.07.014.
7. Jerker P, Per F. Gel filtration: a method for desalting and group saparation. Nature.
1959;183:1657–9.
原文地址:https://zhuanlan.zhihu.com/p/699031984 |
|
 /3
/3 