金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
你能被fda查,那是因为你的药物要卖到美国得通过fda检验。。。
人家搭飞机过来检查厂房有什么问题吗????
中国当然也可以这么干。
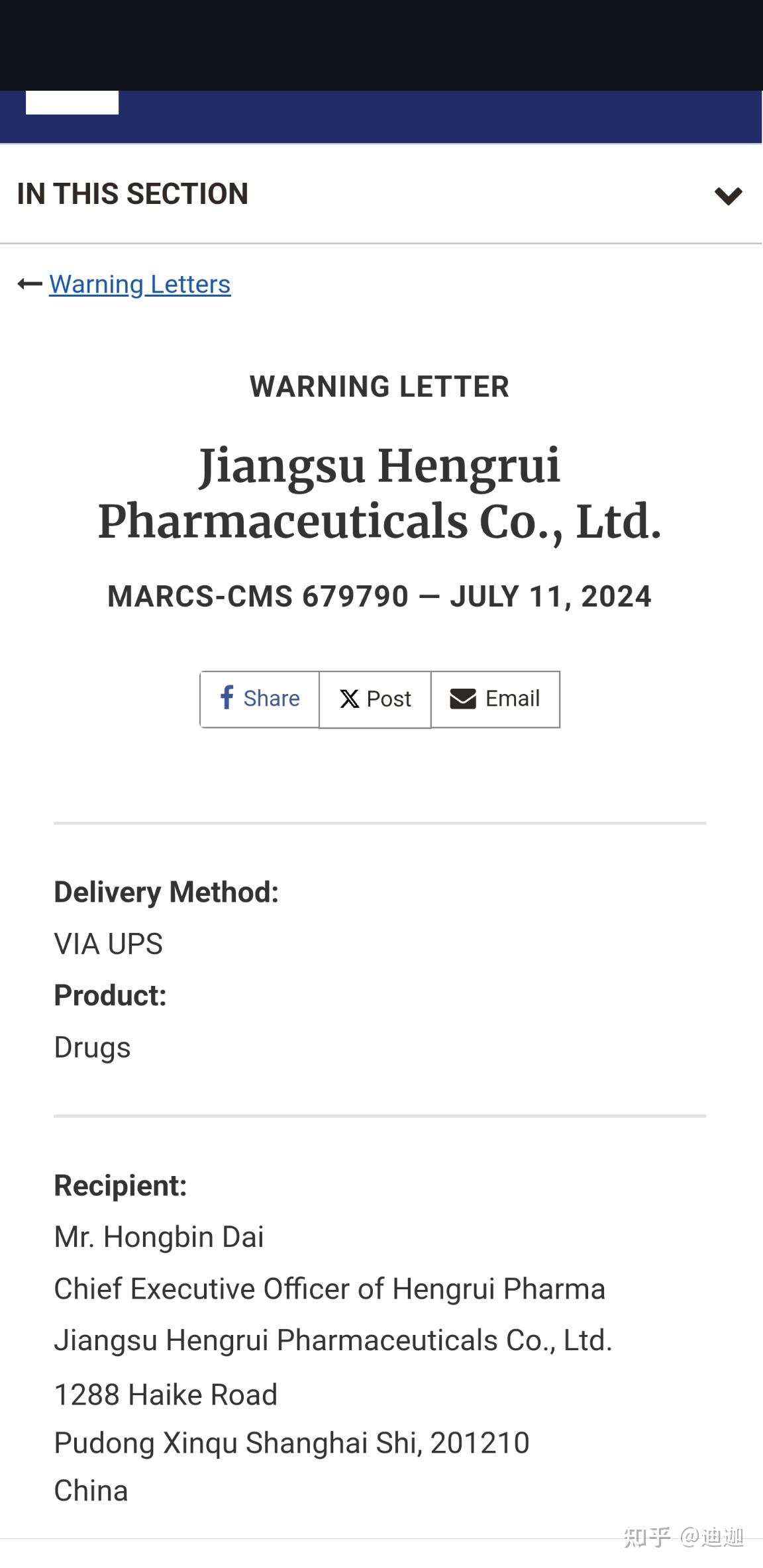
2024 年 7 月 11 日
尊敬的戴先生:
美国食品药品监督管理局(FDA)于2024年1月8日至16日检查了你们位于连云港经济技术开发区黄河路38号的江苏恒瑞药业有限公司药品生产场所(FEI 3007373503)。
本警告信总结了成品药品严重违反现行良好生产规范 (CGMP) 规定的行为。请参阅《联邦法规法典》(CFR) 第 21 篇第 210 和 211 部分(21 CFR 第 210 和 211 部分)。
由于你们的生产、加工、包装或保存的方法、设施或控制不符合 CGMP,你们的药品根据《联邦食品药品和化妆品法案》(FD&C 法案)501(a)(2)(B) 节和 21 USC 351(a)(2)(B) 的规定被视为掺假药品。
我们详细审查了您于 2024 年 3 月 7 日对我们的 FDA 483 表的回复,并确认收到了您后续的通信。
在检查过程中,我们的调查人员发现的具体违规行为包括但不限于以下情况。
1. 你们公司的质量控制部门未能履行其职责,确保生产的药品符合 CGMP 并满足既定的鉴别、强度、质量和纯度规范(21 CFR 211.22)。「此处加粗」
贵公司未能提供充分的监督,也未能确保贵公司工厂生产的成品药品质量相关数据的可靠性。例如,我们的检查记录了严重的质量保证 (QA) 缺陷,例如发现丢弃的原始 CGMP 记录堆放在车辆下面的袋子里和附近的垃圾桶里,以及贵公司生产经理在未经 QA 签发的情况下不受限制地访问空白生产批次记录和其他 CGMP 文件。贵公司的 QA 部门没有履行其基本职责,即监督和控制贵公司工厂所有 CGMP 数据的充分性和可靠性。此外,贵公司的 QA 部门有责任确保贵公司员工了解并遵守批次签发程序和数据完整性原则。
您的生产经理反复访问和打印不受控制的生产记录、介质填充记录、目视检查记录、工艺验证批次记录和清洁验证记录的空白副本,这些记录保存在他的计算机上或通过您的文档管理系统保存。当生产员工报告记录中的“错误”时,您的生产经理打印了一份空白副本,并让员工将信息转录到新记录上,然后丢弃旧记录。无法保证存档数据是原始的或准确的。
在您的回复中,您表示将对文档管理软件进行风险重新评估,以便更好地进行控制。您制定了新的文档销毁程序,修订了现有程序,并就新程序和修订程序对员工进行了培训。
你们的回复不充分。你们的回复没有包括对员工创建新记录以纠正错误的全面评估,也没有确定对 CGMP 文件和数据可能产生影响的“错误”的根本原因或范围。
在回复此信时,请提供:
• 全面的评估和补救计划,以确保您的 QA 部门获得有效运作所需的权力和资源。评估还应包括但不限于:
o 确定贵公司使用的程序是否健全和适当
o 在整个运营过程中提供 QA 监督,以评估是否遵守适当的做法
o 在做出 QA 处置决定之前,对每批产品及其相关信息进行全面和最终审查
o 监督和批准调查并履行所有其他 QA 职责,以确保所有产品的身份、强度、质量和纯度
• 描述高级和执行管理层如何支持 QA 和可靠运营,包括但不限于及时提供资源以主动解决新出现的制造/质量问题并确保持续的控制状态。
• 对整个制造和实验室运营过程中使用的文件系统进行全面评估,以确定哪些文档实践不足。包括一份详细的纠正和预防措施 (CAPA) 计划,全面补救贵公司的文档实践,以确保您在整个运营过程中保留同期、可追溯、清晰、完整、原始和准确的记录。
• 描述您为防止操纵和加强对所有 CGMP 记录的控制而制定的计划。具体来说,描述您对所有可能形式松散或易受操纵的 CGMP 记录的协调和完整性改进。根据合格顾问的独立审查,提供差距分析和您将采取的具体 CAPA 措施,以保护记录的完整性(例如,在日志、预分页文档和经过验证的电子系统中记录数据)。
2. 你的公司未能在专门划定的足够大小的区域内进行操作,也未能拥有单独或划定的区域或其他必要的控制系统以防止无菌加工区域的污染或混淆(21 CFR 211.42(c)(10))。「此处加粗」
设施设计不充分
A 级和 B 级分类区域之间没有足够的物理隔离,无法确保你们工厂无菌药品的无菌生产条件适当。例如,(b)(4)常规灌装机两侧的“过渡”A 级区域是生产员工转移(b)(4)无菌设备进行组装和转移(b)(4)药品瓶进行(b)(4)的地方。过渡 A 级区域和周围的 B 级区域仅由(b)(4)隔开。这种设计无法提供足够的保护,可能会损害(b)(4)药品和无菌设备的无菌性。
此外,你们的药品接触设备和用具是通过此 A 级和 B 级露天过渡区域进行灭菌和转移的(b)(4) ,这可能会损害无菌性。
此外,你们缺乏烟雾研究来证明灌装机外 A 级区域和 B 级区域之间的过渡气流。彻底的烟雾研究对于评估和验证你们的无菌加工操作以及确保适当实施所需的设计补救措施至关重要。
最后,用于将(b)(4)药品瓶转移到(b)(4) 的推车前后两侧均敞开。当转移推车穿过 B 级区域时,烟雾研究视频中可以看到空气湍流。此外,在转移(b)(4)瓶的过程中,转移推车中没有监测到非活性颗粒,仅使用沉降板进行环境监测。
在你们的回复中,你们承诺在灌装机(b)(4)的A 级过渡区和相邻的 B 级区域之间使用(b)(4),以提供更好的保护。你们在回复中承认,A 级过渡区和 B 级区域之间的气流没有特征,你们承诺通过执行烟雾研究来评估这些气流。你们承诺使用(b)(4)灭菌设备,并验证(b)(4)设备的新装载模式。
你们的回复不充分。虽然你们承诺遵守A 级层流过渡区屏障的(b)(4),但你们并未提供 A 级区域和 B 级区域之间保护不足造成的污染危害和无菌保证不足的风险评估。此外,提供的烟雾研究表明 A 级区域和 B 级区域之间的空气可视化不是动态的,并未提供生产过程中气流的运行视图。此外,你们的回复和变更控制文件中并未建议对转移到 A 级和 B 级过渡区的所有灭菌设备实施灭菌(b)(4)保护。
数据完整性修复「加粗」
你们的质量体系无法充分确保数据的准确性和完整性,无法支持你们生产的药品的安全性、有效性和质量。有关如何建立和遵循符合 CGMP 的数据完整性实践的指导,请参阅 FDA 的指导文件《数据完整性和药品 CGMP 合规性》 ,网址为(因知乎原因,这里省略网址)。
我们确认您正在聘请顾问来审核您的运营并协助满足 FDA 要求。在回复此信时,请提供:
A. 全面调查数据记录和报告中不准确的程度。您的调查应包括:
• 详细的调查方案和方法;评估涵盖的所有实验室、制造操作和系统的摘要;以及您提议排除的任何操作部分的理由。
• 采访现任和前任员工,以确定数据不准确的性质、范围和根本原因。我们建议由合格的第三方进行这些采访。
• 评估您工厂的数据完整性缺陷程度。确定遗漏、更改、删除、记录销毁、非同期记录完成和其他缺陷。描述您发现数据完整性漏洞的工厂操作的所有部分。
• 对测试和制造数据完整性缺陷的性质进行全面的回顾性评估。我们建议由在发现潜在漏洞的领域具有特定专业知识的合格第三方评估所有数据完整性漏洞。
B. 对观察到的故障对药品质量的潜在影响进行当前风险评估。评估应包括对因数据完整性问题而影响药品放行对患者造成的风险的分析,以及对正在进行的操作带来的风险的分析。
C. 贵公司的管理策略,包括当前行动计划的范围和深度与调查和风险评估结果相称的证据。指出负责数据完整性缺陷的个人是否仍然能够影响贵公司的 CGMP 相关数据或药品申请数据。
• 临时措施,描述贵公司已采取或将要采取的保护患者和确保药品质量的措施,例如通知客户、召回产品、进行额外测试、在稳定性计划中添加批次以确保稳定性、药品申请行动和加强投诉监控。
• 长期措施,描述任何补救措施以及对程序、流程、方法、控制、系统、管理监督和人力资源(例如培训、人员配备改进)的改进,旨在确保贵公司数据的完整性。
• 承诺在执行数据完整性补救方案后,至少两年内聘请合格的顾问进行广泛的年度审计,以协助评估 CAPA 的有效性。
• 告知 FDA 您是否将聘请首席诚信官,该官有充分的权力保持报告数据完整性问题的员工的匿名性,并有权调查潜在的违规行为。
• 已在进行或已完成的上述任何活动的状态报告
结论「加粗」
本函中列举的违规行为并非贵工厂存在的所有违规行为。贵公司有责任调查和确定任何违规行为的原因,并防止其再次发生或发生其他违规行为。
如果您正在考虑采取的行动可能会导致您所在工厂生产的药品供应中断,FDA 要求您立即联系 CDER 药品短缺工作人员,邮箱地址为 drugshortages@fda.hhs.gov,以便 FDA 与您合作,以最有效的方式使您的运营符合法律规定。联系药品短缺工作人员还可以让您履行根据 21 USC 356C(b) 报告药品生产中止或中断的任何义务。这还使 FDA 能够尽快考虑可能需要采取哪些行动(如果有的话),以避免短缺并保护依赖您产品的患者的健康。
及时纠正任何违规行为。FDA 可能会暂停批准将贵公司列为药品制造商的新申请或补充申请,直到所有违规行为得到彻底解决且我们确认贵公司符合 CGMP。我们可能会重新检查以验证贵公司是否已完成对任何违规行为的纠正措施。
未能解决任何违规行为还可能导致 FDA 根据《联邦食品、药品和化妆品法案》第 801(a)(3) 节(21 USC 381(a)(3))拒绝将江苏恒瑞药业有限公司(地址:江苏省连云港市经济技术开发区黄河路 38 号)生产的药品进口到美国。根据该授权,如果药品被发现掺假,则可能会被扣留或拒绝进口,因为其生产过程中使用的方法和控制似乎不符合《联邦食品、药品和化妆品法案》第 501(a)(2)(B) 节(21 USC 351(a)(2)(B))中规定的 CGMP。
这封信函将我们的调查结果告知您,并为您提供解决上述缺陷的机会。收到此信函后,请在 15 个工作日内1以书面形式回复本办公室。说明您已采取哪些措施来解决任何违规行为并防止其再次发生。在回复此信函时,您可以提供更多信息供我们考虑,因为我们将继续评估您的活动和做法。如果您无法在 15 个工作日内完成纠正措施,请说明您延迟的原因和完成计划。
请将您的电子回复发送至xxxx(后面省略,基本都是问候词和办公室地点) 不用担心什么信息泄露,人家直接把这信丢到美国政府官网挂着的,没挂你的回复反复鞭尸已经很给你面子了,末尾的意思是:
这次抽查9天下来的结果失望透顶,早知道延长几天去查了,你这企业的毛病9天都查不完!
<hr/>总有人拿便宜做幌子想混过去。
学小米?小米没有卖你地沟油吧?也没卖你问题车吧?
但是大哥,这是制药啊,这些低级错误有什么风险你不知道吗?药物是吃进肚子里的,有霉菌感染的药物进了患者体内,你决定不是加把火?本来患者就已经因为生病,免疫系统和病菌打得火热,你还半路送援军。。。
你是医人还是杀人???? |
|
 /3
/3 