金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
酶在催化的过程中会先与底物结合形成酶-底物复合物(enzyme-substrate complex, ES),所以当底物浓度达到一定量时,所有的酶分子就会结合上底物,从而使酶饱和。这就可以解释为什么米氏酶具有饱和现象了。所以,米氏酶催化的(单底物)反应式应为
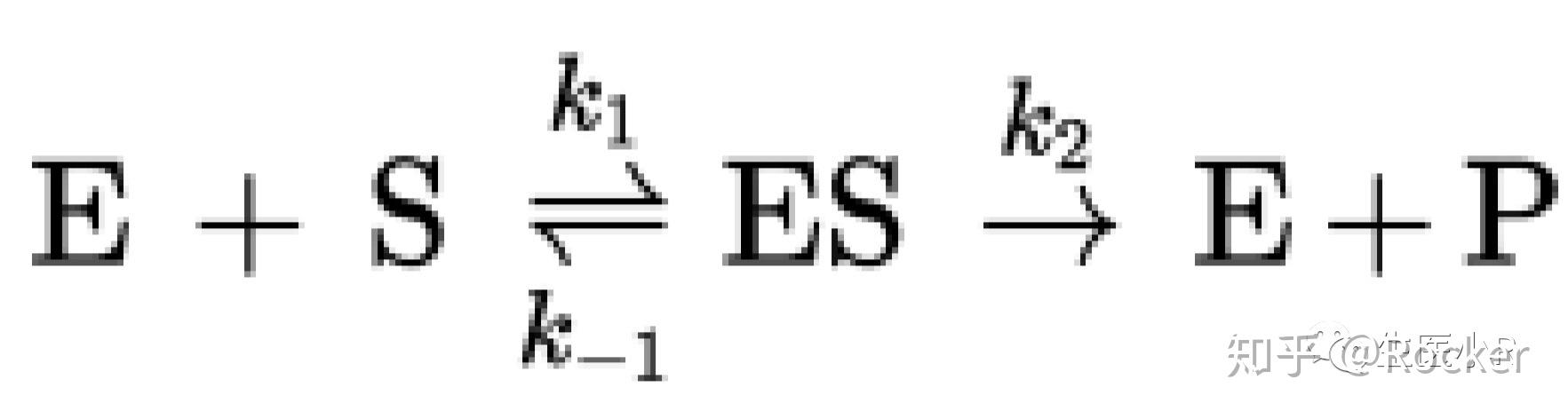
在了解了这些知识以后,我们就可以来推导米氏方程了。具体步骤如下:

米氏常数——Km
米氏常数(Km)是酶的特异性常数,在特定环境(pH、温度等)相同的环境下为定值,只与酶的性质有关,而与酶的浓度无关。
Km有以下几种含义和用途:
① 作为酶的特征性常数,可以用于鉴定酶的种类。例如可以鉴定不同来源或者是相同来源但处在不同发育时期的酶是否属于同一种酶。
② 经过计算我们不难发现当Km =[S]时,产物的生成速率v=1/2Vmax,由此可以看出Km的单位就是浓度的单位,且表示当产物生成速率处于最大速率的一半时的底物浓度。
③ 根据Km的定义(上文在推导米氏方程的时候有提到过),当k2远小于k-1时,Km = k-1/ k1,此时Km约等于解离常数(Kd),所以Km在一定条件下可以表示酶与底物的亲和力。Km越大,亲和力越小;Km越小,亲和力越大。
④ Km可以帮助我们来判断一个可逆反应进行的方向。当一个酶对底物的Km值小于对产物的Km值,则该反应有利于向正反应方向进行。
⑤ Km也可以帮助我们判断一条代谢通路的限速步骤。结合酶分子的在体内的浓度及其Km值有助于我们判断某条代谢通路的限速步骤。
<hr/>最大反应速率——Vmax
在一定酶浓度下,Vmax是一个常数,会受到外界环境的影响。
需要注意的是,我们无法通过实验直接测定Vmax的大小,原因一方面是酶分子饱和是一种理想状态,另一方面是因为部分底物可能受到溶解度的限制,所以导致测定的Vmax值往往小于实际值。所以我们可以通过Lineweaver-Burk作图法找到直线的截距,再取倒数就可以得到Vmax值。
<hr/>催化常数——kcat
Vmax = kcat [Et],对于两步反应(即推导米氏方程时的反应)而言,kcat= k2
当底物浓度很大的时候,Vmax和酶浓度成正比,而kcat可视为一级反应速率,单位是s-1,用来表示酶被底物饱和时每秒钟每个酶分子转化底物的分子数,所以又叫作转换数(turnover number, TN)。
kcat是一个很好的参数去衡量一个酶的催化效率,kcat越高,就说明单位时间内酶转化的分子数就越多,即酶的催化效率越高。
<hr/>kcat / Km
当底物浓度很稀的时候([S]远小于Km),米氏方程可近似写成v=[E][S] kcat / Km,即kcat/ Km是酶与底物反应堆表观二级速率常数(apparent second-orderrate constant),又称为专一性常数(specificity constant),可以从另一角度表现一个酶的催化效率和完美程度,以及酶的最佳底物。而乙酰胆碱酯酶(acetylcholine esterase)、碳酸酐酶(carbonic anhydrase)、顺乌头酸酶(cis-aconitase)和磷酸丙糖异构酶(triose phosphate isomerase, TIM)的kcat / Km值较高,已经到了107~109mol-1·L·s-1,近乎酶kcat/Km值的上限,被认为是比较完美的酶。 |
|
 /3
/3 