金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
沙盘推演:LDT实施会改变什么?【转自:基因江湖】
今年LDT政策会落地。
就如同“新十条”“新二十条”政策出台之时,绝大多数企业或个人(包括笔者)都在观望,或有简单的预判但无实际行动。无论是抗原、布洛芬、Paxlovid、N95,在大多数人反应过来之前,极少数人已经完成了市场收割,从容退场。
现在,还停留在论证LDT的意义、LDT政策会不会出台、什么时候会出来、会写些什么等这些浅显的思考,已没有太大的意义。这就是笔者反复呼吁的,现在一定要立刻行动起来,与政府官员、医院、同行等利益相关方深度讨论,做沙盘推演,设置预案。
政策落地、未明朗之前是最好的准备时机;
政策落地之时,可以预见有一段混乱期,监管部门、医院、企业都是混乱的,需要一段时间的磨合。
这就是企业实现跃迁或弯道超车最好的时间窗口,窗口期不会太长。
1
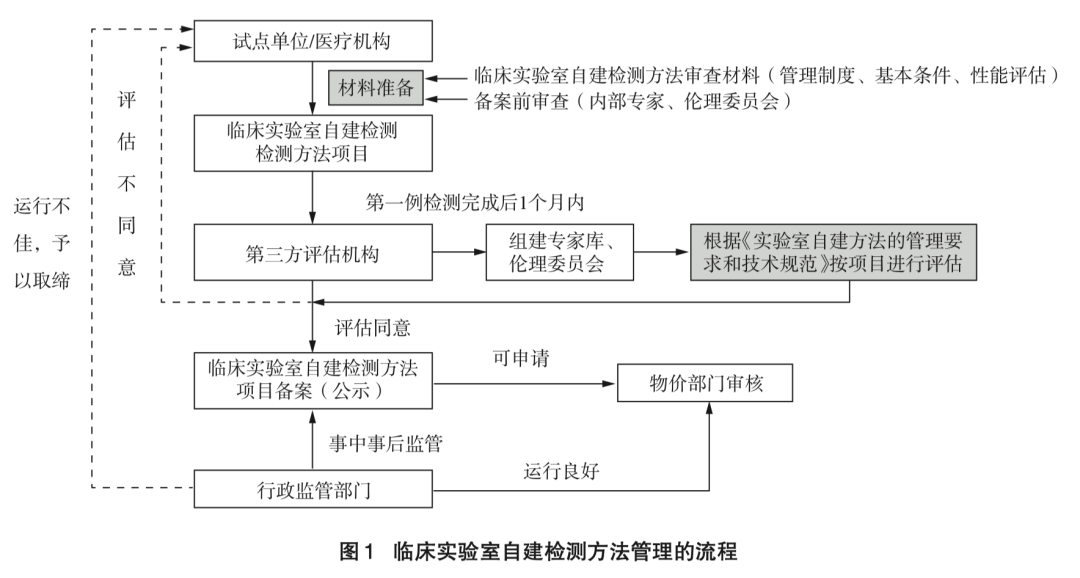
LDT的法理基础,是2021年新版《医疗器械监督管理条例》第53条之规定:“对国内尚无同品种产品上市的体外诊断试剂,符合条件的医疗机构根据本单位的临床需要,可以自行研制,在执业医师指导下在本单位内使用。具体管理办法由国务院药品监督管理部门会同国务院卫生主管部门制定。”
结合部分专家在汇报中简略谈及的具体的管理办法文件(重点注意目录部分):

可大胆推测:
LDT政策实施,会以医疗机构为责任主体,先期试点(医院及项目试点),设置准入门槛,对拟开展项目进行备案管理,药监、卫健委、临检中心多部门联合监管的模式。
具体而言:
“适用范围”是对53条“临床需要”之具体阐述,重点在临床急需的、罕见病、恶性肿瘤、危急重症等检测项目;
“品种范围”“目录确定”是在53条“尚无同品种产品上市”“临床需要”与目前医院实际开展项目情况(成熟度)中取平衡,选取条件兼备且目前运行的成熟的项目作为第一期目录;
“备案管理”“备案信息公开”,需要监管部门及医院建立LDT项目的立项审查程序和相关的工作制度,医院提报一系列资料,监管部门审查及备案公开;
“医疗机构的主体责任”,强调了医疗机构对LDT的立项、具体实施、可能的后果负全部责任,医疗机构是LDT的中心环节和各方的链接纽带。这也对医疗机构提出了非常高的要求,之于53条“符合条件的医疗机构”的表述,医疗机构也会设置准入门槛(or 试点先行);
“鼓励注册”,表明LDT项目一旦运转成熟,具备向IVD产品转化的条件,就应该及时IVD产品化,LDT项目退出,以IVD产品管理模式补充递进。
第一版LDT落地文件,大概率步子不会迈得太大,在大的原则框架下,很多细节不会详细规定,留有操作余地和试错空间,整体还是以适量开放、方便监管为主。事实上,这可能会是一版阉割型、不完美的LDT,与很多同行的期待会存在差距。
2
LDT政策的落地,会给当下各家企业的业务造成实质冲击。冲击的强度取决于监管部门的决心。企业需要预判当前业务遭受冲击的强度。一个既定事实:当前遍地开花的LDT项目,都是在官方的默许状态下进行;一旦有相应的监管流程出现,就看官方是“一刀切死”还是“循序渐进”,生杀大权从来不在企业手中。
所以寄希望于LDT政策的出台,给原本不合规的项目以合法身份;或妄想让企业免于周期长、投资大、风险高的IVD注册流程,都是不切实际的美好想象。
LDT资质,会成为一个新的准入门槛。而这一门槛,在LDT政策落地之前,是0。具体而言,需要企业思考以下问题:
- LDT试点是否会开放给第三方医学检验实验室?如开放,可能会需要哪些资质门槛?是否会新挂一块牌子?或在现有资质上增项?如不开放,仅以大型三甲医院作为LDT实施主体,企业现有运行的业务模式是否满足新的法规要求?
- 目前企业所开展的业务,会进入第一批LDT项目试点\目录吗?未进入试点\目录的项目,是否会面临完全停止?是否可以提前准备,让企业核心业务进入官方目录?
- 即使已在目录的项目,在LDT政策落地之后,是否会面临暂时停止,待提报材料进行备案审核后,方可再行开展?这一过渡阶段,企业该如何做?如何加速这一过程?
- 目前在合作的单位,如若未入选试点,是否会业务停止?如何变通?样本转送有资质的单位or联合挂牌,是否可行?
- LDT项目,会如何收费?具体表现在,在项目立项、审查阶段,是否会要求完全免费,以完成效果评价?如是,现有业务及企业现金流会面临多大冲击?在正式实施阶段,是否会更顺畅进入收费目录?
- 某一LDT项目,一旦有企业完成IVD注册报批程序,现行LDT项目是否会立即停止?
- LDT要求的“仅在本单位使用”,与商业项目的大规模推广复制存在事实矛盾。LDT开发过程中所需人员/技术/资金投入、产生的知识产权成果、未来的商业转化,医院是否有能力、有经验承接?如若没有,医院是否有意愿引入新的合作伙伴或创造一种与医院新的合作模式?在这种合作模式下,企业当前的角色会发生哪些改变?如何进行职能切割与利益切割?
......
以上,均需要企业深度思考、讨论,设置预案。
3
我们可以寄希望于LDT政策的出台,给了一些项目合法的身份,让业务合规;同时也不要封堵现有诸多项目的“默许”状态:即以前是“IVD+LDT(灰色)”两条路,未来是“IVD+LDT(官方)+LDT(灰色)”三条路。但我们也要清醒的看到,“灰色”这条路的封堵,只是时间早晚的问题;LDT也只是走向IVD的过渡形态。
我们也可以寄希望LDT政策会面向广大第三方医学检验所开放,达成真正意义上的LDT。但我们也要评估这种可能性的概率大小,把更多的精力,放在以医院为实施主体、配合医院完成利益最大化的过程中,获取一定的报酬。
企业的角色,这个时候会转变成什么?不一定定义为一家NGSorICL企业,不一定定义为一家仪器试剂的整体解决方案的提供商。医院或医疗集团会不会越变越强,在功能上逐渐取代部分企业的角色,或更激进一些,在医疗领域逐渐“国进民退”化;企业在明面上弱化为LDT相关试剂“原料”的提供者、具体事务的实施者、商业化的代操作者。
这都需要企业从一个更长的历史视角,在不断发展变化中,重新定位企业的角色。更殷切的期盼,各方能以此为契机,改变现有商业模式,一方面让终端收费下来,让患者真正可及、获益,这是我们从业者的真实价值所在;另一方面也让企业能自身造血、自我迭代,真正实现良性循环。
行动,从此刻开始,改变,也从此刻开始。
<hr/>建议扩展阅读:
《上海市临床实验室自建检测方法的市场需求和政府监管政策建议》
《李金明:解读个体化医学检测与实验室自建试剂方法》;
《新规第53条后,LDT离彻底“翻身”还有多远?》 |
|
 /3
/3 