金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
前迪生物 上海前迪生物科技有限公司 2024-02-26 13:13 上海
原文标题:LAMP-Based Point-of-Care Biosensors for Rapid Pathogen Detection
德鲁巴约蒂·达斯,1 林成温,2,3和Han-Sheng Chuang1,4,*
一、摘要:
寻求优秀的传染性病原体检测工具对于减少感染传播至关重要,从而为感染者提供及时的医疗护理。在基于核酸的传感技术中,环介导的等温扩增(LAMP)是一种很有前途的方法,因为它可以快速、灵敏和特异性地检测微生物和病毒病原体,并且具有改变当前即时分子诊断的巨大潜力。在这篇综述中,概述了过去几年中开发的基于LAMP的即时诊断检测方法的进展,用于快速和灵敏地检测传染性病原体。本文讨论了基于LAMP的生物传感器的多种检测方法,并提供了理想的示例。我们还总结了LAMP-on-a-chip模式的趋势,如经典的微流控、纸基和数字LAMP,以及它们的优点和局限性。最后,我们对LAMP方法的未来改进提出了自己的意见。本综述概述了LAMP方法的最新突破及其在现有和新发疾病诊断中的应用潜力。
关键词:环介导的等温扩增, POCT, 病原体检测, 生物传感器, 微流控, 数字LAMP
二. 引言
即时 (POC) 测试在POC测试非常适合资源有限的环境,因为它们价格实惠,几乎不需要设备,并且无需对患者进行后续检查。核酸扩增检测(Nucleic-acid Amplification Tests, NAATs)在POC诊断中发挥着重要作用,它以相对较低的浓度进行病原体检测,从而可以在非常早期的阶段控制感染的传播。在NAAT中,聚合酶链(PCR)反应是最常用的技术,并且仍然是金标准。然而,对复杂的热循环、精密仪器、熟练的技术人员和较长的反应时间的依赖阻碍了它在资源匮乏环境中的使用。此外,基于PCR的现场诊断方法的发展受到非特异性扩增和假阳性风险较高的进一步阻碍。近年来,许多最先进的技术被开发用于快速病原体检测,例如酶联免疫吸附测定 (ELISA) 、表面增强拉曼光谱 (SERS) 、表面等离子体共振 (SPR) 、电化学生物传感器和成簇规则间隔短回文重复序列 (CRISPR)。尽管这些技术很有前途,但它们目前无法完全解决与病原体检测相关的困难,因为它们在资源匮乏的地区实施受到对大量预处理、复杂设备和昂贵标签的需求的阻碍。人们仍然需要开发集成的生物传感器,以高灵敏度快速、精确地检测传染性病原体。
等温核酸扩增检测(isothermal nucletic acid proplification tests, iNAATs)已被开发为一种高精度、快速和经济高效的核酸扩增的替代方法。等温扩增 (IA) 在恒定温度 (35–65 °C) 下工作,反应时间为 60–90 分钟。因此,它只需要简单的硬件进行加热,并且易于与微流控装置集成。此外,IA对酶抑制剂具有更高的耐受性,使其成为一种强大的扩增方法。该方法包括环介导的等温扩增(LAMP)、重组酶聚合酶扩增(RPA)、滚环扩增(RCA)、基于核酸序列的扩增(NASBA)和解旋酶依赖性扩增(HDA)。其中,LAMP被认为是最有前途和最稳健的,因为在短时间内(20-30分钟)从低浓度的靶分子中形成大拷贝数。特别是,LAMP反应产生的扩增产物是任何其他基于PCR的扩增技术至少50倍。LAMP还具有扩增130-300 bp的多种靶DNA的潜力,从而扩增病原体的多功能DNA。逆转录LAMP(RT-LAMP)技术用于使用逆转录酶扩增RNA分子,以从RNA中合成cDNA。与其他 IA 相比,LAMP 具有额外的优势;例如:(i)RPA需要重组酶、用于单链DNA结合的蛋白质和用于链置换的聚合酶,但在LAMP中,使用单一DNA聚合酶[16];(ii)LAMP是一步反应过程,而在RCA中,扩增前需要额外的连接步骤[17];(iii)LAMP可扩增DNA和RNA分子,但NASBA仅用于扩增RNA分子[10];(iv)与其他IA方法不同,LAMP使用4-6个引物,使其具有高度特异性[18];(v)LAMP对聚合酶抑制剂的耐受性也非常高,因此非常适合直接分析体液和其他临床样本,而无需进一步富集样本[19,20]。此外,LAMP方便的设计指南吸引了更多的用户,这有助于在过去二十年中创建一个强大的研究数据库。此外,LAMP的无专利状态使LAMP可用于开发商业产品,用于POC传染病的快速和现场诊断。
在过去十年中,基于LAMP的POC生物传感器取得了重大进展,同时已经开发了许多检测技术,如比色法、电化学法、侧向层析法、光学法和基于智能手机的方法,用于检测LAMP扩增产物。基于LAMP的方法及其在食品安全中的应用之前已有综述,但尚未具体应用于临床环境。在本文的范围内,我们深入讨论了基于LAMP的POC检测传染性病原体的最新进展,以及基于终点及实时监测的LAMP扩增产物的检测方法。基于LAMP的系统和芯片实验室(LOC)设计的优缺点也通过每种方法的实例进行演示和说明。
三、 LAMP检测概述
3.1. 原理
等温扩增(IA)是一种简单、快速、高效的方法,无需使用额外的先进高科技设备即可在恒温下扩增核酸。由于操作简单,IA方法易于与微流控芯片集成,以开发快速、灵敏和现场POC诊断工具。在 1991-2006 年间开发的 IA 方法中,LAMP 已成为一种快速、稳健且高度特异性的核酸扩增技术,能够在短时间内在单步反应中产生大量产物。Notomi等于2000年首次报道了LAMP,此后,LAMP在研究、临床和工业应用中广受欢迎,并对昂贵的热循环仪的依赖而成为传统PCR的替代品。此外,LAMP对酶抑制剂的高耐受性使其成为临床和生物样品现场检测的合适候选者,无需任何样品富集。与传统PCR不同,LAMP需要四种特异性引物,靶向DNA上的六个不同区域(F3c、F1c、F2c、B2c、B1c和B3c),从而增强特异性。这组引物包括两个内引物,称为前向内引物(FIP)和后向内引物(BIP),而F3和B3是两个外引物,也称为“置换引物”。图1显示了LAMP反应的机理。内引物 FIP 和 BIP 分别由杂交序列 F2 和 F1c 以及 B2 和 B1c 组成。内引物包含独特的“折回”排列,可产生茎环基序。LAMP放大可以分为两个步骤,即结构创建和循环放大。LAMP受益于具有链置换活性的DNA聚合酶,避免了在每个扩增周期之间对dsDNA变性进行复杂的热循环步骤。在第一步中,内引物的 F2 与靶架的 F2c 结合,由于聚合酶活性而启动 DNA 合成。接下来,外部引物的 F3 与 F3c 结合,然后是新鲜合成的 DNA 的置换和靶 DNA 的释放。含有互补的 F1 和 F1c 区域的释放链产生茎环结构。在 3' 末端,将在与 BIP 和 B3 类似的机制下形成另一个茎环结构,形成“哑铃”状结构。这种“哑铃结构”作为循环扩增步骤的起始材料。因此,LAMP在快速周期内产生大量扩增产物。由于这些特性,LAMP非常适合用于POC生物传感器,具有简单、弹性、微型和易于操作的特点。
图1
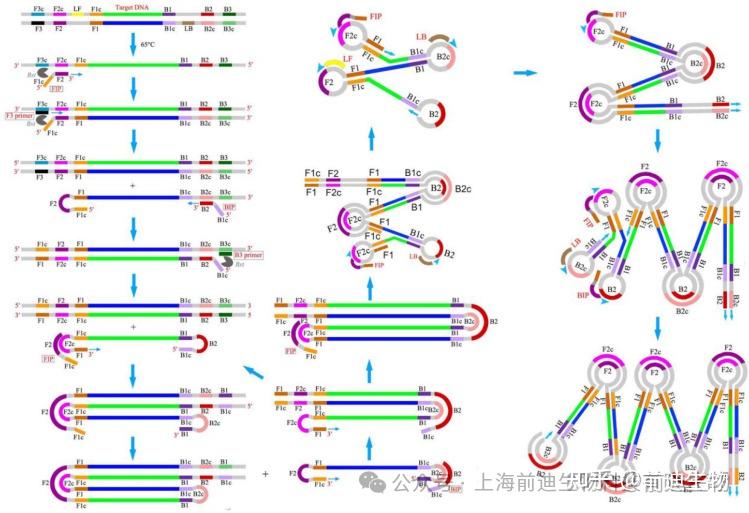
3.2. 引物设计
除了四种基本引物(FIP、BIP、F3和B3)外,LAMP还利用了另外两种环引物,即正向环引物(LF)和后向环引物(LB)[18],以加速扩增并将时间缩短到通常的三分之一。环区通常位于哑铃结构的 B1-B2 和 F1-F2 之间,为 LAMP 提供了额外的起始位点。LAMP引物设计的基本原理如下:(i)F2和F1c与B2和B1c之间应有40-60个碱基的最小距离,以便有足够的空间来生成环引物;(ii)应避免二核苷酸重复(例如,AGAGAG)和单个核苷酸重复超过三次(例如,ATTTT),因为这会导致错误引发;(iii) 应避免三次或三次以上的 G 运行,因为这可能会引起引物合成和纯化的问题;(iv)为避免二级结构的形成,所设计的引物的3'端不应富含AT或相互互补;(v)引物对(例如F2和B2)的Tm应与5°C的最大温差相似,并且F1c和B1c的Tm应高于F2和B2,以便立即形成茎环结构;(vi) 在富含GC的引物的情况下,熔融温度(Tm)应约为60-65°C,在富含AT的引物中,熔融温度应在55-60°C左右。 由于形成更多数量的氢键,富含 GC 的引物需要相对较高的 Tm。引物的Tm使用公式(1)计算;(vii)为了获得更高的稳定性引物,ΔG F1c/B1c 的 5' 端和 F2/B2 和 F3/B3 的 3' 端的值应小于 −4 kcal/mol;(viii)为了消除二级结构的形成,3'末端不应富含AT。NUPACK软件(4.0版,由Niles A. Pierce教授及其团队创建,版权所有© 2006-2022加州理工学院,http://www.nupack.org/partition/new,2022年7月20日访问)用于分析推定的二级结构,以及引物二聚体的产生和杂交稳定性。除此之外,有报道称,在FIP的F2和F1c之间以及BIP的B2和B1c之间整合poly T linkers(TTTT)可以通过形成环来提高反应速度。
Primer explorer V5(http://primerexplorer.jp/elamp4.0.0/index.html,2022年7月20日访问)是LAMP引物设计最常用的软件。所选目标区域的长度应为 200–2000 bp,保存的序列只能以 FASTA、.txt 或 GenBank 格式上传。使用Primer Explorer V5设计LAMP引物的步骤如下:(i)启动程序,上传正确格式的序列文件,点击“引物设计”显示目标序列的区域;(ii)点击“生成”,获取特定基因序列的最佳五种引物选项的设计引物;(iii) 选择具有最高ΔG二聚化值,然后单击“显示”以在新窗口中展示设计的引物列表;(iv) 选择具有ΔG F1c/B1c 的 5' 端和 F2/B2 和 F3/B3 的 3' 端的 ≤−4 kcal/mol 值,然后单击“确认”以获取特定的引物详细信息;(v) 选择合适的引物组后,点击“引物信息”保存文件以进行循环引物生成,然后点击“保存”以Word/Excel文档下载引物序列;(vi) 生成环引物,重新启动软件并上传步骤(v)中保存的文件;(vii) 点击“引物设计”以显示目标序列中的LF和LB;(viii) 接下来,点击“生成”,然后点击“显示”,在新窗口中获得设计的LF和LB引物;(ix) 选择最高ΔG二聚化值,然后单击“确认”以显示引物详细信息;(x) 最后,选择最低的环引物ΔG值在 3' 末,然后单击“保存”以下载引物。BLAST工具(http://www.ncbi.nlm.nih.gov,2022年7月20日访问)用于检查每个设计引物的特异性。设计的引物应对靶基因序列表现出高特异性。该软件还提供高级设置,可灵活选择富含 AT 和 GC 的选项以及所需的 Tm,以设计特定靶标的定制引物。然而,不建议改变引物的长度。Primer explorer V5 是一款简单易用的 LAMP 引物设计在线工具;然而,它有一些局限性,例如,(i)不可能同时设计环引物;(ii)它只允许高达2000 bp的基因序列;(iii) 除 ATGC 外,它不支持任何其他 IUPAX 字符;(iv)它只允许一个执行过程。
除了引物浏览器外,还提供多种在线引物设计软件工具,例如Premier Biosoft、Optigene LAMP设计器、NEB LAMP引物设计器工具等。近年来,已经发表了几种用于设计基于靶标的引物的方法。例如,Zhang等开发了一种新的Python脚本,用于设计基于LAMP的变异特异性探针来检测癌症突变,使用ESR1p.E380Q和ESR1 p.Y537S癌症特异性突变的序列进行评估,因为该算法通过DNA序列的输入为各自的靶标生成两个最佳引物集。在另一项研究中,Jia等提出了一种基于全基因组的LAMP引物设计(GLAPD)工具,可通过以下网站下载:http://cgm.sjtu.edu.cn/GLAPD/ 或 https://github.com/jiqingxiaoxi/GLAPD.git(2022年7月20日访问)和 http://cgm.sjtu.edu.cn/GLAPD/online/(2022年7月20日访问)。这是一种新方法,它使用完整的基因组为一组靶基因组创建LAMP引物,用于快速检测食源性病原体,其结果与具有相同核苷酸序列的Primer explorer V5相似。此外,Savonnet等还提出了一种理论方法,他们从反应速率的基本原理研究了LAMP第二阶段的动力学,并从实验信号发展中推断出物理化学性质。研究中使用的哑铃结构跳过了LAMP的第一阶段。该模型预计扩增产物的浓度将根据逻辑函数而上升。
3.3. 快速病原体检测的功能
由于形成高拷贝数(~109)可以在短时间内(<1 小时)形成,LAMP被认为是用于快速病原体检测的最有效和最流行的诊断工具之一。内引物在LAMP中起着至关重要的作用,因为它为使LAMP成为一种稳健、快速和先进的扩增方法带来了很多好处。从本质上讲,内引物的链位移发生在恒定温度(60–65°C)下,无需复杂的热循环,并使LAMP因其简单的设计和快速性而成为POC器件的合适候选者。茎环结构提供基于自引的扩增,允许产生大量独立于模板 DNA 链的扩增产物。因此,这会在短时间内产生高拷贝数的 DNA,从而能够以非常高的灵敏度快速检测靶标。LAMP对抑制剂具有很高的耐受性,减少了样品预处理的工作量。因此,基于LAMP的简单“进-出样-出”POC器件的理想是可行的。与其他方法相比,LAMP使用4-6种不同的引物,靶向六个不同的区域,使其具有高度特异性。与任何靶序列的不匹配都会导致负扩增,从而消除非特异性扩增的机会。据报道,与金标准PCR相比,LAMP测定可能具有更高的灵敏度。每次反应的检出限可低至5拷贝。因此,LAMP可用于疾病早期诊断和遏制传染性病原体的传播。此外,在LAMP过程中焦磷酸盐分子的产生,可以通过肉眼识别结果,使检测方法变得简单易行,无需使用任何昂贵的仪器。作为另一个因素,LAMP产生具有300至25 kb不同碱基对长度的聚合靶DNA。这种大量扩增的核酸可能会增加溶液的粘度。这种微观层面的粘度变化可以通过一种称为旋转扩散计的先进超灵敏颗粒成像技术来检测,从而将检测时间缩短到10分钟以内。
另一个名为CRISPR/Cas系统的微型工具已与LAMP集成,用于以非常高的灵敏度快速检测致病核酸(NA)。首先,Cas蛋白(Cas9、Cas12和Cas13)与称为CRISPR-RNA(crRNA)的特殊RNA序列形成复合物,一旦与特定靶RNA/DNA结合,就会被激活,从而触发Cas蛋白的切割机制。随后,这种活化的复合物切割携带荧光团和淬灭剂的报告探针,释放出荧光。检测可以通过监测荧光和侧流试纸进行。最近,CRISPR与RT-LAMP联合用于快速、高度准确的COVID-19POC诊断。由于LAMP操作简单,这些超灵敏和高精度的先进检测技术很容易集成,使LAMP成为一种快速灵敏的病原体检测工具。在下一节中,我们将讨论用于监测LAMP反应的各种终点和实时检测方法。
四. LAMP检测方法
4.1. 终点检测
4.1.1. 比色检测
LAMP产品的比色检测可分为浊度和染料使用两大类。在LAMP反应过程中,脱氧核糖核苷酸三磷酸(dNTPs)与硫酸镁(MgSO4),产生焦磷酸镁白色沉淀Mg2P2O7,增加溶液的浊度。不需要额外的读数仪器,因为浊度的变化可以由肉眼确定。Garg等成功引入了基于LAMP的比浊法检测麻风分枝杆菌靶向16s rRNA基因。同样,类似的研究报告了多种病原体的检测,例如肉毒梭菌、肺炎链球菌和无乳链球菌。然而,这种方法的灵敏度较低,因为微弱的产物很容易被误判。
作为浊度法的替代方法,分子探针用于LAMP产品的比色检测。最常见的比色指示剂是金属离子指示染料,即钙黄绿素、羟基萘酚蓝(HNB)加铬合金黑T(EBT)、pH敏感染料(酚红、中性红)和其他荧光探针。这些染料在LAMP扩增子的存在下提供显著的颜色变化,但不会抑制扩增过程。因此,它们可以在LAMP反应开始时添加。此外,各种DNA染料,如SYBR Green I、碘化丙啶(PI)和SYTO-81,用于检测高灵敏度的LAMP产物,并且可以在可见光或紫外线区域下轻松监测。HNB和钙黄绿素是LAMP比色检测最常用的染料。最初,钙黄绿素与 Mn2+离子 结合,使其荧光活性熄灭,LAMP反应混合物呈橙色。然后,Mn2+离子与焦磷酸盐P2O74-形成络合物。在扩增过程中,从而恢复绿色荧光。此外,钙黄绿素-Mg2+复合物进一步增强了荧光信号形成。同样,由于 Mg2+离子的浓度的减少,HNB 的颜色从紫色变为蓝色。Zhu等开发了一种基于毛细管阵列的POC平台,结合LAMP通过靶向5个不同的基因(D1133L、B962L、B646L、G1340L和C717R)来检测非洲猪瘟病毒(ASFV)。毛细管阵列因其蜂巢状形状而被命名为“蜂巢芯片”,其中试剂通过毛细管加载并分布在芯片内。使用氢氧化钠处理的直接血样用于 LAMP,无需任何进一步的 DNA 提取,并使用钙黄绿素染料在 70 分钟的测定时间内显示 LOD 为 50 copies/μL。在另一项研究中,Yao等设计了一种PDMS制造的便携式自驱动微流控芯片,能够自动快速地加载RT-LAMP的样品。该系统可以检测八种媒介传播病毒,包括基孔肯雅病毒(CHIKV)和登革热病毒(DENV)。基于钙黄绿素的比色检测在短短 50 分钟内实现了 CHIKV 和 DENV-1 的 100copies LOD,其中包括 3 分钟自供电样品加载和 45 分钟 RT-LAMP。此外,使用120个蚊子样本和50个临床样本测试的所开发方法提供了与RT-PCR分析一致的结果。同样,开发了另一个自我驱动的POC微流控平台,作为与LAMP的组合,用于对钙黄绿素赋能的血源性病原体进行快速比色检测。试剂可在 12 分钟内加载到自驱动芯片中。LAMP 50 分钟后,使用智能手机摄像头记录和监测结果。对人类免疫缺陷病毒(HIV)、乙型肝炎(HBV)和丙型肝炎病毒(HCV)三种病原体进行了多重检测,LOD为2copies/μL,周转时间为65 min。Jin等设计了一种自吸区室化(SPC)微流控平台,用于基于HNB的食源性病原体肉眼检测。微流控LAMP平台的自充填是通过负压实现的。最重要的是,封闭的孔消除了交叉污染,以确保准确性。通过SPC装置实现了对6种食源性病原体的同时检测,检测限为102–103CFU/mL,测定时间为 60 分钟。在另一项研究中,邓等报道了一种基于LAMP的便携式独立设备,用于SARS-CoV-2病毒的POC诊断。设计了由基于PDMS的微流控芯片组成的一次性小柱,用于执行试剂运输、病毒裂解和RT-LAMP反应(图2微芯片操作由电池供电的基于Arduino的微控制器控制,其尺寸为6 × 9×4 cm3.袖珍型设备每次反应可比色检测 300 个copies的 RNA,样品到答案的时间为 30 分钟。
在LAMP期间,pH敏感染料可以通过溶液的pH值来感知扩增的DNA分子,pH值会因产物而降低。例如,开发了一种POC诊断方法,用于使用对pH敏感的甲酚红染料(图2DNA提取是通过化学裂解实现的,这消除了耗时的多步骤纯化过程。通过以高灵敏度和特异性直接观察受污染牛奶样品中从红色到黄色的颜色变化,实现了~2个孢子/mL的LOD。Ye等开发了一种基于玻璃纤维纸的POC诊断工具,能够在5 min内提取RNA,在25 min内对靶基因进行等温扩增,并目视读出最终产物。这种低成本的纸盘在检测轮状病毒 A 获得了 1 × 103 的copies/mL LOD,通过使用对 pH 敏感的中性红色染料, 具有非常高的特异性。此外,该纸质设备已使用48个临床样本进行了测试,并显示出与金标准RT-PCR相当的检测灵敏度。在另一项研究中,Song等通过直接肉眼检测比色检测结果(图2完整的工作流程,包括样品采集、RNA纯化、靶基因的等温扩增以及结果的视觉分析,只需不到60分钟。以下冻干方案允许RT-LAMP试剂在室温下长期储存10天。LOD达到100个RNAcopies/反应,特异性为99%。
染料SYBR Green I在白光下表现出可见的颜色变化(红橙色到黄绿色),并在紫外线区域发出荧光,过去曾用于监测LAMP反应。例如,Wang等报道了在30 min内检测到LOD为10 pg/μL的镰刀菌增殖。此外,基于SYBR Green I的LAMP测定法用于检测单核细胞增生李斯特菌(单核细胞增生李斯特菌)、肝脯虾肠胞动物、紫云英矮小病毒和炭疽芽孢杆菌。最近,Oliveira等报道了在完全集成的自动化POC设备中基于RT-LAMP的SARS-CoV-2检测。SYBR green I 用于病毒基因组的比色检测,LOD 为 10−3copies/反应。使用这种开发方案测试的临床样本与实时 qPCR 密切相关,展示了在资源有限地区快速诊断 COVID-19 的可靠工具。在另一项研究中,开发了一种基于RT-LAMP的集成聚碳酸酯POC检测设备,用于在50分钟内对SARS-CoV-2和甲型H1N1流感病毒进行多重检测(图2D). 这种多路复用平台允许试剂混合和制备,无需任何电源插座或移液。使用球基阀系统进行样品输送,从而实现纸质RNA富集和试剂制备。SARS-CoV-2 和 H1N1 病毒的比色检测实现,每次反应的 LOD 分别为 2 个和 6 个基因组。此外,该设备可以检测临床和环境样本中的病毒颗粒。Bokelmann等提出了Cap-iLAMP的首字母缩写词,用于捕获和改进的环介导的等温扩增方法,用于基于智能手机的比色法检测漱口灌洗液样品中的SARS-CoV-2(图2这种利用杂交捕获进行RNA纯化的批量测试方法可在55 min内实现500copies/反应的检测灵敏度。Cap-iLAMP 允许在 25 个阴性样本池中识别单个阳性样本,从而消除假阳性,将每次测试的试剂成本降低到每人 1 欧元以下。比色检测消除了昂贵的阅读器和信号处理单元的使用,使其成本低且易于操作。然而,它是定性的,获得定量分析仍然具有挑战性。
图2
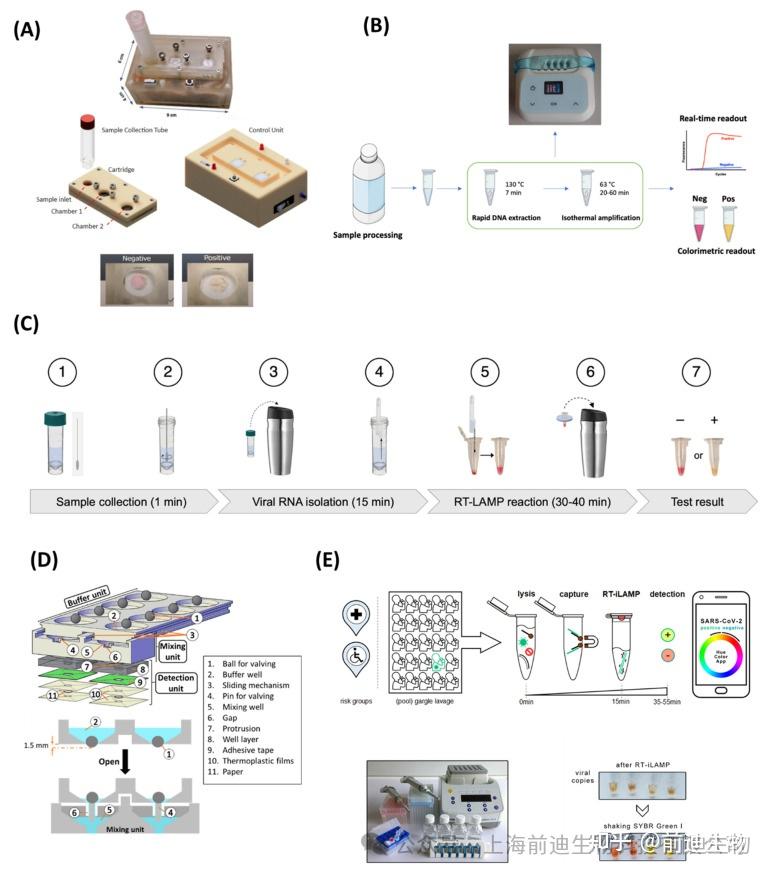
基于LAMP的生物传感器,使用染料检测。(A) 使用一次性墨盒和基于 Arduino 的可重复使用的微控制单元对 SARS-CoV-2 病毒进行独立设备诊断。(B) POC时牛奶中酪丁酸梭菌的示意图。(C) 基于热水瓶的 COVID-19 家庭测试的插图。(D) 聚碳酸酯POC测试装置,带有球基阀系统,用于样品输送和试剂制备。(E) Cap-iLAMP的工作流程。
4.1.2. 电化学检测
电化学传感器已显示出有希望的优势,例如快速检测、高灵敏度和选择性,可用于开发 POC 诊断工具。在过去的几十年里,它们已被广泛探索用于检测单核苷酸多态性(single nucleotide polymorphisms, SNP)、核酸及其扩增产物。LAMP与电化学传感器的集成,由于与LAMP产物相互作用而产生的氧化还原,可以通过测量电活性分子。从而对各种分析物进行快速和超灵敏的检测。另一种策略是用氧化还原报告器将探针固定在工作电极表面,氧化还原报告器可以通过线性扫描伏安法(LSV)、方波伏安法(SWV)、差分脉冲伏安法(DPV)或电导率监测电化学信号。LAMP产物可以在反应后检测,也可以通过电化学传感器实时监测。关于实时检测,可以使用许多氧化还原分子,包括亚甲蓝(MB)和钌六胺,因为它们不会抑制DNA扩增。然而,其中一些,即Hoechst 23458,可能会阻碍LAMP反应,并且不能用于瞬时检测[74]。
Jaroenram等使用内部微型恒电位仪测量以Hoechst-33258为电化学氧化还原剂(图3该测定对结核分枝杆菌的LOD为40 CFU/反应,反应时间为65 min。使用类似的电极系统和便携式恒电位仪检测副溶血性弧菌(V. parahaemolyticus)的LAMP产物,在45 min内每25 g生海鲜的检测限为0.3 CFU。在另一项研究中,Fu等开发了一种基于LAMP的B组链球菌(GBS)电化学传感器,其检测范围很广,可达1 fg μL−1至 100 pg μL−1.将硫醇化β-环糊精(SH-β-CD)固定在AuNPs@MoS2-上通过Au-S键合改性的玻璃电极表面。因此,二茂铁 (Fc) 修饰的引物能够通过 Fc 和 β-CD (图3MB作为氧化还原剂,在与LAMP产物相互作用时产生强电化学信号,检测限低至0.23 fg μL−1.在另一项研究中,Zamani等介绍了一种基于CRISPR/Cas12a激活的人瘤病毒(HPV)病毒传感器,其LOD为104copies每次反应。将亚甲基蓝色标记的寡核苷酸固定在金箔电极上(图3C).方波伏安法(SWV)通过Cas12a酶活性对亚甲基蓝标记寡核苷酸进行电化学读数。其他研究采用基于地高辛标记核苷酸 (DIG-dUTPs) 的 LAMP 和链霉亲和素修饰的磁珠的组合,用于碳基电极系统中 HPV16 和 HPV18 的分离和安培检测。在成功的LAMP反应后,将得到的扩增子与修饰的磁珠一起孵育,然后与辣根过氧化物酶(HRP)偶联抗DIG Ab。使用磁铁将磁珠集中在电极表面,并对HRP反应进行安培监测。在下一次尝试中,对两种基因型的 61 份宫颈样本进行了筛选,并通过实时荧光定量 PCR 和商业 HPV 检测(如 INNO-LiPA 和 COBAS)进行了验证。该系统的准确率为90%。最近,Ramírez-Chavarría等提出了一种基于LAMP的低成本电化学传感器,用于特异性检测SARS-CoV-2基因序列,其中RT-LAMP是在由丝网印刷电极组成的一次性试纸上进行的。亚甲蓝被用作电化学氧化还原探针,在与LAMP产物相互作用期间提供扩散控制电流,因为选择方波伏安法(SWV)进行电化学读数。试纸的检测灵敏度为 2.5 × 10−6ng/μL,以及高特异性和重现性。
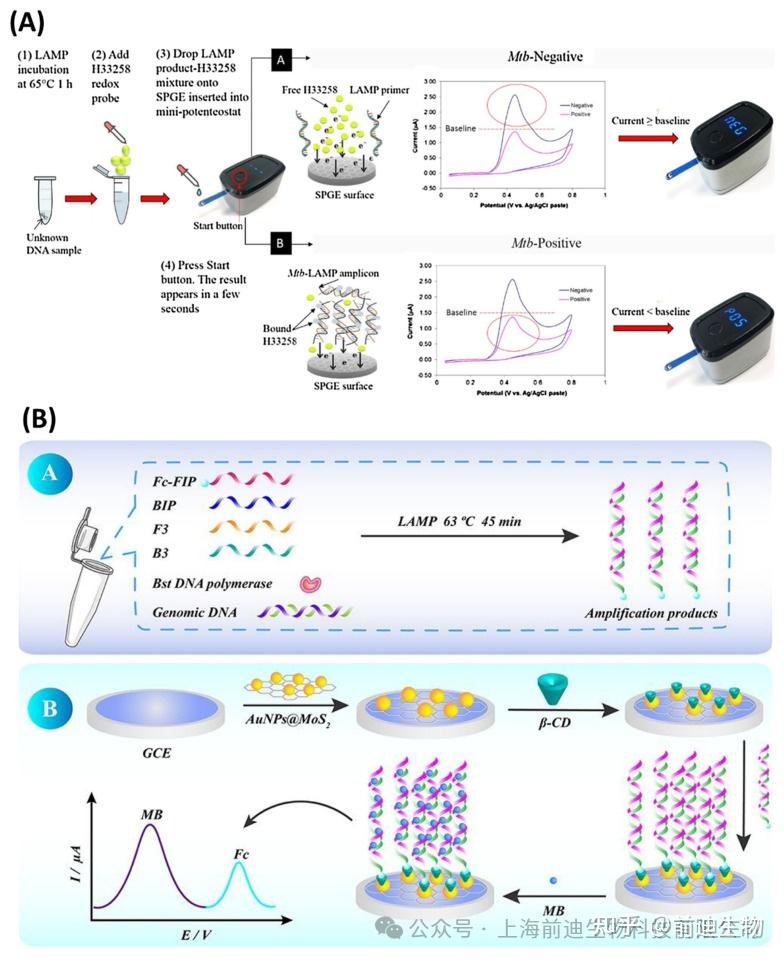
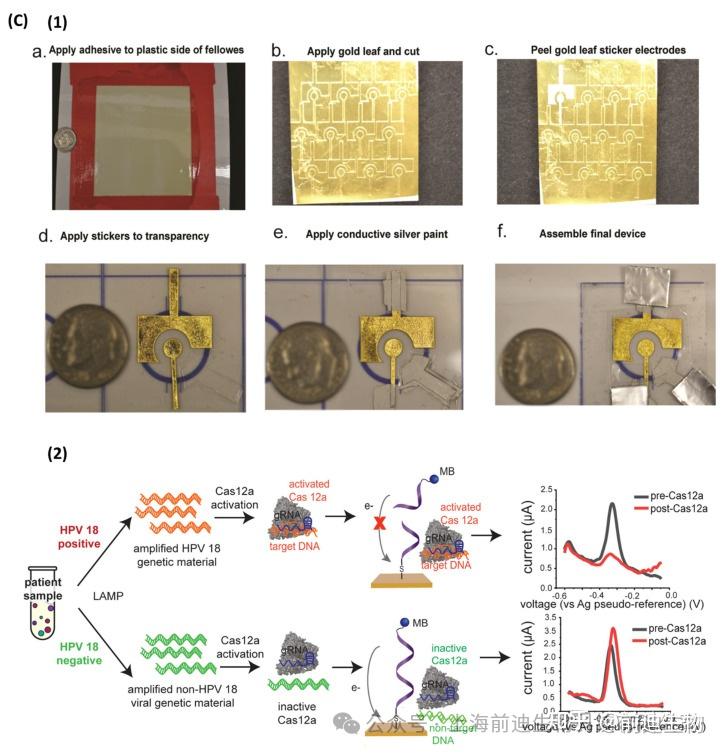
Figure 3
LAMP−based electrochemical sensors. (A) LAMP amplicon detection on a screen-printed graphene electrode (SPGE) using a portable potentiostat device. (B) Schematic illustration of LAMP E-sensor for detection of Group B Streptococci. (C) (C1) Gold-leaf electrode’s fabrication; (C2) Working principle of CRISPR/Cas12a activation-based sensor for detection of the HPV virus. Reproduced with permission from references. Copyright 2020 Elsevier, 2021 American Chemical Society.
4.1.3. 侧向层析检测
近年来,侧向层析检测(LFT)被广泛用于基于LAMP的快速POC诊断检测。侧向层析检测条上的测试线可捕获与异硫氰酸荧光素 (FITC) 标记的 DNA 探针杂交的生物素标记的 LAMP 扩增产物,这些探针随后与胶体金标记的抗 FITC 抗体结合以产生清晰的结果。非杂交的 FITC 探针附着在金标记的抗 FITC 抗体上,产生一种不含生物素的双复合物,从测试线到对照线。提取基因组DNA对肺炎支原体的检测灵敏度为600 fg/反应,耐甲氧西林金黄色葡萄球菌(MRSA)和铜绿假单胞菌的检测灵敏度为630 fg/反应,对副溶血性弧菌的检测灵敏度为630 fg/反应,对沙门氏菌的检测灵敏度为13.5 fg/μL。为了获得更高的灵敏度和准确性,各个研究小组研究了纳米材料和酶增强。例如,Shi等开发了一种基于单叠氮化丙啶(PMA)的纳米酶条,用于单核细胞增生李斯特菌的活性检测,LOD为10 CFU/mL。纳米酶与DAB/H2O2之间的酶促反应进一步增强了颜色变化(酶底物)。金纳米颗粒被Fe3O4纳米颗粒取代,提供了更好的分散性。在另一项研究中,Shang等开发了一种基于量子点纳米珠的LFT,用于定量检测鼠伤寒沙门氏菌(S. typhimurium)。视觉 LOD 为 103CFU/mL 的线性范围102–108CFU/mL,比 AuNPs 标记的试纸高 10 倍。Yang等报道了聚合物纳米颗粒侧向流动生物传感器联合LAMP检测流产布鲁氏菌靶向BruAb2_0168基因。该测定实现了 100 fg/反应的 LOD,反应时间为 85 min。此外,还报道了一种基于 LAMP 的多重 LFT 用于检测两种引起疟疾的寄生虫,即间日疟原虫和恶性疟原虫,其中 FITC 和地高辛标记的探针与具有互补核苷酸序列 (图4A).在60分钟内,两个物种的条带上都出现了清晰的条带。提取的基因组DNA的检测灵敏度达到0.15 pg/μL。
LFT 与 RT-LAMP 联合已被证明是在 POC 快速诊断 COVID-19 的有前途的工具。Zhu等设计了一种基于聚合酶-纳米颗粒的LFT与RT-LAMP偶联,用于在单个反应管中使用两组LAMP引物同时检测SARS-CoV-2基因组中的特定基因。ORF1ab 和 N 基因的引物分别用 FITC 和地高辛标记,并带有额外的生物素标签。在测试线中,FITC、地高辛和生物素标记的双链 LAMP 扩增产物与抗 FITC/地高辛之间的免疫反应产生了特征性的深红色条带,能够以 12 copies/反应的 LOD 对两个基因进行多重检测。从样本采集到结果整个过程在1小时内完成。在另一项工作中,开发了一种手掌大小的便携式微流控平台,该平台集成了妊娠试验条 (PTS),用于 SARS-CoV-2 基因组的 POC 诊断(图4B)。 高特异性人绒毛膜促性腺激素探针 (hCG-p) 被设计为与 RT-LAMP 扩增子的特定环区杂交,因此无法穿过 PTS,仅出现在条带上的对照线上。通过现场肉眼可视化,实现了LOD为0.5copies/μL的超灵敏检测,检测时间为120分钟。LAMP提供靶标的特异性放大,侧向层析传感器提供一种廉价且简单的读出方法。因此,LAMP与肝功能检查相结合,在创建POC诊断平台方面具有巨大的潜力。该技术可以与微流控平台结合使用,以实现高通量分析,同时消除交叉污染的可能性。
图4
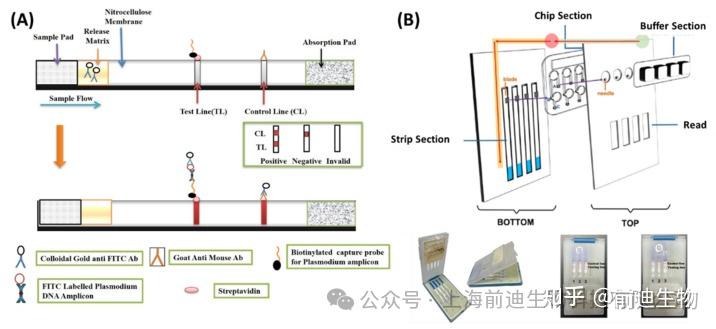
基于LAMP的侧向层析生物传感器。(A) 用于检测 LAMP 扩增子的侧向层析试纸的轮廓。(B) 与妊娠试验条 (PTS) 集成的便携式微流控平台,用于 COVID-19 的 POC 诊断。
4.1.4. 光学检测
光学器件已成为一种替代解决方案,并广泛用于LAMP产品的终点检测。光学传感器和仪器,如互补金属氧化物半导体(CMOS)、表面等离子体共振(SPR)和表面增强拉曼散射(SERS),已被用于监测LAMP扩增子。Chun等设计了一种利用CMOS传感器和白光LED灯对食源性病原体进行检测的方法,将反射式Janus粒子(RJP)和LAMP集成在一起,LOD为102鼠伤寒沙门氏菌的 CFU。将固定在RJP上的DNA探针注入LAMP产物中,导致LAMP产物和RJP之间形成杂交的夹层结构(图5)。在另一项研究中,使用SYTO-9将基于智能手机的图像处理方法应用于检测食源性病原体,该方法对单核细胞增生李斯特菌的LOD为6copies/μL。
表面等离子体共振是过去用于LAMP检测的一种光学方法。Nawattanapaiboon等报道了LAMP联合SPR成像检测临床样本中MRSA的应用。通过使用自组装单层表面 (SAM) 固定生物素化探针来制备生物功能化阵列,从而可以多重检测 MRSA 的femB 和 mecA 基因,并获得每微升样品 10 拷贝的 LOD。在另一项研究中,对F2和F1C互补的金纳米探针进行了修改,用于基于SPR的LAMP检测。该测定在 30 分钟内实现了 20 CFU/mL 的伤寒沙门氏菌检出限。
在过去的几年中,LAMP集成的表面增强拉曼散射(SERS)因其高灵敏度和重现性而在核酸扩增试验(NAAT)中广受欢迎。Draz和Lu报道了一种LAMP联合SERS测定法,用于快速、灵敏地检测肠道沙门氏菌(S. enterica),其中拉曼活性金纳米探针由修饰的AuNP和cy5/DNA探针组成,用于LAMP产物的SERS检测。该检测对肠炎沙门氏菌的检出限为 66 CFU/mL,灵敏度比传统 PCR 高 100 倍。此外,该检测表现出高特异性,因为沙门氏菌的检测是从受污染的牛奶样品中验证的。在另一项研究中,基于微滴的LAMP与SERS配对,以检测食物基质中的病原体。如图所示图5B、多功能AuNPs由以下组分组成:1-萘硫醇拉曼报告基因,以谷胱甘肽(GSH)为络合剂,以硫醇化聚乙二醇为稳定剂。由于谷胱甘肽和焦磷酸盐的羧酸基团络合,AuNPs聚集,然后用于检测靶标,从而提供了增强的SERS信号,从而以3.6×10CFU/mL的灵敏度检测出牛奶样品中的单核细胞增生李斯特菌。
图5
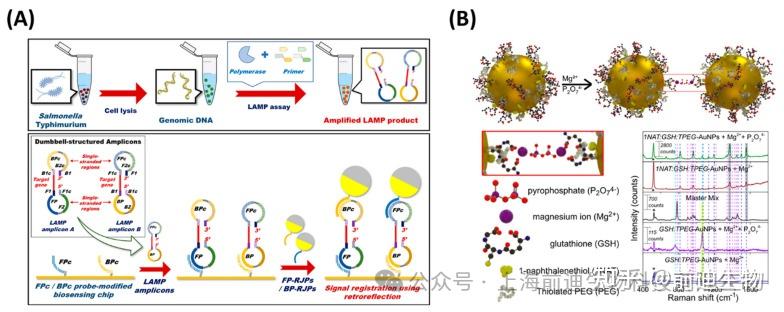
LAMP扩增子的光学检测方法。(A) 基于逆反射Janus粒子的生物传感器的示意图。(B) 使用 SERS 检测 LAMP 扩增的 DNA。经参考文献许可转载。
4.1.5. 扩散法
近年来,LAMP与扩散仪相结合,这是一种基于微观颗粒布朗运动简单原理的技术,是一种灵敏和快速检测传染性病原体的方法。根据斯托克斯-爱因斯坦方程,粒子扩散与样品粘度成反比。因此,通过分析一系列粒子图像来确定由于LAMP扩增产物的存在而导致的微观粘度变化。Clayton等报道了LAMP组合颗粒扩散计法检测血源性病原体,用CCD相机对200 nm荧光聚苯乙烯颗粒进行成像,并用互相关算法进行分析,以检测金黄色葡萄球菌(金黄色葡萄球菌)和肺炎克雷伯菌的扩增DNA。一年后,他们使用粒子扩散法在短短20分钟内成功在纯水样品中检测到单个细胞的霍乱弧菌。他们的检测结果显示灵敏度比金标准实时荧光定量 LAMP 高 10 倍。另一方面,Das等,开发了一种支持Janus颗粒的旋转扩散传感器,与LAMP配对,用于大肠杆菌(E. coli)gDNA。通过互相关算法分析来自 1 μm 大小的半荧光半金功能化 Janus 颗粒的 300 张闪烁信号图像,在短短 10 分钟内获得了 48.2 pg/μL 的大肠杆菌 gDNA,样品体积低至 2 μL。在后续文章中,作者报道了使用旋转扩散仪联合LAMP在10 min内检测到LOD为70 ag/μL的重组质粒中SARS-CoV-2 nsp-2 cDNA 。与金标准实时荧光定量PCR相比,它的灵敏度提高了10倍。在另一种策略中,开发了一种基于智能手机的 POC 设备,用于使用粒子扩散计检测 LAMP 扩增子的终点。该装置用于检测霍乱弧菌和恶性疟原虫,35 min内LOD为6个copies/反应(0.66 aM),45 min内血液样本的LOD为3个寄生虫/μL。该设备由一个带有显微镜、LED 灯和智能手机的 3D 打印平台组成,用于拍摄带有荧光珠的放大样品的视频。后来,Colbert等进一步修改了该装置,并报告了使用RT-LAMP检测SARS-CoV-2。便携式加热装置和用于执行RT-LAMP和样品分析的微流控芯片进一步集成到该设备中。该平台能够检测 30 copies/μL 的 SARS-CoV-2 提取的 RNA 和 35 × 104copies/mL稀释唾液中的病毒。LAMP扩增产物的各种终点检测方法的比较总结如
结如下表1.
表1:LAMP扩增子的终点检测方法比较。
| 技术 | 病原体 | 信号转导材料 | 读出方式 | 时间 | LOD的 | 参考 | | 色度 | SARS-冠状病毒-2 | SYBR Green I | 视觉 | 10 分钟 | 10−3份数/反应 | [59] | | SARS-冠状病毒-2 | 酚红 | 60 分 | 100 份/反应 | [53] | | 轮状病毒A | 中性红 | 30 分钟 | 1 × 103拷贝数/mL | [52] | | 六种细菌 | HNB公司 | 60 分 | 102–103CFU/毫升 | [48] | | 艾滋病毒、乙型肝炎病毒、丙型肝炎病毒 | 钙黄绿素 | 65 分 | 2 拷贝/μL | [47] | | 侧向流动 | 单核细胞增生李斯特菌 | 铁3O4NP的 | 视觉 | 60 分 | 10 CFU/毫升 | [87] | | 鼠伤寒沙门氏菌 | QB 标记的LFIAS | 60 分 | 103CFU/毫升 | [88] | | SARS-冠状病毒-2 | hCG探针 | 120 分 | 0.5 拷贝/μL | [92] | | 电化学 | 副溶血性弧菌 | 赫斯特-33258 | 差分脉冲伏安法 (DPV) | 45 分 | 每 25 克生海鲜 0.3 CFU | [76] | | 人瘤病毒 | 苯醌 (BQ) | 计时电流法 | 40 分 | 0.1纳克 | [79] | | B组链球菌 | 亚甲蓝 | 循环伏安法 (CV) | 45 分 | 0.23 fg/微升 | [77] | | SARS-冠状病毒-2 | 亚甲蓝 | 方波伏安法 (SWV) | 30 分钟 | ~2.5 × 10−6纳克/微升 | [81] | | 光学的 | 单核细胞增生李斯特菌 | SYTO-9型 | CMOS公司 | 60 分 | 6 拷贝/μL | [97] | | 伤寒沙门氏菌 | AuNPs (英语) | SPR系列 | 2小时 | 20 CFU/毫升 | [99] | | 耐甲氧西林金黄色葡萄球菌 | 生物素化-ssDNA探针 | SPR系列 | 60 分 | 10 拷贝/μL | [98] | | 肠链球菌 | AuNP-Cy5/DNA (英语) | SERS系列 | 40 分 | 66 CFU/毫升 | [100] | | 单核细胞增生李斯特菌 | 多功能AuNPs | SERS系列 | 60 分 | 3.6 × 102CFU/毫升 | [101] | | 扩散法 | 霍乱弧菌 | 400 nm 绿色荧光颗粒 | CMOS公司 | 35 分 | 6 个细胞/反应 | [106] | | SARS-冠状病毒-2 | 400 nm 绿色荧光颗粒 | CMOS公司 | 35 分 | 35 × 104病毒颗粒/mL | [108] | | 大肠杆菌 | 1 μm Janus 颗粒 | CCD封装 | 10 分钟 | 42.8 fg/微升 | [104] | | SARS-CoV-2-nsp2 (SARS-CoV-2-nsp2) cDNA | 1 μm Janus 颗粒 | CCD封装 | 10 分钟 | 70 ag/μL | [105] |
4.2. 实时检测
4.2.1. 电化学检测
LAMP产品的实时检测可提供定量结果,无需额外的样品制备步骤。这节省了时间,限制了由于交叉污染而导致的假阳性机会,并且还具有高精度的广泛样品分析的优势。因此,LAMP集成的实时检测方法可用于开发便携式小型化POC诊断工具。电化学检测方法已广泛应用于LAMP扩增子(表2).Martin等开发了一种基于LAMP的电化学读数装置,用于实时检测48个样品(图6),该器件由一个多路复用恒电位仪组成,可以同时测量四种不同氧化还原报告基因的方波伏安响应,即 [Os-(bpy)2dppz]2+、PhP、MB 和 Ru(NH3)63+。在短短 30 分钟内,黄杆菌柱的 LOD 低至 2 copies/反应。在另一项研究中,Gosselin等报道了一种丝网印刷的pH敏感聚苯胺(PAni)电极,该电极带有Ag/AgCl参比电极,用于实时检测苏云金芽孢杆菌的LAMP测定,每次反应的LOD为10copies DNA(图6B)。基于PAni的电极检测LAMP反应过程中由于聚合酶活性引起的溶液pH值的变化。使用便携式电子采集卡来获取电位读数,使其成为基于LAMP的检测方法的一种POC诊断。开发了另一种集成LAMP的便携式电化学设备,用于检测LOD为6.18 fg/μL的乙型肝炎病毒(HBV)DNA。液滴池由一个铂 (Pt) 工作电极组成,该电极连接到放置在水浴中的恒电位仪。亚甲蓝作为氧化还原指示剂,通过方波伏安法(SWV)测量实时电化学信号和MB与LAMP扩增子结合导致的电流降低。同样,Huang等建立了一种与LAMP相结合的完全集成的电化学装置,用于检测分别靶向vt和invA基因的大肠杆菌O157:H7和肠链球菌。该器件与金电极集成,氧化还原分子MB用于电化学信号生成。该检测方法对大肠杆菌 O157:H7 和肠链球菌的检出限分别为 10 copy/反应和1copy/反应。该研究小组后来开发了一种双插层氧化还原试剂,用于LAMP扩增子的实时电化学定性分析。氧化还原探针是使用两个萘醌-咪唑 (NQIM) 分子合成的,它们通过连接基团 (R) 共价键合。该系统仅用了10分钟就实现了单拷贝沙门氏菌DNA的LOD。
4.2.2. 基于智能手机的实时检测
它是实时监测LAMP扩增产物的替代方法。这可以通过分析放大过程中捕获的一系列图像的RGB值来实现。色值的变化是通过使用浊度、比色和荧光染料来确定的。例如,Priye等开发了一种配备智能手机的便携式LAMP设备,用于实时检测淋病奈瑟菌(N. gonorrhoeae)。该方法利用色度-亮度法测量扩增的LAMP产物的荧光强度,其检测灵敏度为3.5copies/10 μL样品。同样,Wang等开发了一种与LAMP集成的片上POC器件,用于使用基于智能手机的实时浊度方法检测活的鼠伤寒沙门氏菌。将沙门氏菌细胞与单叠氮化丙啶(PMA)和抗沙门氏菌捕获抗体包被的磁性纳米颗粒混合,用于死亡细菌DNA的预处理。该系统能够在 90 分钟内检测出鸡肉中 14 CFU/mL 的鼠伤寒沙门氏菌。开发了另一个基于智能手机的定量分子诊断平台,用于LAMP测定的实时比色缺陷 (图6),这种低成本的便携式设备成功地定量分析了唾液和阴道拭子中的HPV DNA以及血浆样本中的HIV RNA。在另一项研究中,Thio等开发了一种智能手机实验室(LOS)平台,该平台集成了等离子体增强光电润湿(OEW)设备,用于监测环境水样中的细菌污染。OEW 的集成可实现片上样品制备的无泵液滴操作。它利用智能手机摄像头作为光学检测器,通过使用图像处理应用程序进行红-绿-蓝 (RGB) 分析进行比色研究。这种先进的设备可在短短 30 分钟内实时检测大肠杆菌。在另一项研究中,Nguyen等开发了一种基于智能手机的3D打印便携式集成遗传单元(i-Gene),用于传染性病原体的POC诊断。LAMP放大在微流控芯片上进行,LAMP的加热器由智能手机供电(图6),智能手机由5.0 V移动电源供电。Eriochrome Black T(EBT)用于LAMP反应的比色检测。基因扩增后,智能手机摄像头的CMOS传感器实时显示样品的颜色变化,仅用60 min即可灵敏地检测大肠杆菌O157:H7,LOD为10copies/μL。同年,他们开发了一种用于LAMP比色检测的智能手机应用程序,并使用绘制的校准曲线测量了测试样品中的DNA拷贝数,以形成已知的模板浓度与阈值时间的关系(图6),这种完全集成的基于智能手机的设备是传染性病原体POC检测和早期疾病控制的终极解决方案,特别是在发展中国家和资源有限的情况下。两年后,该小组开发了一种基于物联网(IoT)的便携式轻量级(320g)小型化诊断设备,用于快速筛查COVID-19。这种全自动设备由便携式电池供电,并通过智能手机操作。利用集成微流控芯片对SARS-CoV-2的多个基因(N、E和As1e基因)进行病毒裂解、RNA提取和RT-LAMP反应。RT-LAMP通过CMOS传感器在488nm波长的LED光激发下测量荧光强度,从而实时监测RT-LAMP。记录的数据由安装在设备中的微处理器进行处理和分析,并以无线方式传输并显示在智能手机上。使用 SYBR 绿色染料的测定时间为 65 min,LOD 为 20 copies/μL。
表2
基于LAMP的实时检测方法。
| 技术 | 病原体 | 信号转导材料 | 检测方法 | 时间 | LOD的 | 参考 | | 电化学 | 沙门氏菌 | 双-NQIM-R(萘醌咪唑) | 差分脉冲伏安法 (DPV) | 10 分钟 | 1 份/反应 | [113] | | 黄杆菌柱 | [Os-(bpy)2德普兹]2+、PhP、MB和Ru(NH3)63+ | 方波伏安法 (SWV) | 30 分钟 | 2 份/反应 | [109] | | 大肠杆菌 O157:H7S. enterica | 亚甲蓝 | 差分脉冲伏安法 (DPV) | 30 分钟 | 10 份/份/份反应 1 份/份 | [112] | | 乙型肝炎病毒 | 亚甲蓝 | 方波伏安法 (SWV) | 60 分 | 6.18 fg/微升 | [111] | | 基于智能手机 | 大肠杆菌 O157:H7 | 铬黑 T (EBT) | 色度 | 60 分 | 10 拷贝/μL | [118] | | 淋病奈瑟菌 | 赛托 | 荧光 | 40 分 | 每 10 μL 3.5 个拷贝数 | [115] | | SARS-冠状病毒-2 | 西布尔 | 荧光 | 65 分 | 20 拷贝/μL | [120] |
图6
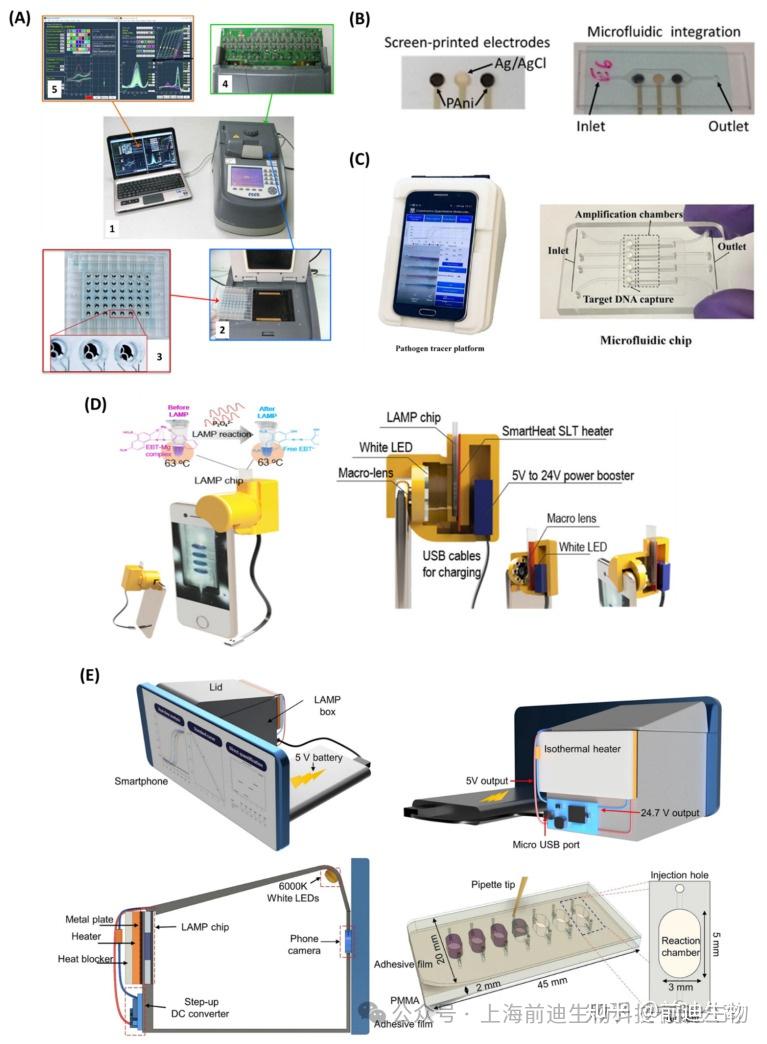
基于LAMP的实时检测模式。(A,A1)用于实时监测LAMP反应的电化学读出装置概述;(A2)PCR热循环仪连接一个扁平的帕尔贴加热块,带有两个72引脚连接器;(A3)由48孔组成的电化学微孔板;(A4)PCB接口承载多路复用恒电位仪的电子电路;(A5)专用软件,用于从每个微孔中提取电化学响应并引导PCB接口。(B) 丝网印刷pH敏感聚苯胺(PAni)基电极,用于实时检测LAMP。(C) 通过“智能连接病原体示踪剂”(SCPT)设备对HPV和HIV进行基于色调的检测。(D) 集成智能手机的i-Gene分析仪示意图及其内部视图。(E) i-Genbox实时检测传染性病原体的三维示意图。
5. 基于LAMP的床旁生物传感器
5.1. 微流控芯片
5.1.1. 经典微流控芯片
控制传染病的传播需要广泛的快速检测。这可能导致交叉污染和感染进一步传播的风险。此外,大量的样本需求使诊断过程变得昂贵,并限制了大规模测试。微流控装置的引入可以克服这一限制,并在受保护的环境中提供“样品进出”路线。LAMP与先进的微流控芯片的集成进一步增强了分析能力,并以非常高的灵敏度提供快速和高度特异性的检测。近年来,LAMP-on-a-chip已成为传染病POC诊断的先进解决方案。基于聚甲基丙烯酸甲酯(PMMA)和聚二甲基硅氧烷(PDMS)的经典微流控芯片是LAMP-on-a-chip模式的最常见示例。本文总结了LAMP集成微流控器件的最新进展。Trinh等开发了一种基于LAMP的可折叠微器件,用于检测多种食源性病原体。该装置由聚碳酸酯薄膜组成,具有两个不同的部分,用于 LAMP 反应和分析物检测 (图7),反应部分用含有LAMP试剂的2-羟乙基琼脂糖封闭,以便长期储存和维护。它可以成功地储存LAMP试剂长达45天。片上放大是通过使用基于石墨烯的加热器进行的。该检测的LOD为2.5×102 copies/反应,检测时间再30 分钟内。在另一项研究中,Fu等开发了一种LAMP测定法,使用最可能数(MNP)来定量PMMA芯片中的大肠杆菌和肠球菌属。该测定在 35 分钟内实现了 4 个copies/孔的 LOD。Sivakumar等开发了一种与金纳米颗粒偶联的LAMP集成POC微器件,用于检测屎肠球菌和SARS-CoV-2质粒。在LAMP产品存在下,氯化金在紫外光下还原为红色金纳米颗粒,在短短10分钟内为COVID-19质粒提供42 fg/μL的检测限。在另一项研究中,开发了一种完全集成的旋转阀辅助微流控装置,用于 DNA 提取、扩增和检测副溶血弧菌和加标虾,检测时间在80分钟内,LOD 为 3.1 × 101拷贝数每次反应, (图7采用CRISPR/Cas12a方法检测LAMP扩增产物。实时荧光定量PCR记录扩增产物的荧光信号。每次测试的检测成本不到 4 美元。后来,Tian等开发了一种经典的微流控装置,用于检测隐球菌性脑膜炎(CM)。五层微流控模块为等温扩增提供细胞裂解、DNA 提取和纯化。LAMP在由冻干试剂组成的便携式微珠中进行。该模块可用作 CM 中后期的辅助工具,并在 CM 诊断的早期阶段确认侧向层析测定 (LFA) 结果不明确的情况。
最近,微流控设备还与RT-LAMP集成,用于检测高传染性SARS-CoV-2病毒。例如,Mateos等设计了一种PMMA制造的集成微流控芯片,用于基于磁珠的RNA提取和针对SARS-CoV-2的ORF1a和N基因的RT-LAMP反应。该微芯片包含一个用于样品加载的大腔室,然后是七个洗涤室和一个检测室。使用更多的洗涤室可提供高纯度的 RNA 提取并消除残留污染。该装置的检测灵敏度为 470 copies/mL,周转时间为 60 min。这个简单易用的平台可快速准确地检测 SARS-CoV-2,并可用于在 POC 大规模筛查 COVID-19。同样,Jhou等设计了一种基于RT-LAMP的集成微流控平台(IMP),用于实时检测SARS-CoV-2病毒。该自动化平台由一个基于PDMS的微流控芯片(用于病毒裂解和RNA提取)和一个用于RT-LAMP的加热模块组成。液体样品通过微泵和阀门在芯片内部运输,通过产生表压差,由流体控制模块控制,还用作混合试剂的微混合器。基于钙黄绿素的荧光检测获得了5×103每次反应的LOD,检测时间在90 分钟内。
LAMP-on-a-chip系统还具有多路复用检测的优势,保持了LAMP的优点。例如,Liu等开发了一种全自动离心芯片,用于同时检测五种不同的细菌。自动化设计在短短 70 分钟内即可对样品进行细菌细胞裂解、DNA 纯化、LAMP 反应和终点比色检测,LOD 为 10 拷贝/μL。基于微珠打浆的机械裂解用于替代化学裂解。颜色传感器与白色LED灯一起用于片上LAMP读数。同时,Jin等研制了一种由PMMA制成的圆盘状双样品微流控芯片,用于10种水生细菌的多重检测。微流控盘配有离心模块,使试剂能够流过通道。实时荧光的LOD范围为7.92×10−3至 9.54 × 10−1pg,检测时间在 35 分钟内,表现出高特异性和重现性。在另一项研究中,开发了一种基于离心芯片的全集成便携式基因分析仪,用于多重RT-LAMP。离心芯片允许在一次运行中检测 10 个样品。该芯片由 10 个分装室组成,这些分装室与锯齿形等分试样通道相连,以及一个用于 RNA 提取的玻璃滤柱。圆盘的结构如图所示图7C,在等分室和玻璃过滤柱之间使用被动阀来操纵流体流动。毛细管压力使样品能够在等分室中自动分配,随后通过离心方案实现样品的洗涤和洗脱。每个样品在芯片上都有三个反应室,预装了冷冻干燥的LAMP引物,用于同时扩增ORF1ab、N和S基因。为了防止样品蒸发,反应室被蜡堵塞。记录扩增产物的荧光信号,检测10份样品中SARS-CoV-2的3个靶基因,LOD为20copies/μL,检测时间为90 min。
5.1.2. 纸基芯片
传统的微流控装置通常需要额外的泵送和微阀来进行流体运动。这增加了他们的运营复杂性、原材料的使用和总体成本。然而,纸基和纸聚合物混合微流控装置因其与核酸和蛋白质的高生物相容性、易于制造和低生产成本而成为一种替代解决方案。此外,毛细管力可以消除使用微型泵和其他笨重设备。Rodriguez等人开发了一种低成本的、从样本到答案的基于纸质的分子诊断测定方法,该测定方法与RT-LAMP集成,用于从人鼻咽拭子中检测H1N1,灵敏度高。从临床样品中提取RNA并纯化,然后在纸质设备中进行RT-LAMP反应。侧向层析试纸的肉眼检测可提供 106copies/mL 的 LOD,在45 min内即可达到,比目前的免疫测定技术灵敏度高10倍。在另一份文献中。Roy等开发了一种基于纤维素的纸微芯片,用于检测猪肉中的微生物(图7D)。使用结晶紫染料在蜡印纤维素纸基微芯片中检测到扩增的LAMP产物。这种低成本比色法检测可快速、高灵敏度地检测枯草芽孢杆菌和 Sus scrofa,LOD 为 10 pg/μL(2.2 × 103拷贝数/μL) 和 1 pg/μL (3.43 × 10−1拷贝数/μL)。同样,Kaarj等设计了一种蜡印G4纤维素纸片,结合RT-LAMP用于从水、尿液和稀释血浆中对寨卡病毒进行POC诊断。纸芯片分为两部分:样品加载区和检测/放大区。将含有加标病毒颗粒的样品转移到加载区域,样品通过毛细管作用通过通道。将检测区域置于热板上,并加入RT-LAMP试剂。通过基于智能手机的比色检测,在15 min内从生物样品中实现低至1拷贝/μL的LOD。在另一项研究中,Batule等展示了一种两步法,用于病毒RNA提取,然后在纸底物中进行等温扩增和检测。在第一步中,使用硝酸纤维素基纸条在5分钟内从血清中提取病毒RNA。在下一步中,RT-LAMP在纸芯片中进行,该纸芯片由四个反应室组成,这些反应室通过流体通道连接并预装有反应垫。将RT-LAMP试剂(包括逆转录酶、引物、Bst聚合酶和用于视觉检测的染料)干燥储存在反应垫中。该检测在磷酸盐缓冲溶液 (PBS) 和血清中分别实现了 1 拷贝和 10 拷贝三种不同 RNA 颗粒(例如寨卡病毒、基孔肯雅热和登革热)的检测限。RNA提取检测全过程在1 h内完成。
基于纸聚合物的混合微流控装置也受到高度关注,并被应用于微生物感染的检测。Pang等报道了一种基于PDMS/纸质的混合微流控平台,用于检测食源性病原体。该微装置包含三个通过微通道连接的LAMP反应室,其中一个用于阴性对照。纸盘预装LAMP试剂并置于反应室中。PDMS的高气体溶解度使样品能够自吸。使用混合染料对最终产品进行视觉检测,LOD为103CFU/mL 用于金黄色葡萄球菌和副溶血性弧菌。同样,Trinh等开发了一种用于肉眼检测沙门氏菌属的纸埋可折叠微器件,LOD为102 CFU/mL,从牛奶样品中检出,时间在65 分钟内。该微器件由三个部分组成,并附有密封膜,能够进行核酸提取、LAMP反应和比色检测。样品室和反应室由聚碳酸酯组成,由九个室组成,预装了LAMP试剂纤维素纸。在检测层中使用了紫红色涂层的纸条,在阳性LAMP的情况下,纸条的颜色变为紫色。报道了另一种集成LAMP的纸基微器件,该微器件具有旋转机制,用于检测耐万古霉素肠球菌(VRE)。固定部分由用于LAMP放大的PDMS芯片组成。纺丝部分安装了一根用氢氧化钠处理的三玻璃超细纤维用于提取 DNA,另一根用酚酞处理过的三玻璃超细纤维用于 LAMP 扩增子的比色检测 (图7)该设备能够检测 102CFU/mL 的 VRE 在自来水中 45 min。在另一种策略中,Dinh等开发了一种可折叠的纸微器件,用于进行片上LAMP放大。聚合的番红O与LAMP扩增产物相互作用,产生深红色溶液。检测限为 10−4ng/μL 和 102 CFU/mLSARS-CoV-2 质粒和屎肠杆菌,反应过程仅需 60 分钟即可实现。Zhang等开发了一种基于纸的微流控芯片,用于食源性细菌大肠杆菌O157:H7的比色检测。该微芯片进一步用于从牛奶样品中检测沙门氏菌属。通过在90°C下热休克5分钟进行细菌细胞裂解。通过嵌入反应室中的钙黄绿素染料进行检测,对大肠杆菌 O157:H7 和沙门氏菌属的 LOD 分别为 13.4 pg/μL 和 12 CFU/mL。总而言之,纸质测试符合POC诊断工具的标准,并有可能用于传染病的早期和现场诊断。
5.1.3. 完全集成的芯片
集成了核酸提取、纯化和LAMP扩增的微流控芯片是现场检测的合适人选,特别是在资源有限的地区。在过去的几年里,研究人员试图开发与样品预处理功能集成的微器件,包括单个微流体装置中的等温扩增。采用磁珠、硅胶珠、玻璃滤膜、FTA卡等材料进行核酸提取纯化。Guo等设计了一种微流控芯片,集成了基于二氧化硅的细菌基因组DNA固相提取(SPE)和LAMP扩增,用于检测三种不同的细菌,包括大肠杆菌O157:H7、MRSA和甲氧西林敏感金黄色葡萄球菌(MSSA)。微芯片由两个通道组成:一个用于样品加载,另一个用于执行洗涤步骤。两个通道都装有一个微阀来控制流体流动。提取的基因组DNA只允许通过SPE室,并且硅胶珠被阻塞在微柱中。检测限为 102CFU/100 μL 对 rfbE、spa 和 mecA 三个特定基因均有效,检测时间为 2 h。Loo等开发了另一种基于LAMP的核酸提取集成实验室平台,以提供从样品到结果的解决方案。硅胶膜用于芯片上固相提取和细菌DNA的纯化。微流控盘中的流体流动由离心力控制。SYTO-9荧光染料采用实时荧光检测痰中结核分枝杆菌达到了103CFU/mL的检出限,用于血液中鲍曼不动杆菌 (Ab)的检测限为102的 CFU/mL。该微流控平台可在不到120分钟的时间内完成整个过程,并且可以同时分析多个样品。同样,Park等设计了一种紧凑的圆盘旋转微流控装置,该装置集成了基于玻璃微珠的核酸提取、LAMP反应室和三个独立的侧向流动条,用于同时检测受污染的牛奶或水样中的多种食源性病原体。玻璃微珠被加载到微通道中,在离液盐存在下,基因组DNA通过氢键吸附在二氧化硅上。通过使用FAM标记的人工DNA探针确认微流控盘中的DNA提取。缓冲液输送是通过离心速度实现的,样品流量在多个虹吸管和圆形毛细管阀的帮助下控制。同时检测鼠伤寒沙门氏菌和副溶血性弧菌的靶基因,LOD为50 CFU,检测时间为80 min。尽管这些集成的微流控盘能够以多重方式对病原体进行全自动、快速和灵敏的检测,但处理大量样品仍然是一个主要缺点。为了解决这个问题,设计了一种集成的离心微流控芯片,基于LAMP的食源性细菌多重检测,样品体积高达1 mL。该微器件由两个主要部分组成:一个用于存储LAMP试剂的3D打印盒和一个离心盘,用于将溶液释放到微器件中,微器件由圆盘旋转控制。为了吸收洗涤液和额外的样品,在洗涤室中安装了高吸水性聚合物 (SAP),最终允许使用高达 1 mL 的样品。芯片的每个部分都使用了 20 个反应室,可以在一次运行中同时检测多个样品。基于微珠的 DNA 提取使该过程完全自动化,并且在 1 小时内对三种细菌(大肠杆菌 O157:H7、鼠伤寒沙门氏菌和副溶血弧菌)进行比色检测,LOD 为 102细胞/mL。Flinders Technology Associates(FTA)开发了卡嵌入式滑动混合微流控装置,该装置由三层组成,可同时进行DNA提取、LAMP反应和细菌检测(图7F).使用FTA卡进行细菌DNA提取和纯化。使用基于品红的方法进行比色分析,最终检测出沙门氏菌属和大肠杆菌O157:H7,LOD为30 CFU/样品,金黄色葡萄球菌,LOD为3×102CFU/样品,检测时间在75分钟内。同样,开发了一种基于3D纸的微流控装置,其灵感来自弹出式贺卡,用于检测VRE。FTA卡安装在顶部用于DNA提取,PDMS芯片用作LAMP反应室(图7G).在纸上涂上浓缩的指甲油,通过改变多孔结构来防止样品流过整个纸。pH敏感化学传感器可检测出LOD为102的VRE检测结果45 分钟内从原料奶样品中提取 CFU/mL。Tsai等设计了另一个微流控平台,并与电磁铁集成,用于病毒裂解、RNA提取和RT-LAMP实时检测SARS-CoV-2。电磁铁能够实现基于微珠的RNA提取和试剂的混合。该检测在 82 分钟内实现了每次反应 5000 个病毒拷贝的检测限。表3列出了最近开发的LAMP-on-a-chip模式,并提供了它们之间的比较。
图7
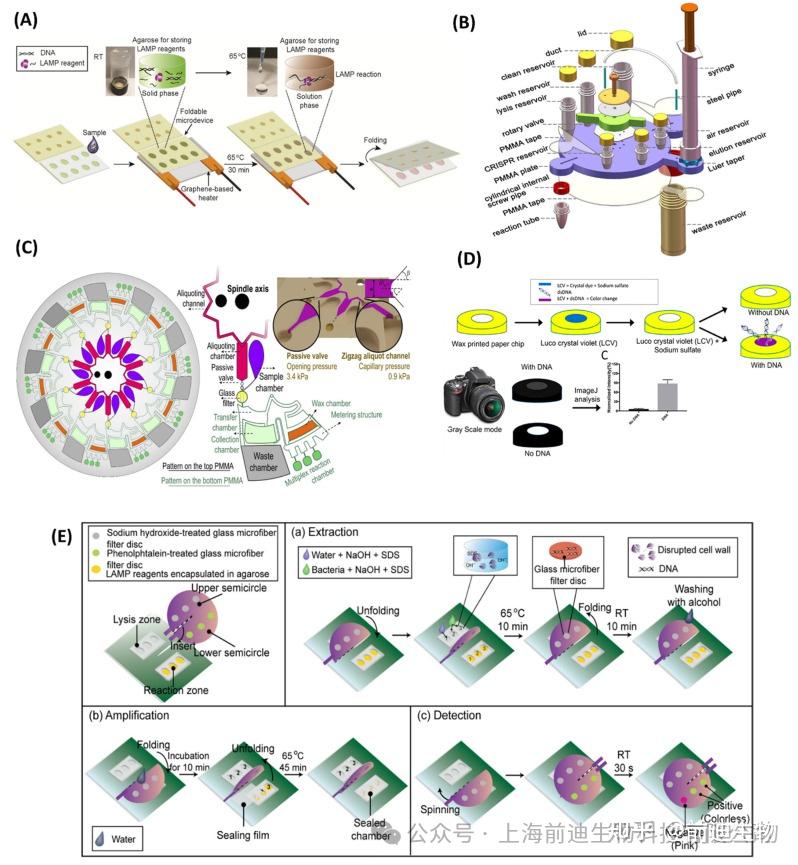
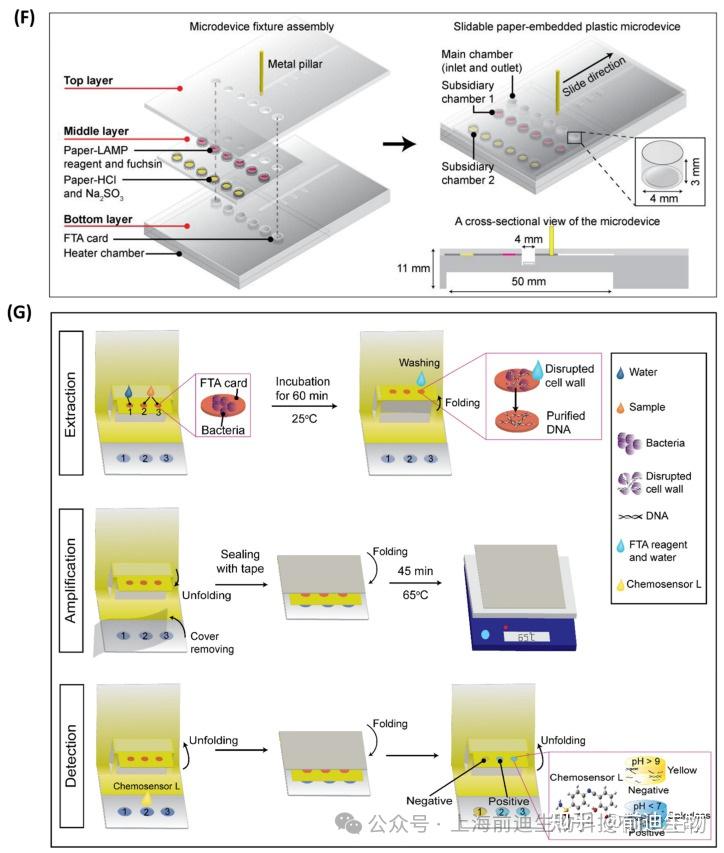
LAMP-on-a-chip 生物传感器。(A) 石墨烯加热器集成聚碳酸酯可折叠微器件的工作流程示意图。(B)旋转阀辅助流体芯片的结构概述。(C) 用于多路RT-LAMP的离心微流控盘。(D) 蜡印纸微器件上LAMP扩增子比色检测的工作流程示意图。(E)一种带纺丝机构的纸基微器件的工作原理。(F) 基于FTA卡的全集成可滑动纸微器件的结构概述。(G) 弹出式、基于纸张的、完全集成的微流体平台的图示。表3
基于LAMP的微流控平台摘要。
| 技术 | 目标 | 病原体 | 材料 | 读数 | 时间 | LOD的 | 参考 | | 古典 | 脱氧核糖核酸 | 沙门氏菌属大肠杆菌 O157:H7 | 聚碳酸酯 | 色度 | 30 分钟 | 2.5 × 102拷贝数/mL | [121] | | 脱氧核糖核酸 | 大肠杆菌和肠球菌属 | 聚甲基丙烯酸聚甲酯 | 色度 | 35 分 | 4份/孔 | [122] | | 脱氧核糖核酸 | 副溶血性弧菌 | 聚甲基丙烯酸聚甲酯 | 荧光 | 80 分 | 3.1 × 101份数/反应 | [124] | | 核糖核酸 | SARS-冠状病毒-2 | 聚甲基丙烯酸聚甲酯 | 荧光 | 90 分 | 20 拷贝/μL | [130] | | 纸质 | 脱氧核糖核酸 | Sus scrofa(猪)枯草芽孢杆菌 | 纤维素纸 | 色度 | 10 分钟18 分钟 | 3.43 × 10−1拷贝数/μL2.2 × 103拷贝数/μL | [133] | | 脱氧核糖核酸 | 沙门氏菌属 | 聚多巴胺涂布纸-聚碳酸酯 | 色度 | 65 分 | 1 × 102CFU/毫升 | [137] | | 脱氧核糖核酸 | VRE系列 | 纸质-PDMS | 色度 | 45 分 | 102CFU/毫升 | [138] | | 核糖核酸 | 寨卡病毒 | G4-纤维素纸 | 色度 | 15 分钟 | 1 拷贝/μL | [134] | | 集成芯片 | 脱氧核糖核酸 | 大肠杆菌O157:H7、耐甲氧西林金黄色葡萄球菌、MSSA | 硅胶珠-PMMA | 荧光 | 2小时 | 102CFU/100 微升 | [141] | | 脱氧核糖核酸 | 鼠伤寒沙门氏菌和副溶血性弧菌 | 玻璃微珠-PPMA | 色度 | 80 分 | 50 CFU | [143] | | 脱氧核糖核酸 | VRE系列 | FTA卡-PDMS | 色度 | 45 分 | 102CFU/毫升 | [146] | | 核糖核酸 | SARS-冠状病毒-2 | 磁珠 | 荧光 | 82 分 | 5000 份/反应 | [147] |
4.2. 数字LAMP
近年来,数字LAMP(dLAMP)在准确测量样品中的核酸方面越来越受欢迎。根据样品分离,数字LAMP可分为两类:基于液滴的数字LAMP(ddLAMP)和基于孔板的数字LAMP。这两种方法都依赖于将样品分离成数千个纳升大小的液滴,每个液滴含有一个靶分子。可以通过将样品液滴悬浮在油中或将样品加载到微孔中并用油或盖子密封来产生样品液滴。目标分子的数量可以通过分析显示阳性信号的液滴数量来量化。通过数字图像处理或流式细胞术分析扩增结果。Gansen等报道了第一个基于样品自数字化(SD)芯片的数字LAMP(dLAMP),用于扩增和检测固定液滴中的单个DNA/RNA分子。该芯片在包含 5000 个微孔的 PDMS 中复制。通过气压将油和样品混合产生液滴,并在65°C下进行LAMP。 该装置显示出足够的尺寸均匀性和低样品消耗。Wang等利用这一概念报道了在临床样本中检测到14种高危HVP,具有非常高的特异性和准确性(图8),另外,Zhu等开发了一种自吸区隔(SPC)芯片来进行数字LAMP分析。通过对空气溶解的PDMS芯片进行脱气产生的真空为样品和芯片中的油流提供了泵动力。这允许在不使用微阀和其他控制系统的情况下产生液滴和样品的自区隔。该装置可检测受污染食品样品中副溶血性弧菌,其LOD 为 1 × 103CFU/mL(图8)但是,可能无法长期保存真空,这将阻碍自吸。为了克服这个问题,马等提出了一种亲水性薄膜包覆的自驱动PDMS芯片来传导数字LAMP。亲水膜可通过毛细管力在芯片中自动操作样品。在这种条件下,该测定在LAMP反应后30 min内实现了每30 μL样品11拷贝的VRE的LOD。同时,Rane等开发了一种基于液滴的dLAMP微流控装置,用于检测淋病奈瑟菌。油和样品通过交叉微通道的连续流动每 110 分钟产生 100,000 个液滴,大小为 10 皮升,含有单核酸和 LAMP 试剂 (表4).这些液滴被移向加热区域进行LAMP放大。使用共聚焦荧光光谱法进行基于钙黄绿素染料的荧光检测,LOD为600copies/μL。
表4
各种数字LAMP模式的比较。
| 目标 | 病原体 | 反应室类型 | 不。《钱伯斯》 | 样品体积 | LOD的 | 引用 | | 脱氧核糖核酸 | 肺炎链球菌 | 小滴 | 6500 | ~2.3 毫升 | 10 拷贝/μL | [154] | | λ脱氧核糖核酸 | EGFRL858R突变 | 小滴 | 10,000 | ~1 毫升 | 1 拷贝/μL | [155] | | 脱氧核糖核酸 | 淋病奈瑟菌 | 小滴 | 100,000 | ~10 毫升 | 600 拷贝/μL | [153] | | 质粒 | 人瘤病毒 | 微孔 | 4480 | ~4.5 毫升 | 1 fg/μL | [159] | | 脱氧核糖核酸 | VRE系列 | 微孔 | 736 | ~22.6 毫升 | 11 拷贝/30 μL | [152] | | 脱氧核糖核酸 | β-乳蛋白 | 微孔 | 384 | ~6 毫升 | -- | [150] |
基于液滴的数字LAMP应用需要,需要经过培训的员工,他们在微流体和精密仪器方面具有丰富的经验。因此,为了使ddLAMP更加方便,Yuan等设计了一种集LAMP混合物乳化、孵育区和扩增产物荧光检测于一体的“Handifluidics”装置(图8C)。使用手动操作的注射器在PDMS芯片中产生单分散液滴。将乳化的LAMP液滴收集在液滴容器中,并在63°C的水浴中加热以进行LAMP。荧光显微镜用于定量靶标,LOD为10个DNA copies/μL。在另一项研究中,Cao等开发了一种微尺度、水凝胶芯片集成的小型化dLAMP装置,用于检测LOD为1copy/μL的λDNA模板。该芯片包含超过 10,000 个微凝胶,能够对 DNA 分子进行自我分配 (图8D)。该平台集成了用于LAMP反应的加热器,并使用基于智能手机的数字读数进行图像分析。类似地,胡等创建了一个便携式的样本到结果的数字LAMP平台,该平台结合了核酸提取和基于智能手机成像的荧光检测(图8),采用表面张力辅助不混相过滤(IFAST)提取核酸。采用螺旋混合通道和流动聚焦液滴生产机构实现负压混合和样品分配。该装置能够检测低丰度cfDNA和EGFR L858R突变。该装置可以为资源有限情况下的核酸POC检测提供低成本、生产简单且用户友好的解决方案。
“SlipChip”是另一个连接两块板的微流控平台。底层包含一系列微室和管道。顶层由井组成,并充当覆盖物。样品通过微通道加载到顶层孔中,并通过滑动顶板与底室中的预加载试剂混合。该平台无需使用泵和阀门,还可实现多重检测,样品体积为皮克/纳升。Sun等通过类似的方法报道了一种SlipChip设备,用于通过执行数字两步RT-LAMP来检测HIV RNA。首先,使用泊松分布对单个RNA分子进行区室化,并合成相应的cDNA。之后,这些cDNA被进行LAMP扩增。与单步 RT-LAMP 相比,这种两步 dRT-LAMP 的效率提高了 10 倍。同样,开发了一种自分区 SlipChip (sp-SlipChip) 平台,用于定量临床样本中的 HPV。该芯片利用毛细管压力进行自我分配,以独立产生液滴。将试剂加载到底板中的“珍珠链”形通道中。包含膨胀通道的盐化疏水顶板通过手动滑动移动并与底部通道对齐。毛细管压力的差会分解流体并将其自行分配成单个液滴。因此,可以消除微通道的精确对齐,使该设备成为传染性病原体的有前途的即时诊断工具。总之,在从样品到答案的微流控装置中加入dLAMP对于实现快速和灵敏的检测有很大的希望。
图8
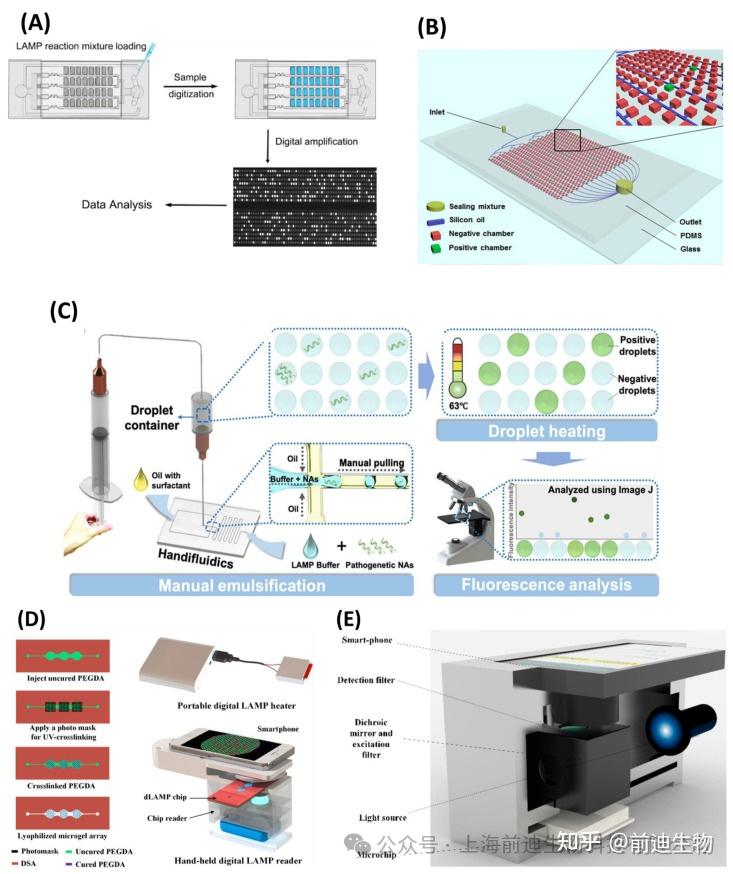
用于检测LAMP扩增子的数字LAMP方法示意图。(A)自数字化dLAMP芯片。(B)用于VP数字检测的自区隔微流控芯片。(C)与LAMP混合乳化集成的Handifluidics ddLAMP装置。(D)微尺度水凝胶芯片集成dLAMP装置。(E) 基于智能手机成像的dLAMP设备。
六. LAMP在临床诊断中的应用
在资源有限的地方,特别是在低收入和中等收入国家,获得高质量的医疗服务和技术仍然是一个主要问题。因此,开发能够在实验室环境之外提供负担得起、值得信赖和快速筛查医学疾病的 POC 设备至关重要。世界卫生组织 (WHO) 制定了评估 POC 诊断平台的标准,首字母缩略词为“ASSURED”,这意味着它们应具有以下品质:低成本/负担得起、高度敏感和特异性(极低的误报)、用户友好(任何人都可以使用)、快速/强大、无高科技设备和可交付(便携式)。由于其操作简单性,LAMP是满足这些标准的最佳候选者之一。因此,LAMP已被大量用于各种传染病的分子诊断,特别是在COVID-19期间。例如,Song等开发了一种名为Penn-RAMP的无仪器两阶段等温扩增方法,将逆转录重组酶聚合酶扩增(RT-RPA)和LAMP相结合,用于检测SARS-CoV-2,靶向ORF1ab基因,效率更高。在这种方法中,RT-RPA首先在反应管的盖子中进行。反应在38°C下用鼻咽拭子和唾液样品进行。使用F3和B3 LAMP引物以及重组酶进行RPA反应。15-20 分钟后,将 RPA 反应混合物转移到同一反应管中的预装 LAMP 混合物中。在第二阶段,在63°C下进行LAMP反应40分钟,RPA和LAMP混合物保持1:9的比例,以防止由于RPA含量而抑制LAMP。该测定的LOD为5拷贝/反应,灵敏度比RT-LAMP高10倍。因此,Penn-RAMP 克服了 RPA 和 LAMP 的单独限制,并提供了更高的灵敏度。此外,CRISPR/Cas诊断方法与LAMP的集成提供了高灵敏度和特异性的致病核酸检测。例如,Joung等开发了STOPCovid(COVID-19的一锅SHERLOCK检测),这是一种基于CRISPR/Cas的SARS-CoV-2结合RT-LAMP的一锅检测方法。在这种方法中,首先,病毒RNA被等温扩增;然后扩增子被CRISPR介导的报告基因切割并依次检测。通过在60°C下在商业裂解缓冲液中热裂解10分钟提取病毒RNA。因此,该方法省去了额外的病毒RNA提取步骤。反应60分钟后,通过侧向流动试纸或荧光报告器鉴定最终产物。该检测仅用了 70 分钟就实现了 100 拷贝/反应的 LOD。它还为临床样本提供了非常高的准确度 (11/12)。同样,Broughton等报道了一种基于RT-LAMP的快速SARS-CoV-2检测平台,名为DETECTR(SARS-CoV-2 DNA Endonuclease-Targeted CRISPR Trans Reporter),该平台集成了CRISPR/Cas12检测功能。该测定对 SARS-CoV-2 的 N(核蛋白)和 E(包膜)基因进行 RT-LAMP 靶向,然后在报告分子切割后对预定的病毒 RNA 序列进行 Cas12 识别和病毒检测。仅需 40 min,LOD 达到 10 拷贝/μL。通过从 COVID-19 患者的口咽/鼻咽拭子中提取 RNA 来测试临床样本。DETECTR检测显示,相对于金标准RT-PCR的准确率为95%。
七、FDA 批准的基于 LAMP 的设备
开发了各种基于 LAMP 的 SARS-CoV-2 商业 POC 检测试剂盒,并获得了美国食品和药物管理局 (FDA) 的紧急使用授权 (EUA)。Lucira COVID-19多合一检测试剂盒由Lucira Health Inc开发,并于2020年11月17日获得EUA,用于处方国内COVID-19检测,2021年4月9日,Lucira Check-it COVID-19检测获得FDA授权,用于非处方家庭使用。它通过靶向 SARS-CoV-2 RNA 的 N 基因来利用 RT-LAMP。基于LAMP引起的样品pH值变化的比色检测可在30分钟内完成检测。将鼻拭子溶解在洗脱缓冲液中,洗脱缓冲液在室温下提供病毒裂解。缓冲溶液溶解预加载的冻干试剂,比色读数由检测试剂盒中的电子和光学元件提供。不需要泵,因为该设备使用毛细管流动和重力,并且只有一个用户激活的阀门。加热器和光学元件位于单个 PCB 上。Lucira Check-It 的 LOD 为 2700 拷贝/拭子,检测准确率为 98%。同样,Detect Inc.将RT-LAMP与侧向层析技术相结合,开发了Detect COVID-19检测试剂盒。该检测试剂盒靶向 SARS-CoV-2 病毒基因组的 ORF1ab 基因。检测中心与一次性试管和收集缓冲液结合使用。连接后,检测中心必须放在一边 65 分钟才能进行测试,这可能会稳定系统。当试管插入检测中心时,RT-LAMP反应将自动开始。扩增大约需要 55 分钟,然后进行侧向层析测定 10 分钟,并使用智能手机上的 Detect 应用程序读取结果。该试剂盒提供人类阳性对照,以确认适当的样本采集和病毒 RNA 提取。尽管 Detect COVID-19 测试旨在在家中使用,但只有医疗保健专业人员才能购买 IFU。2022年4月11日,FDA向Detect Inc.发出了授权书。该测试可以在家中使用,无需处方。表5列出了最近开发的基于LAMP的SARS-CoV-2检测分子诊断方法,并提供了它们之间的比较。
表5
基于RT-LAMP的COVID-19诊断方法。
| 方法 | 靶基因 | 时间 | 敏感性 | 标本(拭子型) | LOD的 | FDA的EUA | 单价 | | 停止 Covid [1 | N基因 | 70 分 | 91.6% | 鼻咽和口咽拭子 | 100 份/反应 | 不 | 40 美元 | | Penn-RAMP | ORF1ab 和 N 基因 | 60 分 | 84% | 鼻咽拭子和唾液 | 5 份/反应 | 不 | 那 | | 检测器 | N 和 E 基因 | 40 分 | 95% | 鼻咽和口咽拭子 | 10 拷贝/μL | 不 | 那 | | iSCAN | N 和 E 基因 | 60 分 | 86% | 鼻咽拭子 | 10份/份 | 不 | 2–5 美元 | | iLACO | ORF1ab 基因 | 40 分 | 89.9% | -- | 10 拷贝/μL | 不 | 那 | | Lucira Check-it | N基因 | 30 分钟 | 98% | 鼻拭子 | 2700 份/拭子 | 是的 | 68 美元 | | 检测 COVID-19 检测 | ORF1ab 基因 | 65 分 | 95% | 鼻拭子 | 800 拷贝/毫升 | 是的 | 55 美元 | | Metrix COVID-19 测试 | ORF1ab 和 N 基因 | 30 分钟 | 95% | 鼻拭子和唾液 | 667 拷贝/毫升 | 是的 | 那 | | DxLab COVID-19 检测 | M基因 | 25 分 | 95% | 鼻拭子 | 3000 份/拭子 | 是的 | 那 |
八. LAMP的局限性
尽管具有许多优点,但LAMP仍存在一些需要修复的缺陷。与传统PCR相比,LAMP在分子生物学应用中的多功能性较低。例如,LAMP产生大尺寸的DNA链,这阻碍了其在克隆和其他生物学应用中的实用性。此外,LAMP的最终产物是不同大小的花椰菜样DNA,导致凝胶上形成涂片或多条带。然而,在PCR中,最终产物似乎是单个条带。因此,在LAMP中无法对凝胶进行特异性产物鉴定。本节将讨论 LAMP 的其他限制。
8.1. 多路复用检测中的交叉干扰
由于LAMP的操作设计复杂,每个特定靶序列的特定引物要求以及具有多种尺寸的扩增子的形成,LAMP中的多重检测仍然具有挑战性。启用多重 LAMP (mLAMP) 的常规方法涉及在 LAMP 引物中添加核酸内切酶识别位点,然后根据其大小鉴定消化的扩增产物。然而,扩增产物的酶切不足导致每个靶标在凝胶电泳中产生多个条带,使得多重LAMP检测具有挑战性。其他用于mLAMP检测的方法使用分子条形码和适配体修饰的金纳米颗粒。然而,产后检测过程非常耗时,而且测序工具和试剂的昂贵使用增加了整体运营成本,并阻碍了它们在广泛应用中的使用。此外,扩增后处理存在高残留污染风险。
在实时荧光定量PCR中,DNA插层染料(如SYBR Green)用于多重检测特定靶基因序列,并通过熔解曲线分析区分扩增产物。然而,由于形成具有多种结构的产物,熔化曲线分析不能与LAMP一起使用。此外,DNA合成的链置换原理禁止使用基于探针的检测。此外,LAMP对每个靶标使用三个引物对,导致Bst聚合酶和其他底物(包括dNTP、MgSO)的引物之间竞争等。因此,优化mLAMP中的反应条件具有挑战性。然而,设计具有多个反应室的微流控芯片应该能够克服上述局限性,并通过将引物放入不同靶标的不同反应孔中,以多重方式提供LAMP检测。微流控圆盘和纸片是mLAMP的完美候选者。
8.2. 引物设计的不确定性
LAMP使用4-6个引物,靶向小靶标段中的6-8个不同区域,F2和B2之间的距离为120-160个碱基,F1和F2的5'末端之间的距离为40-60个碱基。因此,针对具有短序列和大量突变的特定靶标(尤其是在RNA病毒的情况下)进行引物设计仍然具有挑战性。Primer Explorer V5 是 LAMP 引物设计最常用的在线软件。然而,在某些情况下,在线引物设计软件会受到各种限制,无法选择所需的目标位点,使得引物设计变得复杂。因此,引物设计必须手动进行。环引物的位置在引物设计中也至关重要。环引物必须精确地放置在B2-B1c和F2-F1c位点之间,并应朝特定方向定向。这些对其排列的实质性限制在某些情况下会禁用环引物的生成。因此,必须选择不同的引物组来生成环引物。此外,为了找出特定序列的最佳性能引物,必须选择多种设计,并且需要通过反复试验来检查引物的效率。此外,使用大尺寸(FIP 和 BIP 为 30-40 个碱基)和多个引物提高了引物自杂交的机会。这导致形成没有任何模板的自扩增产物,提供假阳性结果。在这种情况下,建议重新设计底漆。
8.3. 残留污染
由于高挥发性和产品稳定性,残留污染是LAMP的一个主要缺点。因此,在非模板对照中会获得意外的假阳性结果。由于其高灵敏度,LAMP反应可能会产生假阳性结果,即使仅存在扩增产物中的少量DNA。为防止此类交叉污染,强烈建议使用层流气流进行LAMP样品制备,并使用单独的移液器和过滤吸头。此外,含有LAMP产物的反应管的打开和后扩增过程应在与试剂制备地点隔离的区域进行。LAMP检测后应立即关闭反应管,并置于密封的双层塑料袋中处理。应避免高压灭菌反应管,以防止扩增产物分散。
九、 结论与展望
LAMP是一种强大且独特的核酸扩增技术,它利用等温环境中的链置换活性,从而通过消除复杂的热循环过程来改善PCR的局限性。因此,与PCR相比,LAMP是理想的小型化。LAMP具有出色的灵敏度(比传统PCR高10-100倍,比快速抗原和抗体检测高500-1000倍)、快速、弹性和特异性,可以被认为是下一代POC设备的一种有前途的技术;及其在实际应用中的易用性。本文通过适当的实例详细阐述了基于LAMP的POC平台与微流控装置相结合的传染病快速检测及其检测机制的最新进展。在众多的检测方法中,比色法和电化学法广泛用于LAMP扩增产物检测。基于LAMP的侧流免疫测定检测试剂盒也已成为各种传染性病原体(包括COVID-19)的快速POC检测。此外,还开发了许多基于智能手机的全自动设备,用于从样本到答案的解决方案。PDMS/PMMA、纸基和混合微流控芯片被证明是在POC上开发低成本、快速的基于LAMP的测试的有吸引力的工具。此外,数字LAMP可准确定量样品中的核酸,并消除样品之间的交叉污染。此外,还开发了新的检测方法,如生物发光和巨磁阻(GMR),用于检测LAMP反应。
9.1. 替代方法
无酶等温扩增方法,例如基于杂交链反应(HCR)的POC传感器,可能是一种替代技术。HCR在室温下工作;因此,省去了加热装置的使用,使整个操作过程简单。扩增产物可以通过比色法、荧光法或电化学法检测。近年来,HCR方法已成为一种敏感的传染病诊断工具。除此之外,其他等温扩增方法(包括RCA和RPA)也被用于多重检测,具有很高的灵敏度和多功能的检测设计。RPA在32–42°C的温度范围内进行,快速反应时间为20 min。RPA还与LAMP相结合,在微流控装置中开发了一种混合检测方法,可同时检测16种传染性病原体核酸,包括寨卡病毒、HIV和HPV。将这些等温扩增方法集成到微流控装置中,可以为病原核酸检测提供简单快速的POC诊断工具。
9.2. 未来方向
LAMP 可用于诊断多种病原体感染,包括细菌、病毒和寄生虫的感染。根据研究,该技术可以以灵敏、省时和 POC 的方式检测和分析病原体。尽管如此,基于LAMP的POC诊断仍有很大的发展空间。由于LAMP容易产生显著的非特异性扩增,因此开发增强其特异性的新方法至关重要,特别是利用减少非特异性扩增的纳米材料。为了提高灵敏度和性能,LAMP可以与其他先进的诊断方法结合使用。例如,Pang等开发了一种将RT-LAMP与CRISPR/Cas12a相结合的单管检测方法,用于诊断针对病毒RNA的N和E基因的COVID-19。通过在试管中进行RT-LAMP并将CRISPR Cas12a试剂加载到反应管的盖子中来实现单管分析。在RT-LAMP反应30分钟后,通过翻转试管将CRISPR试剂与LAMP扩增子混合。crRNA识别启动Cas12a活性的扩增子的特定序列。基于智能手机的荧光分析能够在短短 40 分钟内以 30 拷贝/μL 的 LOD 检测 SARS-CoV-2。此外,基于放热化学反应的无电滤芯可以消除对电力的依赖,并在不使用专业设施的情况下提供准确的测试。
理想情况下,从样品制备到靶标鉴定的整个工作流程应紧凑并与片上LAMP系统集成。然而,开发全自动样品到结果的微流控装置需要结合微型泵和阀门,这使得芯片制造和操作过程变得复杂。由纸和毛细管组成的微流控平台为LAMP扩增提供了有吸引力的底物,用于创建简单、经济实惠的分子实验,特别是对于偏远或资源受限地区的应用。基于纸/聚合物的混合系统还能够长时间保持干燥形式的试剂,从而解决了试剂的储存和运输问题。针对单个靶标具有多个反应孔的微流控芯片设计可以在单个反应中实现多重检测。基于液滴的dLAMP可以通过将单个样品液滴密封在油中来克服残留污染。微滴dLAMP还可以通过将单个靶标分离成单独的微滴来实现多重检测。总体而言,片上核酸提取、纯化和快速传感技术与基于LAMP的微流控模式相结合,是POC诊断检测的理想候选者,能够以多重方式提供高通量和快速的病原体检测,从而降低运营成本、分析时间和残留污染。
原文地址:https://zhuanlan.zhihu.com/p/683956886 |
|
 /3
/3 