插图100%用AI生成。本文严格遵循CLSI EP17-A2 指南的内容,保证内容的权威性,术语定义与原文对应逐字翻译,案例数据经原博士手工验算。
一、 核心概念1. 什么是 Probit 方法?Probit 方法(概率单位法)是一种统计回归分析技术,专门用于处理二项分布数据。在核酸检测性能评估中,它通过建立被测物浓度与检出概率(阳性阳性率)之间的函数关系,来推断出特定检出概率下的浓度阈值。 对于分子测量程序,当样本浓度极低时,结果往往不是连续的数值,而是“有”或“无”。因此,我们无法计算标准差,而是通过阳性率(Hit Rate)来衡量检测能力。 2. 关键术语定义根据 CLSI EP17-A2 标准,以下术语至关重要: 空白限 (Limit of Blank, LoB): 对于大多数分子测量程序,阴性样本的测量结果通常报告为“未检出”或零拷贝。因此,在 Probit 评估中,LoB 通常被设定为零。
Probit 回归: - 回归分析,其中响应函数Y只能有两个响应(即检出或未检出),预测变量X是重复测量的平均值;注:该技术广泛用于评估分子测量程序的检测限。
二、Probit 方法计算LOD的实验要求 Probit 方法的典型应用遵循极限稀释剂量反应方案(limiting dilution dose-response protocol)。从已知测量物含量的起始样品中制备一系列稀释液。这些稀释液通过测量程序进行重复测试,结果被判定为两种结果之一:检出或未检出。对于每个稀释液,计算一个阳性率(Hit Rate),即检出结果的实验数量占测试实验总数的比例。这些阳性率通过数学方法转换为累积正态概率单位(概率单位),并通过回归模型与其相应的测量物浓度进行拟合。最后,使用回归模型计算与预定义阳性率(例如,0.95)对应的测量物浓度,该浓度被取为LoD。1. 最小实验设计针对每个待评估的测量程序,建议的最小样本量和配置如下: | | |
|---|
| 试剂批次 | 2 个 | | | 仪器系统 | | | | | | | 阳性样本 | 3 个 | | | 阴性样本 | 30 个 | | | 稀释梯度 | 5 个梯度 | | | 重复次数 | 20 次 | |
2. 关键:稀释液的分布要求 稀释梯度的设计直接决定了 Probit 回归的拟合质量。如果所有数据点都是 100% 或 0% 检出,模型将无法收敛。因此要求: 中间区间:至少有 3 个 稀释度的阳性率落在 0.10 到 0.90 之间(即 10%-90% 阳性率)。 高位区间:至少有 1 个 稀释度的阳性率 > 0.95(确保包含 LoD 附近的点)。
3. 基因型与亚型如果被测物(如病毒、细菌)存在遗传变异,实验设计应纳入所有主要基因型的代表性样本,确保 LoD 覆盖临床常见的亚型。

4. 数据分析步骤汇总数据:计算每个浓度点的阳性率。 模型拟合:使用统计软件(如 SAS, JMP, R, Minitab 等)进行 Probit 回归。 质量检验:使用 Pearson 卡方检验评估拟合优度。如果拟合不佳(p < 0.05),可能需要增加稀释点或重复次数。 计算 LoD:从模型中推导出 95% 概率对应的浓度值。 最终定值:如果评估了多个试剂批次,应取各批次 LoD 计算值的最大值作为该产品的最终 LoD。
三、 Probit 方法计算原理与公式 Probit 方法是一种统计回归分析技术,核心在于将非线性的“浓度-概率”关系转化为线性的数学模型。主要用于评估分子测量程序(如核酸检测或传染病检测)的检测限 (LoD),这些程序的检测能力以阳性率(即阳性结果数与重复测试总数之比,也称为 Hit Rate)来衡量,。 1. 阳性率(Hit Rate)计算对于第 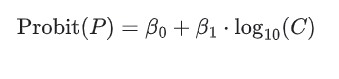
Probit(P):阳性率对应的标准正态分布分位数。可以查标准正态分布分位数表。或者利用 Excel 函数将阳性率(P)转换为标准正态分布的分位数(即 Probit 值)Y = NORM.S.INV(P)
例如,95% 的阳性率对应的 Probit 值约为 1.645 。 注意:如果阳性率为 0% 或 100%,该函数会报错(返回无限大)。实际操作中,通常将 0% 修正为 1/2N,将 100% 修正为 1 - 1/2N,其中 N是重复次数。 C:分析物浓度(通常取 log10 以改善拟合效果)。
四、 实例解析:流感病毒荧光定量 PCR (Flu qPCR)
在 CLSI EP17-A2 指南及 Probit 回归分析中,系数β0(截距)和 β1(斜率)的获取通常有两种途径:“专业统计软件法(最大似然估计 MLE)” 和 “Excel 简易估算法(线性回归近似)”。 对于大多数实验室用户,如果没有 SPSS 或 SAS 等专业软件,可以使用 Excel 进行线性回归近似计算,虽然精度略逊于 MLE,但在 LoD 评估中通常是可以接受的。
1 实验数据收集 我们制备了一系列已知浓度的流感病毒 RNA 标准品(单位:copies/mL),并对每个浓度进行了 20 次重复检测。数据如下: | 浓度 (copies/mL) | X(log10 浓度 (C)) | 阳性数 (Npos) | 总数 (Ntot) | 阳性率(H) | | 50 | 1.699 | 20 | 20 | 1.00 | | 25 | 1.398 | 19 | 20 | 0.95 | | 12.5 | 1.097 | 14 | 20 | 0.70 | | 6.25 | 0.796 | 8 | 20 | 0.40 | | 3.125 | 0.495 | 2 | 20 | 0.10 | | 0 (空白) | - | 0 | 20 | 0 |
2 数据分析步骤Excel 计算演示(以流感 qPCR 为例):假设重复次数 N=20。 | 浓度 (C) | 阳性率 (H) | X (Log10 (C)) | 修正 P (若需要) | Y (Probit) | | 50 | 1.00 | 1.699 | 0.975 (39/40) | 1.96 | | 25 | 0.95 | 1.398 | 0.95 | 1.645 | | 12.5 | 0.70 | 1.097 | 0.70 | 0.524 | | 6.25 | 0.40 | 0.796 | 0.40 | -0.253 | | 3.125 | 0.10 | 0.495 | 0.10 | -1.282 |
X = log10(C),Y=Probit 值 计算 β1:=斜率SLOPE(Y列, X列)≈ 2.78 计算 β0:=截距INTERCEPT(Y列, X列)≈ -2.53
得到方程:Y = 2.78 X-2.53 计算 95% LoD,我们要找出 95% 阳性率(即 Probit 值 Y = 1.645)对应的浓度。代入方程:1.645 = 2.78log10(LoD) - 2.53LoD = 10^1.50 ≈31.75 copies/mL3.3 结果解释与报告小结 精确定义检测限(LoD)不仅仅是一个技术要求,它是确保诊断结果可靠性的基石。Probit方法提供了一个强大、标准化的框架,使我们能够以科学的严谨性和统计学的确定性,来证明和沟通我们检测能力的真实极限。
Probit方法是评价分子诊断方法LOD的金标准。但是很多情况下大家并非用这种方法获得LOD的数据。我始终认为LOD是每种诊断试剂的底线。诊断试剂LOD参数的公示应成为行业共识。 诊断试剂的系统评价除了LOD还有敏感性、特异性等指标,需要参照ROC法进行系统评价。解锁ROC 曲线,从此告别试剂选择障碍。
LOD还需要密切与使用用途相结合。合适的才是最好的。比如现在正是流感刚发的季节,你知道了流感的高流行率,身边有人中招了,你隐隐感觉自己不舒服了。这个时候你需要一个LOD很低的试剂吗?纯靠抛硬币也会很准。当检测与贝叶斯相遇:检测判阴阳,贝叶斯辩真伪 对于检测来说,未来不应还是一次次独立的检测结果,而是会在流行病学大数据和人工智能的加持下变得更加准确和贴近实际。 CLSI EP17-A2 Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures; Approved Guideline—Second Edition 制作了一个probit法计算最低检测限(LOD)的计算器,输入浓度、阳性数和总数就可以自动计算LOD并且绘制出剂量-反应曲线和probit回归曲线。大家可以用我的文章作为附件上传,让大语言模型生成一下。成功了记得打赏哦。
|  /3
/3 