在上周的文章里面,我和大家分析了当前体外诊断产品注册申报资料的两个重要的方面。有需要了解详细内容的,可以点击链接,回看我们上周的文章。从这篇开始,我将对各个资料当中出现的常见问题,逐一进行分析。我们上周的文章里提到过,IVD产品的申报资料,包括六个大部分——监管信息、综述资料、非临床资料、临床评价资料、产品说明书和标签、质量管理体系文件。 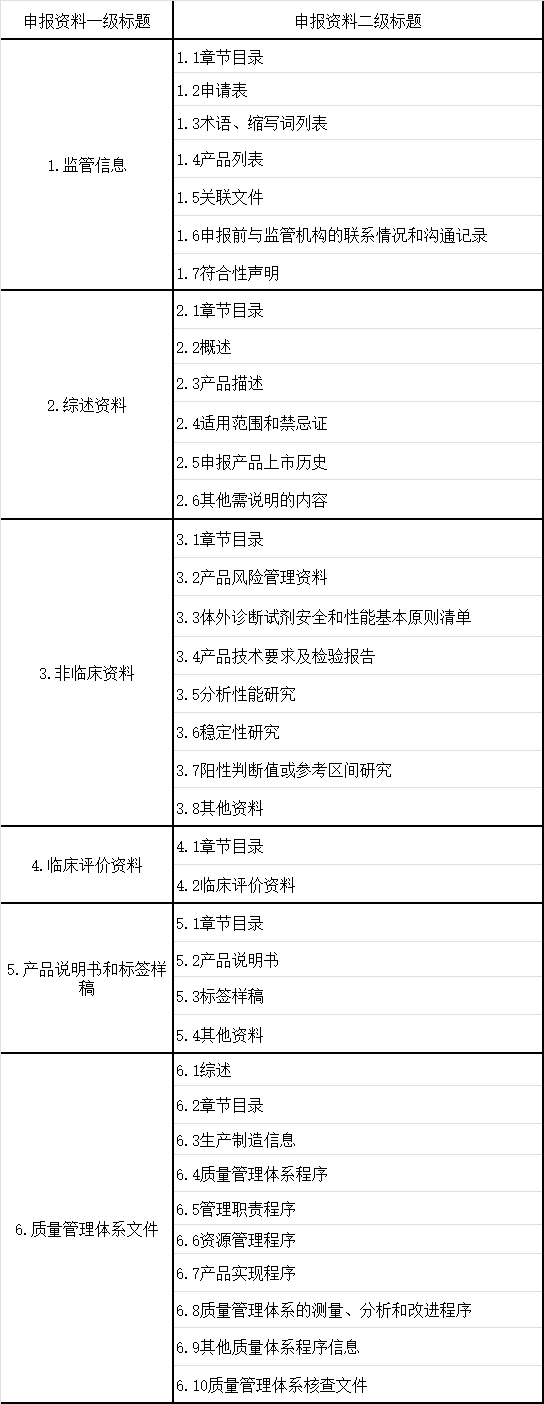
从上面的表格当中,我们可以先看看整个申报资料的结构组成。首先,监管信息的内容,就是产品的申请表、术语、监管沟通信息等等,主要是展示申报企业和申报产品基本情况。其次,是综述资料,是我们整个申报资料的高度概括,向审评老师展示我们产品的具体情况的重要资料。然后,才是各部分的分述资料,包括了非临床资料、临床资料、说明书和标签、质量体系管理文件。所以,综述资料和后面的其他四大部分的内容,其实是构成了一个“总-分”的结构。所以,在“综述资料”当中,我们需要详细说明申报产品的整体情,包括产品的名称、管理类别、预期用途、产品描述、申报产品的上市历史等等。好,在了解了这些内容之后,我们看看,大家申报的综述资料,出现问题比较多的都在哪里。这个问题比较多的是在主要原材料、质控品和校准品、技术原理和工艺流程上。我们先看看主要原材料的具体问题,有三个问题需要特别注意。第一,需要写清楚主要原材料的来源,比如抗原、抗体、磁珠等等,它们的来源是什么。第二,是对于企业自制原材料的,要提供它的制备方法和质量标准。第三,是在填写主要原材料的名称时,不能用“物料编码”代替名称。质控品没有提供制备方法和赋值情况,而校准品,则是没有提供制备方法和溯源情况。技术原理和生产工艺的描述中,最主要的问题是,描述不清晰。很多从业者在进行技术原理描述的时候,描述含糊不清,也没有从反应原理、方法学、测量方法、分析前处理等方面,进行详细描述。整个生产过程,在我们的申报资料当中,写得过于简单。有的从业者,是采用流程图的方式来展示生产工艺流程,但是图示和过程也写得太简单,并且部分的流程没有写。像这些情形,审评老师其实是没有办法,从这些过于简单的描述当中来看到完整的流程。所以,我们在进行原理、工艺描述的时候,要尽量做到详细、清晰,让审评老师可以从我们的申报资料中,就可以了解到我们产品完整的原理和工艺。监管机构、医疗专业人员和终端用户,都是通过我们产品的预期用途,来了解产品的功能、目的和使用场景的。它需要包括产品的适用范围、预期使用环境、适用人群等。我们需要在这里,写清楚产品用于检测的分析物和功能,比如申报的产品在临床应用里是辅助诊断、鉴别诊断、筛查或监测等。还有,临床适应证的情况,比如产品的临床适应症是什么,分析物和临床适应证的关系等等。还要写清楚适用的仪器,它的使用方法是自动、半自动或者是手工,产品的检测类型是定性、定量还是半定量。另外还有,产品适用的样本的情况,比如样本类型是血清、血浆、尿液等,有没有添加剂的要求,样本采集及保存装置等。要说清楚产品预期使用的地点,是家用还是医疗机构当中使用。是由专业人士使用,还是患者可以自用。适用人群的特征需要明确,比如产品的目标人群是哪些,有什么特征,包不包括儿童、新生儿。产品的预期用途,决定了产品的使用风险,也会产品的管理类别造成影响。所以,清晰、准确地对产品预期用途进行描述,是非常重要的。在我们之前的文章中,我和大家讲过了IVD产品的申报资料要求。所以,我们要做好相应的清单,清点我们提交的资料,确保申报资料的齐全性。根据我们以往的经验来看,最容易出现遗漏的是产品的概述、产品包装描述、研发历程以及其他需要说明的内容。我们在申报的时候,会特别容易把关注的重点放在了申报产品本身,而忽略了IVD产品,其实是一个“检测系统”。这个检测系统,不仅仅有申报的产品,还可能包括样本处理的试剂、适用仪器、质控品、校准品、独立软件等等。那么这些内容,也需要在我们进行产品申报的时候,一同提交。比如,适用仪器已经获批了,它的注册信息、说明书,也应该作为申报资料的一部分,一同来提交。综述资料,是对我们申报产品的高度概括,也是申报产品基础情况的展现。希望通过这些具体问题和例子的分析,帮助大家有效完成IVD产品的综述资料。
|
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 