2024年3月21日,贝瑞基因“染色体拷贝数变异检测试剂盒(可逆末端终止测序法)”(国械注准20243400528)获国家药品监督管理局(NMPA)批准上市!据悉,该试剂盒适用于体外定性检测高危孕妇羊水样本,同时检测染色体非整倍体及多个CNV异常情况,可为临床提供全面、精准、高效的产前诊断解决方案!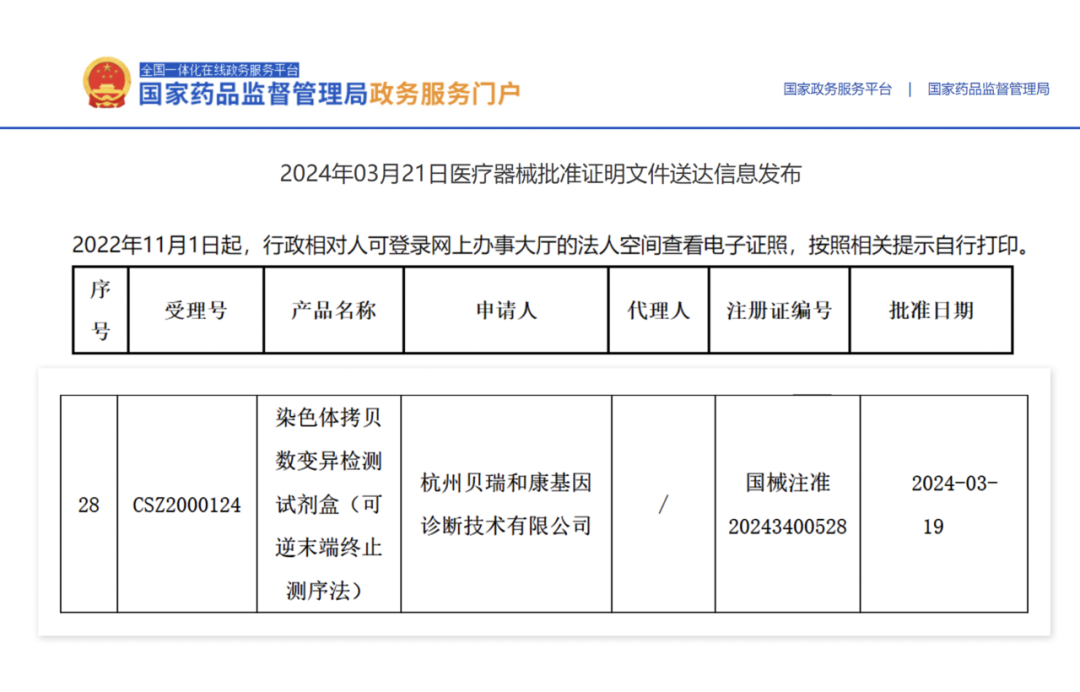
产前诊断是预防出生缺陷的重要方式,我国人口基数庞大,在高龄产妇持续增多和5.6%出生缺陷发生率的背景下,产前诊断供给量长期严重不足。
贝瑞基因作为国内最早将二代高通量测序技术应用于临床的公司,针对传统染色体拷贝数变异的检测方法,如核型分析、染色体微阵列分析(CMA)分别存在的周期长、分辨率低和通量低、成本高的问题,于2013年率先开启CNV-seq研发及回顾性研究,贝瑞基因CNV-seq试剂盒,正是在防控新形势下,寻求产前诊断更佳方案的突破性探索。
2019年4月,《低深度全基因组测序技术在产前诊断中的应用专家共识》的发表,将CNV-seq确认为新一代一线产前诊断技术,而贝瑞基因自主研发并取得发明专利的PCR-free建库技术,无需扩增,是CNV-seq精准检测的技术保证。
据了解,贝瑞基因CNV-seq产品已实现从样本处理到智能化解读的全链条布局,CNVisi®原发性拷贝数变异智能化解读系统基于ACMG最新指南,内置20+权威数据库及百万中国人CNV内部大数据,提升CNV-seq注释解读准确性及可靠性。同时,可节省临床≥90%的操作时间,降低解读报告工作的复杂度及难度。“软硬件”强强结合,共同提升中国临床产前诊断的效率,降低胎儿出生缺陷风险,缓解临床及孕妇的压力!
贝瑞基因在我国生育健康领域起步较早、发展迅速、产品结构完善,是国内NIPT的双寡头之一。NIPT产品也于2015年获得国家药监局批准上市。目前贝瑞基因已经布局了孕前、孕期、新生儿的出生缺陷三级预防,并在临床得到了广泛应用。
近些年来,贝瑞基因积极推动产前诊断合规化开展。截止目前,CNV-seq检测服务已合作产前诊断机构超300家、累积产前诊断样本量超500,000份,40+家权威机构实现全流程自主开展。相信随着此次CNV-seq试剂盒的获批上市,将再次加强贝瑞在基因测序领域的市场竞争力,对其生育健康业务将产生积极影响。
去年,贝瑞基因用于检测染色体拷贝数变异(CNV-seq)的测序文库构建方法和试剂盒,获得欧洲专利局颁发的专利证书(专利种类:发明专利;专利号:EP3642400)。并与阿吉兰兄弟医疗公司在沙特共同成立合资公司,这标志着贝瑞基因在不断打磨技术、创新产品的同时,也为积极“出海”积蓄力量,积极寻求新的业务增长点。
贝瑞基因CNV-seq检测试剂盒获证的十年征程,是高通量测序在临床产前诊断检测探索中的一个缩影。我们期望“天下没有难做的产前诊断”,相信下一个十年基因测序技术能更好地服务临床,为我国出生缺陷防控工作做出更多贡献!
 /3
/3 