术前八项是指各医院在手术前必查的临床上常见的、危害性较大的、经血或体液传播的四种传染病感染的血清学标志物。主要包括针对乙型肝炎病毒(HBV) 、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV) 、梅毒螺旋体(TP)等病原体或其抗体的检测。临床检测术前八项,有助于识别感染者、及早进行干预,同时有效减少医护人员产生职业暴露的风险,降低医源性交叉感染及传播,防范医疗风险与医疗纠纷的发生。因此,无论是对病人还是对医务人员,术前八项检测都具有非常重要的意义,不可不查!

在乙肝筛查中,有效检出病毒尤为重要。而乙肝表面抗原(HBsAg)突变所造成的漏检,对于献血安全、疗效判断等都有很大影响。
新产业生物为提高HBsAg定量检测试剂的灵敏度并扩宽突变检测范围,将传统包被的1株单克隆抗-HBs优化为5株不同的单克隆抗-HBs。保证能够检出不同基因型、血清型突变株,灵敏度更高,可有效降低漏检率。
LIAISON重组HBsAg突变体血清盘的检测中,与国际品牌的HBsAg相比,新产业突破性的检测技术可以检出所有突变株。
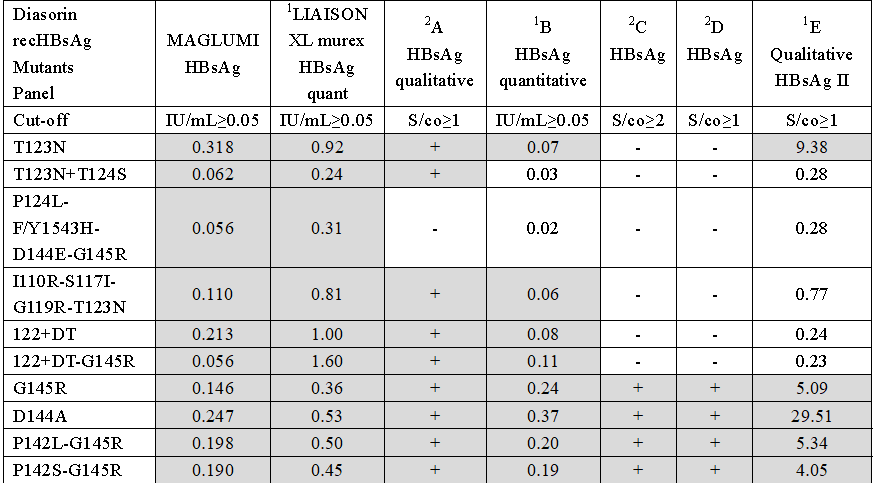
新产业HBsAg试剂可检出所有LIAISON重组HBsAg突变体血清盘的突变株注:①灰色区域代表阳性结果,白色区域代表阴性结果;②A、B、C、D、E试剂均为国际品牌的HBsAg试剂。此外,通过HBsAb定量检测,可判断疫苗接种是否成功以及再次疫苗接种的时间和HBV感染恢复程度。通过HBeAg和HBeAb的定量检测,有助于抗病毒治疗起点、终点的判断、疗程监测,推动乙肝个性化治疗。国内ELISA法多采用1:30倍稀释后检测乙型肝炎病毒核心抗体(Anti-HBc),抗体阳性率约15~20%。根据我国流行病学调查结果,全国乙肝核心抗体(Anti-HBc)阳性率为50%左右。因此,若采用ELISA法检测将导至大量假阴性样本产生。新产业生物化学发光方法定量检测Anti-HBc,具有较好的灵敏度和特异性。在一般样本的比对分析中,与雅培试剂的阴阳性符合率达到100%,具有极好的可比性。
在与国内同样采用化学发光法的某品牌比对中,此品牌的Anti-HBc阳性率仅为21.43%左右,而新产业检测阳性率为50%左右,更符合真实情况。


目前针对HCV筛查,大部分化学发光Anti-HCV试剂检测位点为HCV核心蛋白C、非结构蛋白NS3和NS4,为第二代抗体试剂。新产业生物自主研发的丙肝抗体试剂检出区域为C+NS3+NS4+NS5,属第三代抗体试剂。采用改良的双抗原夹心法及基因融合表达技术,新产业在识别和检测HCV病毒核心蛋白、NS3和NS4抗体基础上,增加了对非结构蛋白NS5区域的检测,可检出单独NS5抗体阳性者,提高了试剂检测的灵敏度,检测结果更加准确可靠。

新产业HCV试剂增加了NS5区域检测,提高了检测灵敏度第三方性能评估中,新产业生物Anti-HCV试剂可检出全部126例不同基因型(HCV 1-6)的样本。此外,与雅培Anti-HCVs试剂盒205例阳性样本的比对,阳性符合率高达99%(203/205)。
第三方性能评估,新产业可顺利检出所有126例不同基因型(HCV 1-6)样本
新产业生物Anti-HCV试剂盒与雅培进行205例阳性样本对比(仅展示部分),阳性符合率为203/205=99%目前国际和国内市场的主流HIV检测产品是第三代抗体检测试剂,检测窗口期为3周。新产业生物自主研发的HIV抗原和抗体检测试剂为第四代HIV检测试剂,可同时检测HIV-1抗体、HIV-2抗体和P24抗原,检测窗口期为2周左右,比第三代HIV抗体检测试剂提前6天检出,其灵敏度几乎可达核酸检测水平。

以往的酶学免疫法只出具阴阳性报告,不利于连续监测。受制于方法学的影响(包被面积小、均一性不足,反应时间不一致,颜色反应等)及手工操作的繁琐,精密度仅为15%-30%,敏感性较低。而新产业生物化学发光可报告具体数值结果,有利于临床对患者病情发展及时监测;全自动分析,规避人为操作导至的误差,重复性好,精密度通常在3%-8%;全自动检测,速度快,节省人力;敏感性较高。

30套血清盘转换盘,新产业比目前国际主流A厂家多检出一个样本
新产业梅毒试剂盒具有优异的性能,精密度及再现性良好,相较其他产品,可提前14天检出梅毒特异性抗体。同时,可溯源到WHO国际标准品,完全符合国家参考品检测要求。

新产业Syphilis试剂盒可提前14天检出梅毒特异性抗体。注:数据来源www.seracare.com
新产业生物采用全自动磁分离直接化学发光技术,探索Tp15、Tp17、Tp47特异性抗原最优配比,使用双抗原夹心保障卓越的诊断灵敏度,采用两步清洗使其具有更好的特异性,目前梅毒试剂盒已获国家发明专利授权(ZL 201510069547.1)。
CE认证是各国产品进入欧盟市场的“护照”。欧盟IVDD指令按照风险等级将产品分为List A、List B、自测产品Self-Testing和其他Others等四类,监管级别依次递减。所以CE List A是IVDD法规中规定最严苛也是最难的一项认证。CE List A认证的难点,第一需要欧洲人群的临床性能评估,一般要委托经欧盟认定的第三方公告机构(Notified Bodies,简称NB)独立完成,与欧盟已上市的性能优异产品进行结果对比,临床性能评估对样本的数量和多样性有严格要求。第二通过CE List A认证后,后续批次上市销售前,还需要送往欧洲权威实验室进行第三方检验,检验合格后,方可上市销售。其严苛的要求,使许多厂家望而却步。截至目前,通过CE List A认证的国产厂家寥寥无几。2019年7月,新产业生物自主研发的丙型肝炎化学发光检测产品成功通过欧盟CE List A认证,成为中国第一家丙肝试剂荣获欧盟CE List A认证的化学发光厂家。2022年3月,新产业生物自主研发的人类免疫缺陷病毒抗原和抗体、乙型肝炎病毒表面抗原化学发光产品成功通过欧盟CE List A认证。2022年5月,新产业生物自主研发的乙型肝炎病毒表面抗体、乙型肝炎病毒e抗原、乙型肝炎病毒e抗体、乙型肝炎病毒核心抗体、乙型肝炎病毒核心抗体IgM等5个项目获欧盟CE list A认证。同时,也成为中国第一家HBV、HCV、HIV拿齐CE list A认证的化学发光厂家。

新产业生物乙肝、丙肝、艾滋试剂拿齐欧盟CE List A认证新产业生物自主研发的乙肝(ZL 201510069151.7)、丙肝(ZL 201510068054.6)、艾滋(ZL 201510069549.0),梅毒(ZL 201510069547.1)检测试剂盒均已获得国家发明专利。

新产业生物HBV、HCV、HIV、Syphilis试剂盒获国家发明专利
借助持续的技术创新,新产业生物在乙肝、丙肝、艾滋病、梅毒等疾病的检测领域取得了显著进展,使术前八项检测性能大幅提升。同时,新产业生物在出海征程中,展现了中国体外诊断高端制造的实力,为推动国产医疗产品走向国际舞台做出了杰出贡献。
在未来,随着科技的不断进步和全球合作的深化,我们有理由相信新产业生物将继续引领行业发展,为全球公共卫生事业做出更大贡献。
 /3
/3 