| 美国FDA对IVD检测试剂产品的批准,按使用场景分成了3类:只能在CLIA实验室使用的产品;可以在CLIA豁免(CLIA Waiver)的场所,也就是通常说的POC(Point of Care)产品;Over the Counter (OTC), 也就是通常说的家用检测产品。2021年3月5日Cue Health Inc.(Cue)宣布其新冠检测产品——Cue COVID-19测试获得了美国食品药品监督管理局(FDA)的非处方(OTC)紧急使用授权(EUA),可以在柜台销售其快速、准确的新冠(COVID-19)测试,使该产品成为美国首个无需处方即可向消费者提供的分子诊断测试。Cue COVID-19 OTC家用自测产品能在大约 20 分钟内将测试结果传送到用户的手机上。Cue COVID-19 OTC 测试简单易用,既具备PCR实验室级别测试的准确性,又具备家用自检产品的私密性,同时能有效避免排队采样时人员聚集导至的交叉感染。2022年,Cue Health 全年销售额4.83亿美元,相对于2021年的6.18亿美元销售额下降21.8%。2023年1月5日,Cue Health发布公告,公司将执行一项费用削减计划。其中,最重要的一点就是公司决定裁员388人,占公司总人数的约26%。此外,Cue Health预计其2023年第一季度的销售额为2000万到2500万美元。这个数据相对于2021年和2022年的销售额,可谓断崖式下跌。 
Lucira Health, Inc.在2021年4月12日宣布旗下产品LUCIRA CHECK IT™ 测试套件获得FDA的非处方(OTC)紧急使用授权 (EUA)。该测试套件可在家中 30 分钟或更短时间内提供 PCR 级别的新冠核酸检测准确性,可供有或无症状的个人使用。2023年2月22日,Lucira发布公告,公司申请破产保护。公司未来将寻求出售公司业务,在此期间公司将继续服务它的客户。Cue Health和Lucira两家公司的新冠核酸检测产品都获得了FDA OTC的EUA,都因为新冠的家用核酸自检产品而业绩腾飞,一时风光无两。然而,后新冠疫情时代,两者一个破产,一个销售额下滑而不得不裁员(而且还要面对着未来的销售额断崖式下滑)。这也让家用核酸自检产品新冠之后的前景蒙上了一层阴影。 虽然新冠疫情后,FDA很快就给出了新冠+Flu A /Flu B 的OTC家用自检产品的申请指南,但是针对新冠+Flu A/Flu B的OTC多联检EUA,FDA在2021年12月后才开始放开了申请。与单一的新冠OTC居家检测不一样,FDA对于新冠+Flu A/Flu B的OTC检测试剂增加了一个使用条件,那就是必须是用于有症状的人。就在Lucira宣布破产后不久——2023年2月24日,FDA批准了美国第一个OTC居家新冠+Flu A/Flu B核酸自检产品,恰恰就是Lucira公司的Lucira COVID-19 & Flu Home Test 。对于美国居家检测市场来说,这是一个具有里程碑意义的事件。FDA也为此做了特别的新闻发布,一般FDA不会对新批准EUA检测产品做这样的新闻发布。“今天,美国食品和药物管理局为第一个可以区分和检测甲型和乙型流感(俗称流感)和新冠的非处方(OTC)家庭诊断测试颁发了紧急使用授权(EUA )。Lucira COVID-19 & Flu Home Test 是一种一次性家用测试套件,可在大约 30 分钟内提供自行收集的鼻拭子样本的测试结果。医学博士 Jeff Shuren 表示:‘今天,第一个可以检测 A 型和 B 型流感以及 SARS-CoV-2 的非处方药测试获得授权,这是一个重要的里程碑,它可以让更多的消费者获得可以完全在家进行的诊断测试。’ ,JD,FDA 设备和放射健康中心主任。‘FDA 强烈支持检测开发的创新,我们渴望继续推进更多的家庭传染病测试,以更好地支持公共卫生需求。我们仍然致力于与检测产品开发人员合作,以实现为需要它们的美国人提供更准确和可靠的检测的共同目标。’COVID-19、流感和 RSV 的共同流行强调了呼吸道病毒诊断测试的重要性,FDA 认识到家庭测试可以提供的好处。该机构将继续利用其权力增加公众可用的适当准确且易于使用的家庭测试的数量,尤其是检测这些高度传染性呼吸道病毒的测试。”在这场新闻发布会中,我们可以明确的看出FDA对于OTC感染类疾病检测产品的态度。新冠之后,FDA发现家用自检产品一方面能有效避免疫情期间聚集采样时人员交叉感染的风险;另一方面,家用自检也能体现对个人隐私的充分尊重。所以,也逐渐的转向支持家用自检产品。此外,对于家用核酸检测产品而言,特别是在感染的早期,其检测相对于抗原检测而言准确性更高。这也是FDA批准家用核酸自检产品的基础。在中国,虽然我们确实已经有不少的抗原自检类产品(甲流、乙流、新冠等)在面对普通消费者销售。但是,我们国内还没看到任何的家用核酸自检类产品在终端销售。当然,我们本身也还没有像Lucira和Cue health这样成熟的家用核酸自检产品。家用核酸检测产品广泛推崇的应用场景是呼吸道感染和性病相关的检测。在这两个场景下,一个是能有效避免人员聚集采样导至的交叉感染,另一个是能充分满足个人隐私的需求。然而,不管是呼吸道感染还是性传播疾病,其常见的病原体也都可以通过抗原检测来实现诊断。考虑到抗原试纸类的产品更便宜、使用更友好,家用核酸自检产品唯一具备竞争优势就是更准。那么,对于感染类疾病,相对于抗原检测,核酸检测检测性能到底有多大的优势?能否支撑其更高的检测成本呢?我们以新冠为例,来看看在感染的不同时期,核酸检测和抗原检测的阳性检出率差异。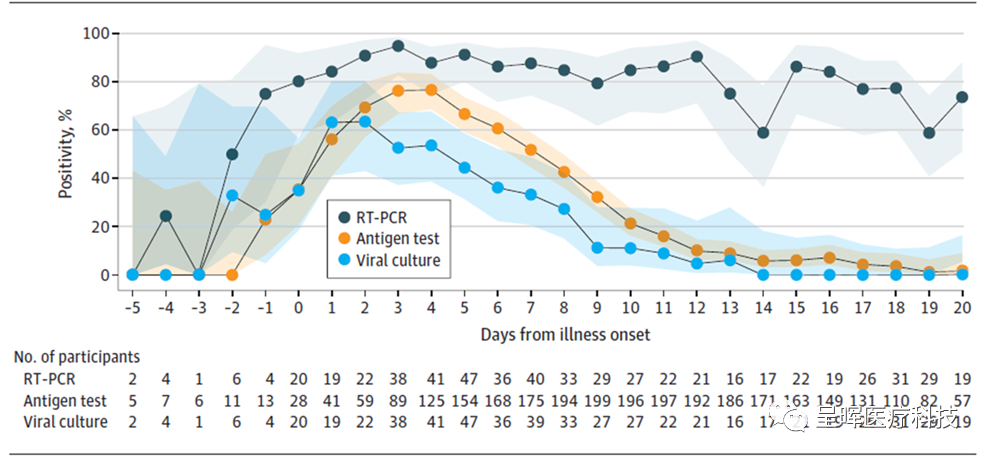
参考文献:Chu VT, Schwartz NG, Donnelly MAP, et al. Comparison of Home Antigen Testing With RT-PCR and Viral Culture During the Course of SARS-CoV-2 Infection. JAMA Intern Med. 2022;182(7):701–709. doi:10.1001/jamainternmed.2022.1827 由上图可以看到,在新冠感染的初期(出现症状的前1-2天),核酸检测(RT-PCR)的阳性检出率迅速升至约80%,而抗原(Antigen test)的阳性检出率低于40%。在出现感染症状一天后,抗原的阳性检测率才升至60%附近,而核酸检测的阳性检出率已超过80%。此外,核酸检测的阳性检出率在出现症状后的2-12天内都维持在90%左右。反观抗原的阳性检出率,在出现感染症状后的第3-4天出到达顶点,但依然低于80%,其后迅速回落。从这组不同新冠感染时期核酸检测和抗原检测的阳性检出率数据来看,核酸检测对于尽早检出阳性患者而言有明显的优势。这也是家用核酸自检产品存在的根基:在感染初期,相对于抗原检测,核酸检测明显更准。不管是呼吸道感染还是性传播疾病,在感染初期的准确检测都具有重要的意义。随着技术的发展,检测成本可以降下来,产品的易用性可以提上来,但是不同检测靶标(抗原还是核酸)决定的检测准确性很难有质的改善。从这个角度上讲,家用核酸自检很可能代表着感染类疾病居家自检的真正未来。 家用核酸自检产品普遍采用的是一步法提取和恒温扩增。这里最主要考量的因素是仪器、耗材的成本以及检测时间。想仪器成本低,需要反复升降温并且要精确控温的PCR技术就不适合;想耗材成本低,就最好检测耗材上集成的步骤少一些,那就一步法提取。同时,恒温扩增所需温度相对于PCR变性温度(95℃)而言要低得多,因此,恒温扩增技术对于检测耗材的封接要求也低得多。这也让基于恒温扩增技术的分子POCT产品的耗材更易实现量产。此外,由于恒温扩增技术不再像PCR反应那样需要不断地升降温,其扩增速度也更快。这样,基于恒温扩增技术的产品检测时间普遍更短。除此以外,考虑到传统的QPCR仪以及分子POCT产品,其最终信号的读取多为光学信号,典型的是荧光信号。因此,传统的QPCR仪(ABI 7500)和分子POCT(GeneXpert/FilmArray)多采用的是荧光检测系统。然而,荧光检测系统不仅会使仪器变得昂贵,也会使得仪器体积不容易做小。基于此,在家用核酸自检领域,传统的基于荧光的信号获取方式也要做出改变。无论是Cue Health还是Lucira,二者最终的测量结果都是可视化的,以规避上述的荧光检测系统的问题。然而,所有的这些降低产品成本的措施,都可能会削弱产品的检测性能,从而使得产品的检测性能低于PCR实验室级别的核酸检测。我们以Cue Health为例来进行说明。
参考文献:Donato L J, Trivedi V A, Stransky A M, et al. Evaluation of the Cue Health point-of-care COVID-19 (SARS-CoV-2 nucleic acid amplification) test at a community drive through collection center[J]. Diagnostic Microbiology and Infectious Disease, 2021, 100(1): 115307.“Our positive specimens were carefully selected to verify the lower sensitivity, and a majority of them (61.1%, 11 of 18) had high Ct values (>30.0). In our evaluation, the clinical performance of the Cue's COVID‐19 test started to decline as the Ct values increased reflecting decreasing viral loads.”——“我们的阳性标本经过精心挑选,以验证较低的灵敏度,其中大多数(61.1%,18 个中的 11 个)具有高 Ct 值 (>30.0)。在我们的评估中,随着样本Ct值的增加,病毒载量降低,Cue 在COVID-19测试的临床表现开始下降。”与标准的实验室级别的核酸检测相比,Cue health的整体阳性符合率为91.7%,阴性符合率为98.4%。当我们用一些Ct值大于30的样本(低病毒载量的样本)进行测试时,发现Cue health的临床变现开始下降。这也表明,Cue health的检测灵敏度还是要低于实验室级别的核酸检测。所以,对于感染类疾病,虽然实验室级别的核酸检测比抗原检测明显测得更准(特别是在感染早期),但是作为家用核酸自检产品,我们要考虑产品的成本和易用性,就要做出取舍。作为取舍的结果,一步法提取、恒温扩增以及可视化的结果呈现就变成了家用核酸自检产品的技术实现路径。但这也削弱了其产品的检测性能。作为面对普通家庭用户的OTC产品,检测性能与产品成本及易用性之间的平衡与取舍,也将不断考验每个产品的生产商。家用核酸检测产品在居家自检市场将面临着与抗原试纸类产品的直接竞争。这里最大的问题就是产品的价格。以Cue health为例,其产品分为两个部分,一个是Reader(读卡器),对应的是检测仪器;一个是Test,对应的是检测耗材。读卡器单独售价199 美元,读卡器和一包三个测试售价 394 美元。这个价格,即使在美国,也不算便宜了。IVD企业以往面对的使用客户是有专业检验医学知识的医院方。如果做OTC的产品,那面对的使用客户就变成了普通的家庭用户。让医院方在检测准却贵和不那么准却便宜之间做出选择往往不难。然而,对于普通家庭用户而言,怎么让大家相信家用核酸自检产品测得确实更准就已经挺难的了。更难的是,在有更便宜的抗原试纸类产品的情况下,让普通家庭用户做出符合核酸自检产品厂家期望的选择。这也为传统的IVD企业的营销带来了一系列的全新挑战。对于绝大多数感染类疾病,无论为了有效阻止交叉感染还是有效地治疗,感染初期的准确检测都具有重要的意义。
随着技术的发展,检测成本可以降下来,产品的易用性可以提上来,但是不同检测靶标(抗原还是核酸)决定的检测准确性很难有质的改善。从这个角度上讲,家用核酸自检很可能代表着感染类疾病居家自检的未来。只是,还要等多久,这里就涉及产品的成熟度(在保证检测性能的同时做得更便宜、易用)以及监管部门的态度(本身与产品的成熟度也有关)。本站转载文章观点仅代表原作者,如有侵权请联系删除!
|
 /3
/3 