| 多重PCR也是分子检测领域比较热门的一个方向,最近很火的一个原因,将其用在靶向测序tNGS上面,真正的做到了一百多重,虽然多重PCR的理论基础支持做到百重、千重等等,但是实际上做到二三十重已经到了极限,主要的原因是信号标记特异性和检测技术的灵敏度还远远达不到理论值。于是现在能做到二十多重的检测产品,要么是采用基因芯片技术进行反应体系分隔而实现多重,或者采用终点核酸检测方法,像电泳,测序等等。那有没有一种技术不用这么麻烦,直接采用单管检测,实现多重或者超多重检测呢?理论上可行,实际上有很大难度。直接采用单管检测实现多重或者超多重检测,一般有三种,第一种是多重qPCR,通过试剂设计和分析技术的改变来实现,第二种是以微流控技术在有限的信号通路下,通过微流控分隔扩增体系来实现多重,第三种就是膜杂交或液相芯片技术,通过形成“微球-探针-靶标-报告基团”复合物,然后再通过检测光源进行检测。这种是目前最多企业做的,用3色、4色或6色的荧光通道来设计多靶点的检测产品,一般是三重或者四重检测,如果要再多一些靶标就要进行“分管设计”,比如说用三管,四管,六管或者八管,这样就可以做到多重,比如说非常经典的HPV分型检测产品就是用四管或者六管来做的,还有一些像艾德生物伴随诊断的检测产品则使用八管或者十管的设计来覆盖更多的突变基因型,这种设计虽然在一定程度上解决了多重的问题,但是也牺牲了通量。 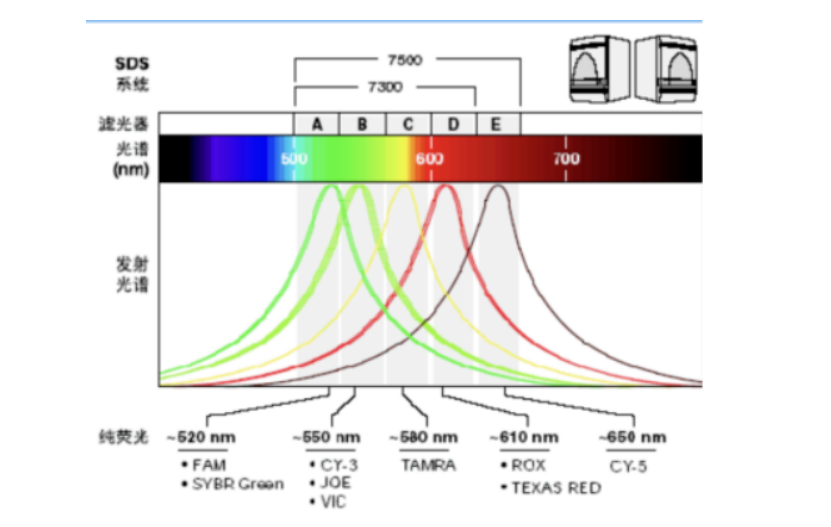
于是,高分辨熔解曲线(HRM)技术就被寄予厚望,因为它能够做到一管多型,同时对通量没有损失,比如说致善生物的HPV分型产品,结核耐药产品等就采用这种技术,这种基于荧光探针熔解曲线的多重PCR技术非常具有想象力,如果再搭配多色荧光,就会实现百重、千重的靶标检测,目前从国内的PCR技术企业来看,致善生物在这个方向上走的最快。近期普济生物通过荧光编码技术也能实现单个荧光通道10阶信号的分类,每增加一个应该通道按照一维来看,其两色荧光可以实现10X10个靶标的检测,三色荧光就是10X10X10, 达到1000个基因位点了,这个理论值看起来是不是非常的有想象空间。这种技术是将同一份标本经过核酸提取之后,分别注入不同的PCR反应舱室内进行独立的反应,这些舱室提前预装了不同的引物,每个反应仓进行的反应均不一样,即便只有四色荧光,只要分的PCR独立舱室足够多,那也能够实现多重检测,比如说腾飞基因的产品设计就有点这种感觉,也是非常具有想象力的产品设计。这种技术的核心在于将捕获探针固定在膜上或者芯片上面,然后使得经过处理的多重PCR复合物经过膜或者芯片,然后被探针捕获进而发出荧光,在机器的检测之下,完成结果报告,比如说凯普生物的HPV膜杂交的产品、Luminex的液相芯片等产品,只要特异性的捕获探针固定的足够多,再对液相微球进行编码,实现百重、千重也不是问题,这个理论值也是非常值得想象。
为什么实操上就有很大的难度? 这么多的技术路径,为什么现在好像做出来的产品很少,最多做到30多重就没法往上了,这就回到我们今天的第二大板块的内容,理论值可以,但是实操起来就不行。
(1)荧光基团的相互干扰 在多重qPCR中针对不同靶标的检测,需要设计不同的探针、选用不同光谱范围的荧光基团。虽然许多荧光光谱相似的荧光基团的最大发射波长不同,但在附近的波段内,它们仍然会相互重叠,因此荧光基团的发射光谱之间的相互干扰就成了限制多重PCR发展的最大难题。目前普遍水平能够调配到4-6色荧光通道之间的不干扰,再继续增加信号通路干扰越大。 (2)多靶点的扩增效率差异 在PCR扩增的过程中,较高丰度的靶点往往会抑制较低丰度基因的扩增,所以在设计多重分析时,应根据 PCR 反应中各基因和基因产物的 DNA 或 cDNA 绝对丰度,识别多重反应中哪种基因或哪些基因有可能引起饱和,需要在引物设计上做一些预防措施。 需要指出的是多重PCR实验并不是简单地将多对特异性引物混合成一个反应体系。多重PCR之所以难,还难在多个靶点之间扩增条件不兼容,每个靶点都需要旁边其他的引物配合。 (3)引物二聚体 传统单管多靶标扩增的方式通过不断优化反应体系中缓冲液、酶、引物、探针等的用量,确保每一重的扩增效率保持一致,然而随着检测重数的增加,形成二聚体甚至多聚体的可能性也大幅上升,轻则导至非特异性扩增的出现,靶标扩增效率下降,检测灵敏度和特异性降低,重则导至非特异性扩增占据主导,靶标扩增失败,造成假阳性和/或假阴性,影响检测准确性。 (4)信号检测精确度不足 不管是多重的探针设计还是微流控的多孔设计,在信号的检测和分析上都是一个不小的挑战,尤其是实现实时检测,众多信号交叉在一起,同时差异又特别小,则对相机精密度要求更高。 综上所述,多重PCR技术虽然目前有很多实现路径,而且其具有多重、快速等特点,在理论层面具有非常大的想象空间,但是其也面临着各种技术实现上的难题,若能有所突破,未来其应用场景会将PCR带入一个全新的时代。 以上综合自互联网,部分观点仅代表作者锁炎的个人观点 声明:本文仅代表作者观点,不代表平台立场,如果转载涉及版权等问题,请尽快联系我们,我们第一时间更正或删除,谢谢!
|  /3
/3 