达安基因一步把HIV-1 RNA降价至15元;
圣湘生物开展“一年两次,安心之选”HIV感染者关怀试点项目;
丽珠试剂借助顶级标杆及灵活商业政策装机超百台;
赛沛也在多地下沉市场获得大量设备订单;
2022年至少3家企业获批HIV-1 RNA核酸定量检测试剂……
那么问题来了,谁可以真正撼动罗氏、雅培等早期市场红利者的江湖地位?
艾滋病核酸定量检测市场多年来以外资品牌为主导,如罗氏、雅培及已经退市的梅里埃。国内主要厂家有东北制药、达安,万泰,其中只有东北制药这些年能在市场上分了一杯羹。如前言所说,从2020年开始,市场格局慢慢发生了改变。苏州新波2021年HIV-1 RNA试剂获批,圣湘生物、山东见微、豪洛捷等公司相关产品也在2022年拿证,2023年仁度生物的试剂也即将获批,路上还有N家在报证的路上。艾滋病的全称是“获得性免疫缺陷综合征”(Acquired Immunodeficiency Syndrome,AIDS)。它是由艾滋病病毒(human immunodeficiency virus,HIV)引起的一种病死率极高的恶性传染病。人体在感染HIV后,病毒会将其基因组复制到细胞DNA中,形成病毒库,继而源源不断地产生病毒。在这种状态下,病毒可有效地躲避抗HIV药物和人体免疫反应。让感染者逐渐丧失对各种疾病的抵抗能力,甚至会导至死亡。抗逆转录病毒治疗(ART)可阻止新病毒的产生,但不能消除病毒库,故而需要进行日常治疗来抑制病毒。目前艾滋病逐渐转变为了类似高血压、糖尿病的内科慢性疾病。艾滋的传播方式主要是性传播,占97.9%,其中异性传播占七成以上。其次是母婴传播和血液传播。
比较奇幻的是已经有两例未经过治疗而自愈的HIV感染者,感兴趣的可自行搜索。
02 HIV-1 RNA定量检测的主要战场在哪里 ?2003年12月1日,温家宝总理到北京地坛医院看望艾滋病患者。这是中国国家领导人首次接见艾滋病患者。当时,温家宝将5项承诺改为“四免一关怀”政策。“四免一关怀”政策的提出,彻底改变了中国艾滋病防治的被动局面。轰轰烈烈的艾滋病筛查在全国开始了。
根据查询相关公开信息显示,从2004年12月1日起北京市开始实行艾滋病防治的四免一关怀政策,四免一关怀是当前和今后一个时期我国艾滋病防治最有力的政策措施。自2003年四免一关怀政策逐渐实施以来,越来越多的艾滋病患者接受了正规检测与治疗,抗逆转录病毒治疗覆盖范围不断扩大,关怀形式、方案不断创新。
也就是说,在中国的HIV-1 RNA定量检测80%来自于国家四免一关怀的政策拨款,也就是专款专用的经费,那么剩余的20%则来自于各个省市的自主收费及申请物价来实施的。
那么相对来说想要进入这个市场,四免一关怀的每年集采不可小觑,目前很多公司虽然看上去装了一些设备,但是开展不起来或者样本量有限,归根结底是因为没有抓住主流市场,从而年年被统一招标抛在门外,等招标结束只能再苦等一年,忘仪器兴叹。
不过总体来说,HIV-1 RNA定量检测的市场非常有限,每年国免只有一人一次,全国仅仅100万随访人群,如果像达安这样的做法,即使份额全部拿回来,也就1500万的收入,真真的小众之中的小众,不值一提。
参照《艾滋病和艾滋病病毒感染诊断(中华人民共和国卫生行业标准WS293-2019)》、《全国艾滋病检测技术规范(2020版)》及《中国艾滋病诊疗指南(2021 年版)》中临床诊断相关的检测分为抗体筛查试验和补充试验。抗体筛查试验:包括免疫凝集试验、免疫层析试验(ICA)、免疫渗滤试验(IFA)、酶联免疫吸附试验(ELISA)、化学发光免疫试验(CLIA)、抗体抗原联合检测试验等。补充试验:包括抗体确证试验和核酸试验。抗体确证试验包括免疫印迹试验、条带/线性免疫试验、免疫层析试验、免疫渗滤试验及特定条件下的替代试验。核酸试验包括核酸定性试验和核酸定量试验。而在实践中,优咨康统计了NMPA注册的HIV产品信息显示:批准的116款试剂盒中共涉及了30种方法学:数量最多的为胶体金/乳胶法,有40款产品,化学发光产品也较多。目前随着疾控确证检测的日益完善和恐艾人群对于结果实效性的需求,核酸检测的呼声与日俱增,但是目前国内单项目HIV-1 RNA定性试剂取证的厂家寥寥无几,也就预示着这个进度的推进会相对缓慢。在去年的世界艾滋病日上国家卫健委发布的数据显示,全国报告现存艾滋病感染者114万例,我国艾滋病疫情总体控制在低流行水平。虽然与14亿人口相比,艾滋病感染者的人数在绝对值和相对值都不高,但检测市场是非常大的。半仙的脑子不太灵光了,依稀记得在2019年学术研讨会上专家介绍检测量超2亿人次,2021年的某次学术会上专家分享的是检测量达3.2亿人次。如果有人知道这个具体数据,欢迎后台留言告诉半仙,别让他太孤陋寡闻的。为什么会有这么多检测量,可以简单理解为恐艾、高危人员会不停地测试的。大家可以搜搜天猫、京东等电商平台艾滋检测产品的销量便知。单看核酸检测市场,国家会为艾滋病感染者免费提供每年一次的核酸检测,也就至少意味着114万人份的HIV-1 RNA检测量。而HIV核酸检测厂家的出厂价差异又巨大,从十几块钱跨度到两三百元。全省各地收费也是差异不小,上海收费1620元,北京收费1200元,而某些省收费也就百元。而且国免外的自费检测随着地域的差异,检测量也有很多的差异,患者还是很难打破自我管理的僵局,也就是花感染者的钱难上加难,读者自己算算这个市场有多大,值不值得投入。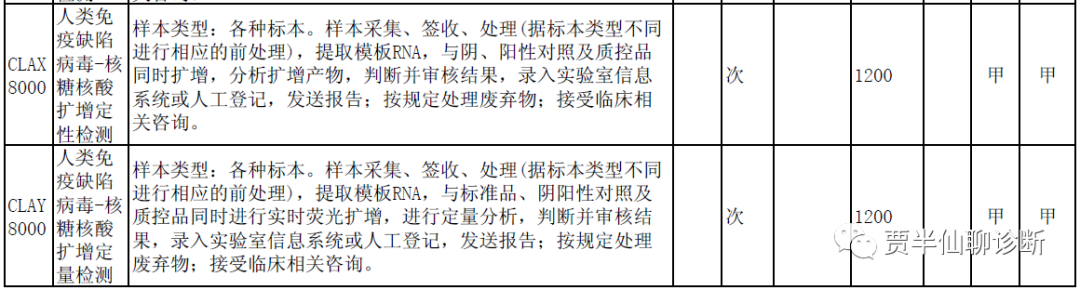
根据优咨康统计获证的HIV相关产品共144款:105款境内产品, 39款境外产品;28款质控品/液,116款检测试剂盒,涉及企业74家:境内公司60家,境外公司14家。
今天重点撸一撸HIV RNA核酸检测产品:
1) 罗氏诊断:cobas® HIV-1 Test
cobas® 4800 System Performance其他平台产品性能请查看Roche官网信息:https://diagnostics.roche.com/global/en/products/params/cobas-hiv-1-test.html#productInfo2) 豪洛捷:Aptima® HIV(RT-TMA法)- 采用多批次试剂进行可多次重复对HIV-1 M、N和O组进行验证
- 搭配Panther平台,样本进结果出,2h41min出结果
3)赛沛:Xpert HIV-1 Viral Load- 试剂盒中全自动完成 RNA 提取、纯化、逆转录以及 cDNA 实时定量检测
- 可在 90 分钟内快速定量 1 mL 血浆样本中的 HIV-1 RNA
双区段扩增防漏检:扩增引物分别位于高度保守的HIV-1 pol基因和LTR区域
内标法定量:排除孔间差异;无需额外建立标准曲线
检测灵敏度高:最低检测限30IU/ML (16.64cp/ml; 1拷贝/ml相当于1.7IU/ml)
严格的多重防污染设计:UNG酶防污染体系;石蜡油封盖
- 灵敏度可达25 IU/ml (12 copies/ml)
- 平台可及性高,可搭载多款半自动和全自动仪器进行提取,并适配多种PCR分析仪
检测速度快:单批样本处理≤30min,96个样品时间约为3.5小时
快速便捷:配套预封试剂,仪器全自动完成提取过程
操作简便:全中文操作界面,预置程序
检测下限为≤30cps/mL;检测范围28-5.88E8cps/mL
基因覆盖型全:能够覆盖HIV-1九个基因亚型
检测准确度高:标准品及内质控采用Armored RNA假病毒专利技术
防范污染措施齐备:仪器紫外消杀;试剂热敏UNG酶
7)达安基因
8)宝瑞源

- 定量限范围:2.9E1-1.16E7copies/ml

检测灵敏度:最低检出限30IU/mL(17cps/mL)
动力学范围:50-1E8IU/mL
双靶标检查,避免漏检:LTR+GAG双靶标,覆盖全部流行亚型
内标:假病毒内标,全程监测提取与扩增过程,避免假阴性
检测样本:血浆或血清
防污染体系:UNG+dUTP。
配套自动化设备:50分钟完成从原始管上样到PCR体系构建,自动扫码、自动液面探测、凝块探测、气密性检查,不接触血样,内置UV+HEPA系统
其他的产品有机会再写。此外试剂不仅仅是试剂,一般会配套设备形成整体解决方案,上述产品参数中也有很多体现了设备的优势。我把各厂家系统比较放在了星球,有兴趣的可以看看。
2022年4月国家卫健委印发2021-2030年中国妇女儿童发展纲要实施方案的通知,产前筛查、新生儿遗传代谢病筛查、宫颈癌和乳腺癌综合防治、减少艾滋病、梅毒和乙肝母婴传播、儿童常见疾病和恶性肿瘤是未来8-10年的长期大力发展方向。联合国发布的“到2030年终结艾滋病流行的政治宣言”承诺:1)将预防作为优先事项,确保到2025年,有效的艾滋病综合预防方案涵盖95%的有HIV感染风险者;2)承诺2030年前实现“三个95%”目标,即95%的HIV感染者能得到确诊,95%的确诊者能获得ART,以及95%的接受治疗者体内病毒得到抑制。但随着生育率及母婴阻断项目的有效实施,HIV-1 RNA定性检测试剂的市场也很微量,每年不超过15000人份数,也就是在这个层面上,厂家想做大做强是有点难度,但是如果新型的企业,如果能拿下这个市场也是一个非常稳定的销售来源,值得一试。
《中国艾滋病诊疗指南(2021年版)》中建议病毒载量检测频率:在ART前应进行一次检测,初始治疗后,建议第1次检测应在治疗后4周左右,然后每3个月检测一次直到病毒载量完全被抑制。治疗后两年以内,建议每3~4个月检测一次。治疗两年以后,如果病毒载量被稳定抑制,则每6个月检测一次。如果治疗过程中病毒载量>200拷贝/mL,建议每3个月检测。天津精耐特基因生物技术有限公司早在2018年获得“人类免疫缺陷病毒1型(HIV-1)DNA检测试剂盒(荧光PCR法)”,算是开辟了另外一个思路。当HIV进入人体的CD4细胞时,HIV RNA首先会变为HIV DNA前病毒。由于HIV DNA会嵌入人体CD4细胞的DNA当中,所以一但感染HIV,即使是服用抗病毒药物(包括暴露后阻断药物),也无法将HIV DNA清除。所以HIV DNA前病毒是人体在感染HIV后最早的生物标记,仅需3-7天的窗口期即可检测出,是目前窗口期最短的检测标志物。HIV DNA指标已经写入了《全国艾滋病检测技术规范(2020版)》。但是HIV-1 DNA没有区别于HIV-1 RNA有效的治疗方法以及各省市收费都没有开放的前提下,这个项目很难展开,也仅作为临床科研的一个补充。如果近两年仍未有有效治疗途径的开展,这个指标也很有可能会从指南中移除。目前暂未有HIV-2核酸检测产品获批。我国以HIV-1为主要流行株,获得核酸产品注册证也是HIV-1。尽管HIV-2型主要集中在非洲西部区域,未形成全球性扩散,但从1999年起在我国部分地区已发现有少量HIV-2型感染者。
此外新技术平台也开始出现在该领域(NGS),2022年6月遗传办也通过了HIV-1基因耐药分型检测试剂盒(半导体测序法)临床试验。总之,HIV治疗药物入医保,哨点医院增加,国产替代政策,梅里埃HIV产品退市等等都会利好国产产品,而且也是一个远未饱和,尚有多种检测需求未被满足的大市场。但还是得说下,艾滋市场不同一般的产品,阳性确认“兹事体大”。所以预计两三年内大的格局不会有大的变化,还是进口品牌的天下。两三年之后呢,那就看各家的定力、产品、学术、品牌、服务等等综合实力的PK,愿大家都有美好的未来。
 /3
/3 