技术篇:数字PCR实验成功的关键因素
2023-3-8 11:18|
编辑: 沙糖桔|
查看: 2613|
评论: 0|来源: 分子生物应用
摘要: 数字PCR(digital PCR, dPCR)技术是继real time PCR技术的第三代PCR技术
数字PCR(digital PCR, dPCR)技术是继real time PCR技术的第三代PCR技术,该技术具有超高灵敏检测特点。由于不需要标准品可利用泊松分布统计计算实现绝对定量,而称之为数字PCR技术。数字PCR技术应用领域广泛,包括肿瘤早期筛查、遗传生殖、感染性性疾病检测、环境微生物检测、产前诊断、科学研究和生物制药等领域。数字PCR可以定量样本中目标基因组或互补DNA(cDNA)、RNA的绝对拷贝数,因此,它可以用于多种应用。对于基因分型应用,dPCR具有足够的灵敏度,可用于罕见的等位基因或拷贝数变异检测,液体活检分析;确认基于CRISPR的基因组编辑或DNA质量评估所引起的同源性定向修复(HDR)或非同源末端连接(NHEJ)以及下一代测序(NGS)。另外,dPCR是一种高灵敏技术,可以从单个细胞中检测基因表达,确定microRNA的表达水平,鉴定病毒感染,并检测病毒载量。尽管这些试剂与传统的定量PCR(qPCR)分析非常相似,但定量方法却有所不同。dPCR和qPCR之间的异同点在以下dPCR步骤分解中概述。
数字PCR(dPCR)工作流程。分离基因组DNA(gDNA)或将mRNA样品转换为cDNA后,添加预混液,靶标特异性引物和探针。混合液经过稀释和分区,每个分区中有1个或0个目标。PCR扩增后,记录每个孔或液滴的荧光信号。阳性孔或液滴的数量提供了样品中起始目标gDNA或cDNA分子数量的准确计数。与所有基因组分析一样,必须获得核酸样品。对于基因分型应用,需要从目标组织或样品中纯化基因组DNA(gDNA)样品。为了进行基因表达分析,需要分离目标mRNA并通过逆转录酶分析将其转化为cDNA。与qPCR一样,dPCR使用热稳定的DNA聚合酶扩增靶DNA,因此无法直接扩增RNA。获得纯化的gDNA或cDNA后,将样品与正向和反向引物以及水解探针混合,水解引物设计为具有与目标靶基因/DNA互补的序列。引物退火至靶序列的外部区域,与典型的PCR反应相同,水解探针是为了提高检测特异性,5'核酸酶(水解)探针在正向引物和反向引物之间退火,水解探针包括5'荧光团和3'淬灭剂。与传统的qPCR分析一样,引物和探针设计是获得准确结果的关键。由于数字PCR检测和qPCR检测的设计相似,引物探针设计原则基本相同,但是dPCR对引物特异性要求较高,请参考探针设计注意事项。数字PCR,也可以使用SYBR或EvaGreen嵌入双链DNA染料完成检测,而不是5'核酸探针。这些引物的设计至关重要,因为无法将引物二聚体的扩增与靶标的扩增区分开。使用公认的测定方法并对产品进行熔解曲线分析可以确保测定的特异性。尽管数字PCR反应体系与qPCR测定相同,但数据生成阶段有所不同。dPCR分析首先将反应分为数万个纳升反应,因此每个分区中有1个或0个目标DNA分子。不同厂家实现分区的方法各异,在某些dPCR平台中,反应被分为单个的微孔,而其他dPCR平台则以油/水乳液形式产生纳升大小的反应液滴。dPCR不能像qPCR那样实时分析单个扩增反应,而是采用终点检测方法,检测10,000多个单独的PCR反应。分区完后,使用常规PCR循环参数扩增微分区中的模板DNA。当DNA聚合酶在循环的延伸/延伸部分从正向引物延伸时,其核酸外切酶活性会使探针降解,从而释放5'荧光团,进而释放出可检测的荧光。如果测定包括插入染料而不是水解探针,则荧光会随着双链PCR扩增子的积累而增加。PCR循环完成后,任何包含1个模板或目标DNA序列的分区都将发出荧光。缺少目标DNA的任何液滴或孔都不会发出荧光。带有荧光的液滴或孔的总数代表样品中目标分子的总数。从统计学上讲,某些分区有机会具有多于1个的目标DNA,可以通过应用泊松分布函数最终确定样品中目标分子的总数来进行校正。影响数字PCR实验成败因素较多,包括操作方法、引物探针特异性、退火温度、引物探针浓度、核酸模板浓度、PCR反应液配置等。不同dPCR平台因分区原理各异,所以可能会有各自的操作注意细节,这里主要介绍除操作方法外的影响因素。dPCR与qPCR检测原理相同,均可利用染料法和Taqman探针法检测荧光信号,所以针对dPCR引物探针特异性的设计要求基本相同。但是dPCR由于是在1nl(纳升)的反应体系中实现的扩增,一般在该体系中只有1个模板分子,实现引物和探针高特异与模板结合,要求引物和探针具有较高的特异性,因此在设计dPCR引物探针时需注意:扩增产物长度建议为60-120bp;上下游引物退火温度相差<1℃;对于Taqman探针法,建议使用双淬灭探针,尤其是当dPCR检测背景过高,干扰样本检测的准确性;建议探针修饰荧光基团的位置不要有G碱基,G碱基会淬灭荧光信号。前面提到dPCR对引物探针的特异性要求较高,所以对于扩增时退火温度要求也较高。一般qPCR选择用引物Tm值减去2-3℃作为退火温度,但是对dPCR退火温度的确定,需要用梯度退火筛选最适合的退火温度。当然,也可以用qPCR退火温度减去3-5℃作为dPCR退火温度,如果结果不稳定,重复性较差,仍然需要做梯度退火筛选最佳退火温度。总之,dPCR技术对退火温度较为敏感,需要筛选最佳退火温度,并且一般低于qPCR退火温度。一般地,qPCR退火时间为15-30秒,但是数字PCR退火时间较长,一般为45-90秒,其主要原因是数字PCR反应体系中都会加一些油(不同平台油的作用不同),导至数字PCR反应体系较大,需要较长的退火时间保证引物/探针与模板结合。另外,还需要注意数字PCR反应体系中有荧光信号,在PCR扩增过程中需要设计升降温速率,一般设计为1-2℃/s,一般采用2℃/s。qPCR检测的动态范围一般为10-107copies/ul,对应的ct值范围是15-35。而dPCR动态范围稍小,一般为1-104copies/ul,但是dPCR检测下线明显低于qPCR,可以准确检测到单拷贝基因,因此,dPCR更适合检测拷贝数较低的基因,当然拷贝数较高的基因,可以将其稀释后检测。所以,样本初始浓度的高低对dPCR来说影响较大,样本浓度过高,超过dPCR检测上线,导至检测不准确,所以需要评估样本初始拷贝数。样本初始拷贝数的评估分为两类:质粒初始拷贝数可以通过质粒浓度和质粒大小计算出理论拷贝数。例如,某质粒大小为5000bp,用紫外分光光度计测量的浓度为50ng/ul,将两个参数带入计算公式,计算出该质粒理论拷贝数为9.26×109 copies/ul(计算方法参考http://cels.uri.edu/gsc/cndna.html),因此需要将该质粒至少稀释106倍,然后用dPCR检测。为了保证样本初始拷贝数在dPCR动态检测范围内,只能通过其他方法检测(如qPCR)或通过多次dPCR梯度稀释实验来验证。对于dPCR梯度稀释实验,就是将样本做梯度稀释,然后选择那个可以用dPCR准确检测出结果的浓度。对于用qPCR评估,主要是借助qPCR的ct值评估样本大概的拷贝数,以下是ct值与分子数的对应关系(该对应关系是大概值)。当数字PCR检测背景荧光信号过高时会导至阳性信号与背景信号区分不开的现象。如果是染料法实验,可以考虑降低引物浓度来下调背景荧光信号。如果是Taqman探针法实验,可以考虑降低探针浓度下调背景信号,当然,还可以采用双淬灭探针降低背景信号。双淬灭探针既可以降低背景信号,同时可以提高探针与模板结合的灵敏度。IDT有推荐的双淬灭探针选择,特异性和灵敏度较高,但是成本较高。国内可以自主选择合成双淬灭探针。一般在dPCR反应体系中引物和探针终浓度在100nM-400nM之间,根据我们的经验,数字PCR反应体系中引物和探针的终浓度在200nM左右适合多数项目。对qPCR来说PCR反应液的配置,一般是先将相同的液体混合到同一个PCR管中,根据实验设计分成若干份,然后分别加入不同的试剂,加样时要求先加入体积多的,再加入体积小的试剂,然后分装到qPCR 8联管中检测。对dPCR来说前面qPCR配样方法完全相同,但是需要注意的是如果有重复孔dPCR也需要将不同的复孔反应液配置到同一个PCR管,最后上样时,分别取样点样到dPCR系统,同时还需要吹打混匀。由于dPCR灵敏度较高,如果样本配置不均匀会导至复孔差异大(这种情况是操作误差造成)。实时荧光定量PCR可以进行绝对定量和相对定量,其中绝对定量是用一系列已知浓度的标准品制作标准曲线,在相同的条件下目的基因测得的荧光信号量同标准曲线进行比较,从而得到目的基因的量,标准品可选择纯化的质粒DNA或体外合成的ssDNA等,相对定量通过内参等进行换算起始样品中DNA的相对含量。数字PCR是基于传统PCR、实时荧光定量PCR基础上发展起来的第3代PCR技术,它不需要标准品,也不要制作标准曲线,即能实现更灵敏、更准确的绝对定量。同时,数字PCR是单分子扩增技术,能够有效避免反应抑制剂的影响。随着反应室的增加,反应受到抑制剂的影响就越小。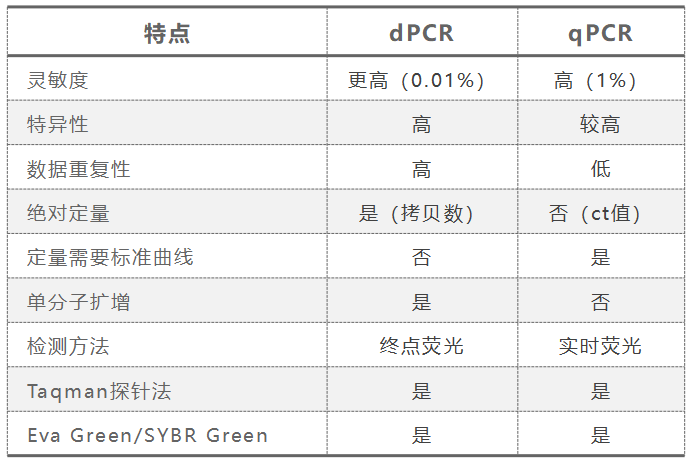
|
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 