| 在试剂研发过程中,可能遇到一些反常问题,举个例子,比如对于酶免试剂,我们包被1ug/ml和2ug/ml,反应曲线如下: 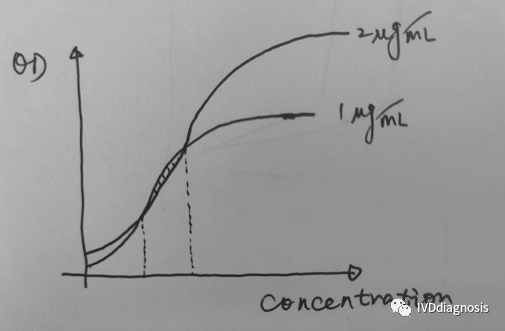
在某一段区间内,1ug/ml的反应强度是要高于2ug/ml的,这是为什么呢?我怀疑最有可能的原因和空间位阻有关系。
低浓度包被在反应前期给了包被抗体和酶标抗体足够的反应空间,高浓度的包被带来的位阻反而不利于前期的反应,只是带来了后期足够的反应容量。其实,这一点同样适用于免疫层析平台。很多时候我们发现1mg/ml的包被浓度在某一段区间内,反应强度要高于2mg/ml的包被浓度,有的时候表现为灵敏度的提升,有的时候则在整个反应区间都是如此。有些人解释说抗体包被浓度高的话,部分结合不牢固,反应过程中被样本冲走了。其实我觉得,2mg/ml的包被浓度根本不算高,NC膜的蛋白结合量远不止于此,可能不同蛋白与NC膜的结合性能不同,但我只能说,这不是主要原因。并且,对于免疫层析,不知道大家有没有发现,有时候降低标记浓度,同样可以一定程度地提升灵敏度。这又是为什么呢?
图片解释了部分原因,也就是说达到一定的量后,抗体标记量过多其实对于灵敏度的提升并不会带来积极作用。这时候也许有人说,照你这么说抗体标记量越少越好喽,一个颗粒带一个抗体分子最高效率喽?理论上是这样子的,但是实际的标记过程不可能这么理想,再加上抗原抗体的反应也讲究一个碰撞概率,一个抗原跟带一分子抗体的颗粒和带两分子抗体的颗粒碰撞,概率上并不占优势。 实际上今天讲这几个点,并不是为了讲清楚什么,微观世界具体发生了什么我们也不清楚,研发人员主要还是要善于总结,勤于分析,乐于实践。
|  /3
/3 