为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,国家药监发布了《创新医疗器械特别审批程序(试行)》,2014年3月1日开始实施。符合下列情形的医疗器械审查,可以走该程序(现行法规):(一)申请人的专利授权公告日不超过5年;或者发明专利的申请已公开,有检索报告载明其新颖性和创造性;(二)产品基本定型;(三)产品主要工作原理/机理为国内首创,技术上处于国际领先水平,且具有显著的临床应用价值。创新医疗器械产品可以享有的利好:早期介入;专人负责;检测、体系核查、审评优先。 截止到2022.5.9号,共有42款IVD产品走到药监局器审中心公示阶段,共涉及37家公司,34家国内企业,3家境外企业,具体数据见表1。从2014年到2018年,到公示阶段的IVD产品逐年增多,到2018年12月1号正式版的《创新医疗器械特别审批程序》实施后,2019年全年没有IVD产品进入到公示阶段,2020和2021年也都只有2个产品进入到公示阶段,2022年快半年了,也才只有1个产品,具体数据见图1。走创新的IVD产品进入到公示阶段的变少,以笔者经历过的创新IVD经验来分析,可能有以下几个原因: 第一,2018年正式版的法规比2014年试行版的法规对于产品的入围要求更加严格:专利要求、工作原理/机理及临床应用价值等; 第二,从2019年开始,企业对产品的原则性/方向性等重大问题与审评老师沟通的途径增多,现在有国家局、有分中心,可以邮件、可以视频、也可以面谈,企业对于创新产品享有的早期专人介入依赖性降低; 第三,现行的新法规下,有些创新产品享有的优势变弱,早期的注册检验优先,现在已经不存在注册检验了,第三方都是委托检验,技术沉淀好的企业已经在自检了。新法规下,体系核查的进度也很快,创新产品优势不明显。企业关注的审评优先(不排队,可以节省时间),很多满足创新的产品都满足优先审批的条件,若是企业想加快产品审评进度,同时可接受技术审评报告公开的话,完全可以走优先审批程序(笔者下一篇和大家分享的就是优先审评产品); 第四,专业的CRO公司介入,从已获证及进入临床试验产品的过程分析,绝大部分产品获证流程中都有CRO公司的协助,专业的CRO可以让产品更快的成功上市,有专业CRO公司助力,使企业对于创新产品享有便利的依耐性进一步削弱; 第五,技术审评报告的公开,加速同行追赶步伐,当今社会的信息交流速度极快,很多的IVD产品很难做到独一份,好的产品一旦进入到同行的视野中,同类型(或同应用场景)产品的出现就变的不可避免,非创新产品不公开技术审评报告,可以一定程度的延迟同行追逐,使其有更充裕的时间进行商业布局。上述分享仅为笔者根据自身经历对IVD产品申报创新数量减少的猜想,仅供参考。


公示的42款产品中,有14款产品已经成功获证,技术审评报告也已公开,具体产品见表2。进行创新申报对于产品阶段而言,只需在产品基本定型(研发阶段)后的任一阶段申报即可,加上不同产品的临床试验难度不一样,这就使得不同的产品从公示到获证的时间不尽相同,最快的产品用时10个月(厦门艾德),最久的是北京中仪康卫63个月,这些产品的平均耗时26个月。其中57%的产品都是附条件上市,50%的产品需要在延续注册时提交上市后的临床数据,2款产品至少 10 家临床机构,5款产品至少两家临床机构。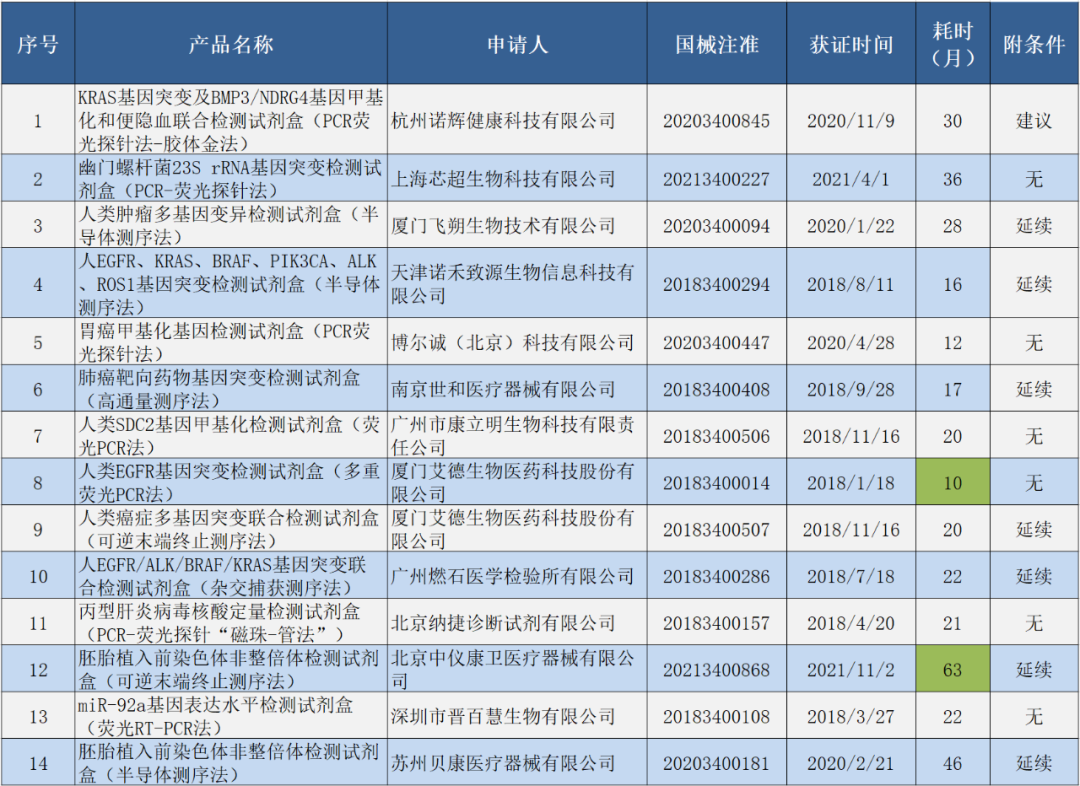
在已公示的42款产品中,还有28款产品未通过创新程序获证,具体数据见表3。笔者根据各大数据库的数据反馈,找到了部分“下落不明”的产品进展情况。有的是刚公示,还没有进行临床试验,获证还早;有的是刚刚进入临床试验(采用名称和遗传办数据库对比(遗传办数据截止时间为4.23),仅供参考);有的是可能没有继续走创新程序(公示期间有异议或其他因素),采用常规途径已经获证了(有时候获证产品申请人和产品创新公示申请人不是同一个,产品名称也有一定的变化),具体数据见表4。还有17款“下落不明”的产品,后续笔者将持续跟踪(下述进展情况仅为笔者根据数据库和自身经验判断)。 

表 3 已公示创新未获证IVD产品列表

表 4 部分已公示创新IVD产品进展情况
|
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 