从2月下旬开始,新冠肺炎疫情在全球爆发,截至5月13日,美国确诊感染新冠肺炎病例已超百万例,西班牙、意大利及英国确诊感染人数均超过了20万例。海外市场对新冠病毒检测试剂盒需求极大,中国体外诊断试剂厂商纷纷出口各类检测试剂产品。
伴随新冠试剂的大量出口,各企业的检测试剂表现也受各方关注。值得肯定的是3月29日菲律宾卫生部发布公告,中国政府捐赠的华大基因核酸检测试剂盒和圣湘核酸检测试剂盒,经由菲律宾热带病研究所评估,其测试水平与世界卫生组织提供的试剂盒相当。西班牙《国家报》曾报道,西班牙多家医院采购了来自中国某公司的新冠病毒快速检测试剂,灵敏度仅有30%。由此可见,选择性能可靠稳定的检测试剂是非常重要的。
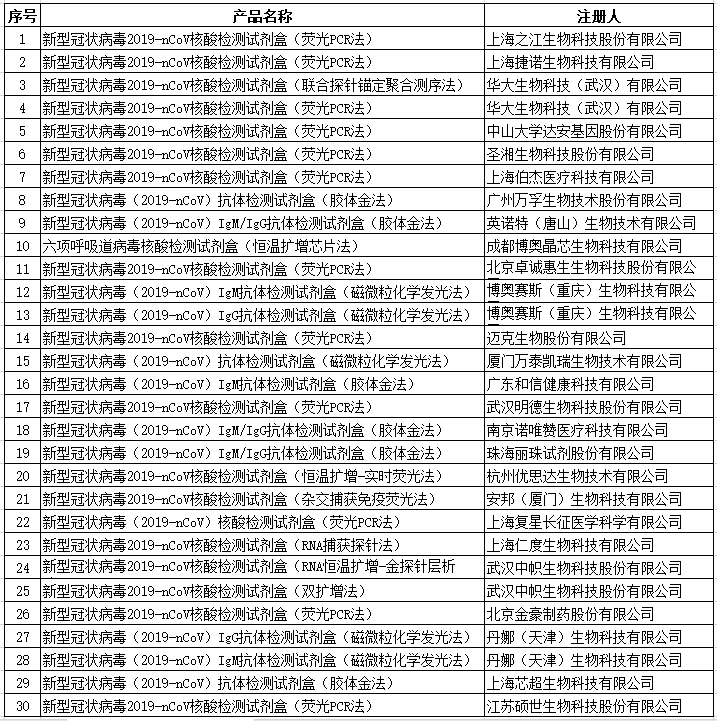
2020年年初,为抗击新冠疫情,国家药品监督管理局(后简称药监局)应急审批了7家企业的新冠核酸检测试剂。后续,国内外众多企业设计开放了新冠病毒核酸、抗体及抗原检测试剂,这些试剂在检测原理、试验方法及适用范围等方面都存在差异。
截至4月21日,药监局已经应急批准30个新型冠状病毒检测产品,其中新冠病毒核酸检测试剂19个,抗体检测试剂11个。
现在市场上应用的新冠核酸检测试剂多为实时荧光RT-PCR检测试剂。该试剂主要是通过实时荧光RT-PCR来检测新冠病毒RNA,利用PCR过程大量扩增目的片段,利用标记有荧光的特异性探针检测大量扩增的目的片段,然后利用获取的荧光信号来实时检测PCR产物,最终通过扩增曲线测定样品中的核酸。新冠核酸检测是直接检测新冠病毒的“身份证”——RNA,因此在国家的多版《新型冠状病毒肺炎诊疗方案》中也明确指出,核酸检测是新冠感染诊断的“金标准”。 病毒核酸检测不仅是新冠病毒感染确诊的重要手段,也适用于对一般人群的大规模普筛,能够真正实现早发现、早报告、早隔离、早治疗。
新冠病毒入侵人体后一段时间,人体免疫系统会产生特异性的抗体与病毒对抗,这特异性的抗体就是判断是否有新冠病毒入侵或者入侵过人体的“证据”。抗体检测方法是检测新冠肺炎患者血清或血浆中针对其N蛋白或S蛋白等产生的IgM或IgG抗体浓度值。
当前陆续上市的新冠病毒抗体检测产品,多用作新冠病毒核酸检测阴性疑似病例的补充检测指标或疑似病例诊断中与核酸检测协同使用,尚不能用作新型冠状病毒感染肺炎的确诊和排除依据,不适用于一般人群的筛查。需要强调的是,即便具备了快速、高效的优势,抗体检测依然不能取代核酸检测,只能作为辅助手段。
新冠病毒基因编码多个结构蛋白,如N蛋白、E蛋白和S蛋白等,这些蛋白包含相应的抗原表位,利用抗原与抗体特异性结合的源来,通过抗体检测抗原的存在,从而检测标本中是否含有新冠病毒。
3月26日新闻报道深圳市某公司出口的抗原检测试剂盒被指有质量问题,受到社会广泛关注。作为一种新发传染病的体外诊断试剂,新冠病毒检测试剂盒研发时间有限,尤其是抗原检测试剂盒研发尚未成熟。截止5月12号,国内尚无企业的抗原检测试剂获得国家药监局的医疗器械注册证。
中国:医疗器械注册,是指依照法定程序,对拟上市销售、使用的医疗器械的安全性、有效性进行系统评价,以决定是否同意其销售、使用的过程。医疗器械注册证是医疗器械产品的合法身份证。
欧盟:在欧盟市场,根据欧盟的《体外诊断医疗器械指令》规定,所有医疗器械,在欧盟成员国投放市场时须经过按要求作出EC合格声明的CE合格认证程序,并且产品加贴CE标志。据不完全统计,截止目前,国内已有超110余家体外诊断企业产品获得欧盟CE认证或准入。美国:在美国,获得紧急使用授权(EmergencyUse Authorization,EUA)的新冠检测试剂盒可以在美国商业化使用。而Pre-EUA意味着已被正式受理,后续还需要FDA的进一步反馈与认同,才能获批EUA。与此同时,截至目前全球有40余家企业或机构的新型冠状病毒检测产品获得了美国FDA的紧急使用授权。其中,我国有五家企业获美国FDA紧急使用授权。
核酸检测试剂“假阴性”问题,一直是防控中关注的焦点问题。国家卫生健康委临床检验中心为规范检测试剂标准,3月对市场上一批新冠检测试剂进行了集中测评。在对试剂的性能验证结果中,采用的一份2020010号样本的2019-nCoV浓度为128copies/mL,低于大部分试剂的检测下限,在收回的931份不同试剂检测回报结果中仅有6份检出,符合率仅为0.6%,其中2家为圣湘生物、2家为达安基因、2家为没有注册证的试剂。该样本的检出,反映试剂对较低浓度的样本也具备检出的能力,能很大程度上减少“假阴性”问题的发生。
同样在3月国家卫生健康委临床检验中心的试剂测评结果中发现,此次室间质评测评共收到844家实验室的有效结果,其中采用单试剂检测的实验室759家,采用两种或两种以上试剂检测的实验室85家,不同试剂检测结果共计931份。该931份回报结果中,823份为NMPA批准试剂。823份回报结果中,排名前3的体外诊断生产企业是圣湘生物、中山达安、上海之江。新冠肺炎病毒检测试剂盒为新兴产品,属于体外诊断产品,各国对体外诊断产品通常按医疗器械进行管理,因此政策要求不尽相同。选择符合出口国相应政策的、适用范围准确的、性能优良的且经过国内市场认可的产品才是保障试剂出口获得优良表现、免受质疑的唯一标准。
|  /3
/3 