登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
小胶质细胞——脑实质内唯一的免疫细胞。随着成像技术进步,人们对其认知从“静息状态”转变为“极度活跃的细胞”,特别是其舞动的分枝“貌似”在探测周围组织、监控神经元活动,使得小胶质细胞成为神经科学领域研究热点。本期咱们就来唠唠小胶质细胞~
Section.01 认识小胶质细胞
先来进行一波知识更新~
(已掌握,请略过)
[color=rgba(0, 0, 0, 0.9)]首先! [color=rgba(0, 0, 0, 0.9)]小胶质细胞并非仅存在于中枢神经系统

其次, 以往使用的一些广泛术语和命名, 或许需要被重新定义......
小胶质细胞: “静息”与“激活”20 世纪 70 年代中期,“静息”和“激活”小胶质细胞这两个术语首次出现在文献中,用于在形态学上描述在生理 ("静息") 和病理 ("激活") 条件下观察到的对银染有亲和力的细胞。这种命名法在 20 世纪 90 年代得到广泛使用。 然而,随着近些年双光子显微成像技术的发展,人们逐渐发现小胶质细胞始终活跃,不会因创伤、损伤、感染、疾病等挑战从“静息”转变为“活化”状态。相反,它持续活跃,会根据生命阶段、中枢神经系统区域、物种、性别及健康或疾病环境采取不同状态、执行不同功能 (图 1)。所以,尽管“静息”和“活化”小胶质细胞仍被广泛使用,科学家越来越多的成像数据对“激活”小胶质细胞概念提出质疑[2]。 图 1. 小胶质细胞的身份和状态[2]。 与血管周围间隙、脉络丛和软脑膜中的其他中枢神经系统相关巨噬细胞相比,小胶质细胞的身份在早期就由卵黄囊来源的祖细胞确定。一旦它们在脑实质中定植并分化,它们就可以根据特定的时空环境呈现多种状态。
小胶质细胞:M1 与 M221 世纪初,免疫学家根据体外模型的研究结果对巨噬细胞进行分类,并提出了另一个术语:“M1”,即经典激活,被认为具有促炎和神经毒性,与“激活”小胶质细胞的概念密切相关,而“M2”即替代激活,被认为具有抗炎和神经保护作用。这些术语在小胶质细胞研究中被广泛采用。 然而,很快发现巨噬细胞的反应比简单的“M1”和“M2”更复杂 (图 2)。就小胶质细胞而言,单细胞技术的出现提供了明确的证据,表明活体脑中的小胶质细胞不会极化为这两种类别中的任何一种,通常同时表达 M1 和 M2 标记物。可以从表观遗传学、转录组学、代谢组学和蛋白质组学数据等多个维度整合小胶质细胞的共存状态[2]。 图 2. 小胶质细胞命名法:过去和未来[2]。
尽管目前仍存在争议,但相信在不久的将来,终将对小胶质细胞的一些命名达成共识。 简单了解后,咱们言归正传:作为中枢神经系统的常驻免疫细胞,小胶质细胞是大脑健康的第一道防线!
大脑的“双面卫士” 免疫细胞是免疫系统的重要部分,分布于身体的各个组织器官。CNS 也不例外,小胶质细胞是中枢神经系统内固有的先天免疫细胞[3]。 看到这里,你是不是迫不及待想为小胶质细胞贴上“Good”标签? 的确,生理状态下的小胶质细胞在 CNS 发育、体内平衡和疾病中发挥着重要作用。它们能促进突触的发育和可塑性,通过持续监测、吞噬凋亡神经元或受损细胞碎片。小胶质细胞还可在受到刺激时触发免疫反应,来维持神经系统的健康和稳态 (图 3)。
图 3. 小胶质细胞的活化[4]。 调控小胶质细胞的信号可以被分为“启动”和“关闭”两种。启动信号指的是可以使小胶质细胞从静息状态转化为活化状态的信号分子,“关闭”信号是神经元释放的用来维系小胶质细胞静息状态的信号分子。 注:由于未有统一新命名,暂沿用以往术语。
病理状态下,小胶质细胞转为“激活状态”,释放 ROS 和促炎细胞因子等应激源引发炎症[4]。活化的小胶质细胞起初有益,但长期暴露于炎症介质可致神经元损伤和神经退行性变[5][6][7] 。如小胶质细胞对 AD 病理有反应,早期可能是保护性的,会迁移至 Aβ 或 tau 等病理性沉积物附近并吞噬清除。但长期受病理性沉积物刺激,保护性小胶质细胞可能转为功能障碍的小胶质细胞,加剧 AD 病情进展[8]。 近期研究显示,小胶质细胞耗竭可作为潜在治疗手段[9]。小胶质细胞消耗后会在受损中枢神经系统重新增殖,还能降低炎症反应、促进恢复,可作为了解其在神经退行性和神经炎症性疾病中功能的有效工具。
Section.02 小胶质细胞耗竭: CSF1Ri 往期小 M 已给大家介绍过不同的小胶质细胞清除技术,如利用毒素、CSF1R 药理性抑制剂 (CSF1Ri)、氯膦酸盐脂质体和构建遗传模型等,每种技术都有其自身的优势和局限性(详见 打开神经系统“黑匣子”----操纵小胶质细胞以探究大脑功能)。 其中,CSF1Ri (代表性化合物包括PLX3397 和 PLX5622) 凭借其独特优势,被广泛应用于生理或病理条件下小胶质细胞的耗竭[6]。 CSF1Ri 的优势 ? 高效快速且剂量依赖性地清除小胶质细胞,清除程度可通过剂量精准调控。 ? 安全性好,不引发严重的炎症反应或血脑屏障损伤,不影响行为及认知。 ? 有口服活性和血脑屏障穿透性,可长期维持小胶质细胞耗竭,便于深入研究其在神经发育、稳态及疾病中的作用。 CSF1Ri 清除小胶质细胞的原理是什么?是否可逆?PLX5622 和 PLX3397 区别是什么...... 别急别急,答完你的答你的,答完你的答她的,咱们接着看~
CSF1Ri 清除机制 CSF1R,集落刺激因子受体,是一种跨膜受体酪氨酸激酶,主要在中枢神经系统的小胶质细胞中表达。CSF1R 与其天然配体 CSF1 和 IL-34 的信号传导对于小胶质细胞的存活至关重要。 原理:无配体时,CSF1R 处于非活性状态,通过自我抑制维持活性。当一种配体与之结合,引发 CSF1R 同源二聚化、构象转变及近膜结构域 (JMD) 内酪氨酸残基磷酸化,解除自我抑制,使更多 ATP 进入。这促使更多酪氨酸残基磷酸化,使 CSF1R 完全激活,激活下游信号通路(如 PI3K/Akt、JNK、ERK1/2 和 JAK - STAT 信号通路),促进靶细胞(如巨噬细胞、小胶质细胞、单核细胞等)增殖、分化、存活与活化[5][10][11]。 CSF1Ri(如 PLX3397、PLX5622、BLZ945、JNJ-40346527、Ki20227 和 GW2580)能够阻断 CSF1R 受体的结构改变与自磷酸化,抑制信号传导,致使小胶质细胞丧失生存信号,进而逐步被清除。而且,停用这些抑制剂后,小胶质细胞会迅速重新增殖——也就是说,CSF1Ri 清除是可逆的。
图 4. PLX3397 和 PLX5622 与 CSF1R 的结合位点[12][13]。 A. PLX3397 和 PLX5622的化学结构式。B. CSF1R-PLX5622 复合物的 X 射线晶体结构。C. CSF1R-PLX3397 复合物的 X 射线晶体结构。结合位点表明,PLX3397 能够与近膜结构域 (JMD) 结合,而 PLX5622 能够稳定结合在被近膜结构域 (JMD) 排斥走后形成的 CSF1R 变构口袋中,且 PLX5622 上的 2-氟取代基伸入 CSF1R 特有的 Gly795 附近空间,而 Gly795 在 KIT 和 FLT3 对应位置为较大体积的半胱氨酸,从而导至空间排斥,影响整体结合稳定性,从而避免了对 KIT 和 FLT3 的非特异结合。
目前,PLX3397 和 PLX5622 在啮齿动物模型研究中的应用最为广泛,且已拓展至非人类灵长类动物。2019 年,PLX3397 获得美国 FDA 批准,用于腱鞘巨细胞瘤 (TGCT) 的治疗。PLX5622 作为 PLX3397 的结构类似物,具有更出色的血脑屏障穿透性和药代动力学特性[11]。
PLX5622 VS PLX3397 PLX3397 和 PLX5622 怎么用? 在已经发表的大量文献中,PLX3397 和 PLX5622 多通过饲料自由饮食的方式进行使用,如PLX5622 in AIN-76A Diet (1200 ppm), PLX3397 in AIN-76A Diet (290 ppm 或 600 ppm);且不会显著影响成年小鼠的行为或认知功能。表 1 展示了两种化合物的差异性[12][14]。
表 1. PLX5622 和 PLX3397 生化性质和细胞内的活性差异 (μM)[12]。 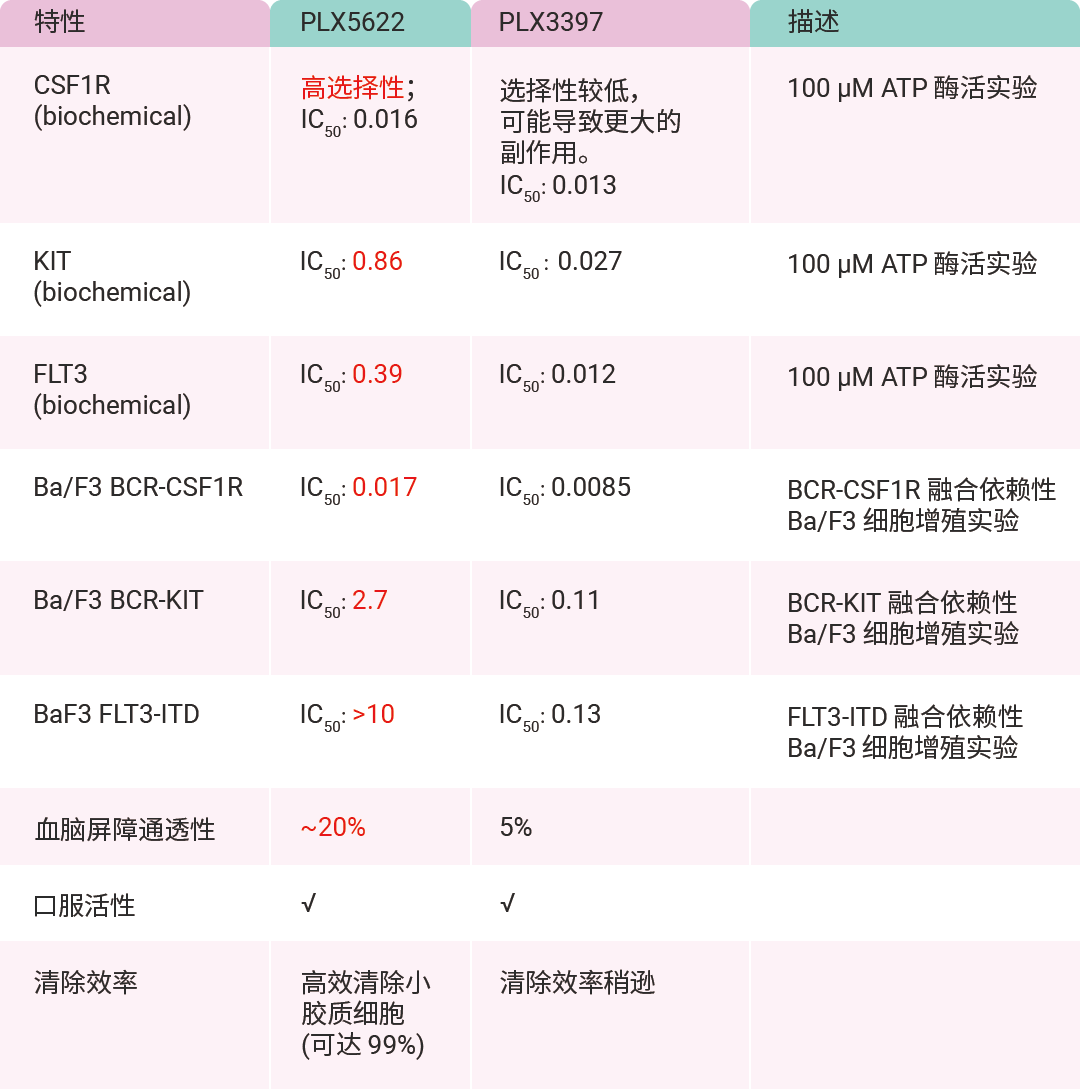
总体而言,相较于 PLX3397, PLX5622 对 CSF1R 的选择性更强,对 KIT 和 FLT3 的抑制活性也更弱。在 CSF1R 依赖性试验中,PLX5622 展现出与 PLX3397 相近的效力。然而,在 KIT 依赖性试验中,PLX5622 的效力比 PLX3397 低约 30 倍。 PLX5622 具备更优的药代动力学特性以及更高的血脑屏障通透性。它拥有较低的分子量、较高的亲脂性和良好的细胞通透性。
MCE 验证:PLX5622 MCE 可提供高纯度,高小胶质细胞清除效率,批次间稳定的 PLX5622,产品已经过 MCE 实验室专业的生物验证:7 天小胶质细胞清除率可达 87%, 14 天可达 90% (图 5)。 ? 实验动物:雄性 C57BL/6 小鼠 (11-12 周) ? 剂量:自由摄取含 1,200 ppm PLX5622 的 AIN-76A 饲料 7 天或 14 天 ? 检测指标:脑组织中 IBA1+ (小胶质细胞标志物) 细胞数目
图 5. MCE 实验室对 PLX5622 清除脑部小胶质细胞的效果验证。
MCE 还能够提供 SPF 级别饲料装 PLX5622 in AIN - 76A Diet (1200 ppm),并且赠送同等规格的空白对照饲料,同时提供辐照证明。 此外,MCE 产品更是获得了全球客户的认可!

Section.03 小胶质细胞:常见 FAQ Q1PLX5622 只清除脑部的小胶质细胞吗?对外周组织中其他巨噬细胞是否有影响?长期以来,小胶质细胞被认为是中枢神经系统 (CNS) 特有的巨噬细胞亚群,但 2025 年 4 月,李汉杰团队在 Cell 期刊上在线发表了题为 Peripheral nervous system microglia-like cells regulate neuronal soma size throughout evolution 的论文。研究发现人体胚胎的多个外周组织 (如皮肤、心脏和睾丸) 中存在大量“小胶质细胞” (命名为 PNS microglia),且 PLX5622 可显著减少 PNS 小胶质细胞样细胞。在 PLX5622 停止耗竭后,CNS 小胶质细胞和 PNS 小胶质细胞样细胞均可重新增殖[15]。 此外,也有文献表明 PLX5622 也可清除肺间质巨噬细胞 (lung interstitial macrophages),脾脏巨噬细胞和中枢神经系统内的巡逻单核细胞 (patrolling monocytes),并证实 PLX5622 通过消耗 MHCIIhi 间质肺巨噬细胞减轻了小鼠肺部真菌感染[16]。 另有研究表明 PLX5622 的抑制作用不仅限于小胶质细胞,还会影响肝脏中的外周巨噬细胞、血管周围巨噬细胞 (PVM)、骨髓、脾脏和血液中的髓系和淋巴细胞等[17][18]。
Q2PLX5622 做成饲料后保质期多久?由于饲料里面有较多的营养物质,时间过久,维生素和氨基酸会有损失,适口性和营养均衡性会受到影响,我们建议: 1. 计算好给药期间需要的饲料的量,每隔 1-2 天给小鼠更换新鲜饲料。 2. 袋中的空气尽可能排干净,并且密封,在 4°C 保存(不超过一个月),剩余的未开封的放在 -20°C 或者 -80°C保存 (6 个月以内)。
3. 更多注意事项可前往官网查阅。
Q3MCE 是否可以定制 PLX3397 饲料或其他饲料?
Q4除了 CSF1R 介导的信号通路以外,是否还存在其他影响小胶质细胞存活的通路和靶点?除了主要的 CSF1R 信号通路以外,小胶质细胞的存活还受其他多个信号通路调控。例如:TREM2 信号通路通过激活 Wnt/β-catenin 路径促进小胶质细胞的存活。 此外,多个表面受体与 PI3K-AKT 信号网络相关,如 CD14/MD-2-TLR4 复合体通过 MyD88 激活 PI3K,CX3CL1-CX3CR1 结合激活 G 蛋白并传递信号,这些通路均可调节小胶质细胞的增殖、分化、生存以及对神经炎症的反应 (图 6)[19][20]。 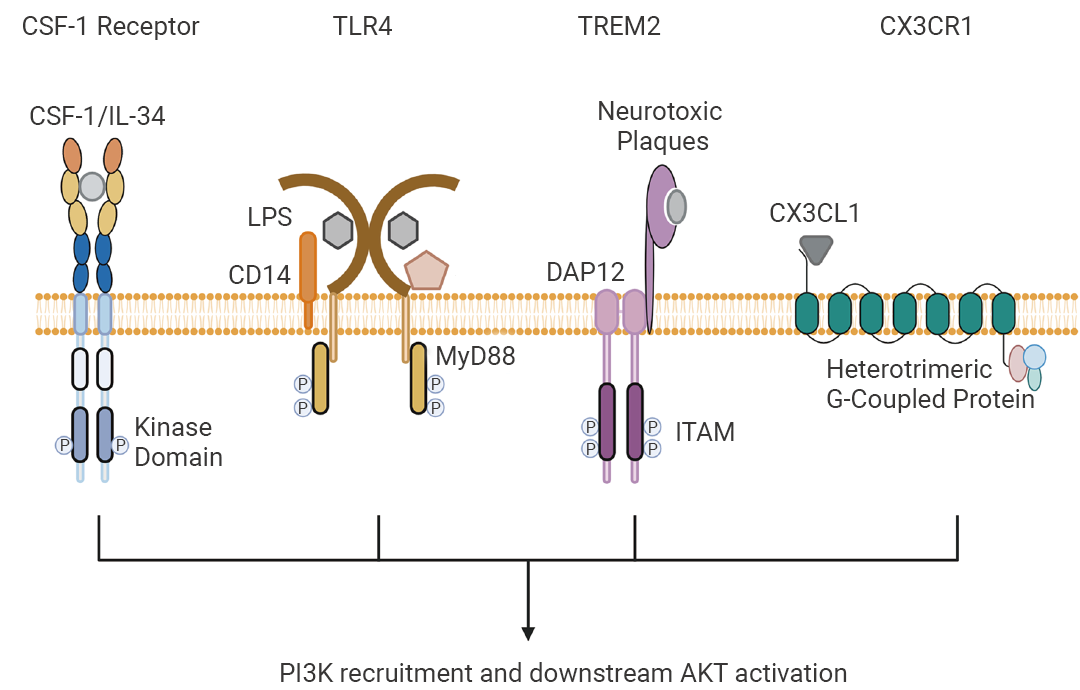 图 6. 小胶质细胞中利用 PI3K-AKT 信号传导的关键细胞表面受体[20]。
Section.04 小结 [color=rgba(0, 0, 0, 0.9)]本期,小 M 带领大家了解了小胶质细胞当前存在的术语分歧,介绍了小胶质细胞耗竭的常用方法—— CSF1Ri 清除,并对 PLX5622 进行了详细解析,此外还涵盖了常见的 FAQ。当然,若大家有 PLX5622 的购买需求,欢迎联系我们!
 [1] Wang Z, et al. An immune cell atlas reveals the dynamics of human macrophage specification during prenatal development. Cell. 2023 Sep 28;186(20):4454-4471.e19. [2] Paolicelli RC, et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 2022 Nov 2;110(21):3458-3483. [3] Angiulli F, et al. Blood-Based Biomarkers of Neuroinflammation in Alzheimer's Disease: A Central Role for Periphery? Diagnostics (Basel). 2021 Aug 24;11(9):1525. [4] LI Hui-Quan, et al. The multiple roles played by microglia. Chinese Bulletin of Life Sciences. 1004-0374(2014)06-0620-06. [5] Elmore MR, et al. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron. 2014 Apr 16;82(2):380-97. [6] Kim N Green, et al. To Kill a Microglia: A Case for CSF1R Inhibitors. Trends Immunol. 2020 Sep;41(9):771-784. [7] Sara Bachiller, et al. Microglia in Neurological Diseases: A Road Map to Brain-Disease Dependent-Inflammatory Response. Front Cell Neurosci. 2018 Dec 18;12:488. [8] Gao, C, et al. Microglia in neurodegenerative diseases: mechanism and potential therapeutic targets. Sig Transduct Target Ther 8, 359 (2023). [9] Tahmasebi F, et al. The Role of Microglial Depletion Approaches in Pathological Condition of CNS. Cell Mol Neurobiol. 2023 Aug;43(6):2459-2471. [10] Weyer MP, et al. Repurposing of pexidartinib for microglia depletion and renewal. Pharmacol Ther. 2024 Jan;253:108565. [11] Xiang C, et al. Targeting CSF-1R represents an effective strategy in modulating inflammatory diseases. Pharmacol Res. 2023 Jan;187:106566. [12] Spangenberg E, et al. Sustained microglial depletion with CSF1R inhibitor impairs parenchymal plaque development in an Alzheimer's disease model. Nat Commun. 2019 Aug 21;10(1):3758. [13] Tap WD, et al. Structure-Guided Blockade of CSF1R Kinase in Tenosynovial Giant-Cell Tumor. N Engl J Med. 2015 Jul 30;373(5):428-37. [14] Han J, et al. Inhibition of colony stimulating factor-1 receptor (CSF-1R) as a potential therapeutic strategy for neurodegenerative diseases: opportunities and challenges. Cell Mol Life Sci. 2022 Apr 2;79(4):219. [15] Wu Z, et al. Peripheral nervous system microglia-like cells regulate neuronal soma size throughout evolution. Cell. 2025 Apr 17;188(8):2159-2174.e15. [16] Mohamed SH, et al. CSF1R inhibition by PLX5622 reduces pulmonary fungal infection by depleting MHCIIhi interstitial lung macrophages. Mucosal Immunol. 2024 Dec;17(6):1256-1272. [17] Lei F, et al. CSF1R inhibition by a small-molecule inhibitor is not microglia specific; affecting hematopoiesis and the function of macrophages. Proc Natl Acad Sci U S A. 2020 Sep 22;117(38):23336-23338. [18] Vichaya EG, et al. Microglia depletion fails to abrogate inflammation-induced sickness in mice and rats. J Neuroinflammation. 2020 May 31;17(1):172. [19] Zheng H, et al. TREM2 Promotes Microglial Survival by Activating Wnt/β-Catenin Pathway. J Neurosci. 2017 Feb 15;37(7):1772-1784. [20] Chu E, et al. Dysregulated phosphoinositide 3-kinase signaling in microglia: shaping chronic neuroinflammation. J Neuroinflammation. 2021 Nov 27;18(1):276.  
|  /3
/3 