登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
一、项目基本情况 项目编号:TC250V0DQ 项目名称:高通量测序(二代测序)基因检测试剂 预算金额:7200.000000 万元(人民币) 最高限价(如有):7200.000000 万元(人民币) 采购需求:
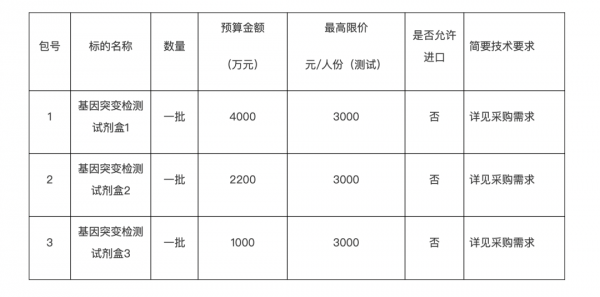
合同履行期限:自合同签订之日起至合同项下全部义务履行完毕 本项目( 不接受 )联合体投标。 本项目不专门面向中小企业预留采购份额。 二、申请人的资格要求: 本项目的特定资格要求:投标产品属于医疗器械的,投标人如为代理商,投标人应具有合法的医疗器械经营资格;投标人如为制造商,使用自身生产的产品投标时,投标人应具有合法的医疗器械生产资格。 三、技术要求: 第一包:基因突变检测试剂盒1★1.试剂盒适用癌种 投标人参与投标的试剂盒需是NMPA获批三类注册证的用于实体肿瘤组织样本非小细胞肺癌患者检测的NGS试剂盒产品,检测范围至少包含EGFR、ALK、KRAS、BRAF。投标人需提供加盖公章的NMPA获批产品注册证复印件。 ★2.试剂盒注册获批的检测机型 投标人参与投标的试剂盒其注册检测使用机型是Miseq DX。投标人需提供加盖公章的NMPA获批产品说明书复印件。 #3.投标人参与投标使用试剂盒的生产企业至少具备2个NMPA获批三类注册证的用于实体肿瘤组织样本非小细胞肺癌患者检测的NGS试剂盒产品。投标人需提供加盖公章的NMPA获批产品注册证复印件。 #4.投标人参与投标使用的NMPA获批三类注册证的试剂盒在目标区域平均测序深度在1000X以上,单碱基变异和插入缺失变异的稳定检出限应小于等于2%,融合变异的稳定检出限应小于等于2.5%。可以检测融合变异的所有亚型。投标人需提供加盖公章的NMPA获批产品说明书复印件。 #5.投标人使用的NMPA获批三类注册证的试剂盒可检测包含已知突变热点区域与未知区域在内的所有突变事件,并在DNA水平上定量检测突变与融合,提供丰度信息。投标人需提供加盖公章的NMPA获批产品说明书复印件。 #6.投标人使用的NMPA获批三类注册证的试剂盒对测序质量的要求Q30需达到85%及以上。投标人需提供加盖公章的NMPA获批产品说明书复印件。 #7.投标人使用的NMPA获批三类注册证的试剂盒可在DNA水平上一次性检出基因的不同变异类型,包括点突变、插入缺失、融合重排、可变剪切等突变类型。投标人需提供加盖公章的NMPA获批产品说明书复印件。 #8.投标人使用的NMPA获批三类注册证的试剂盒建库方法需采用为杂交捕获建库技术。 #9.投标人参与投标使用的试剂盒需要提供NMPA医疗器械技术审评中心官方公布的委托招标单位作为临床实验机构的【体外诊断试剂产品注册技术审评报告】复印件。 #10.投标人参与投标使用的NMPA获批三类注册证的试剂盒,其肿瘤组织样本DNA的投入量最低要求≤50ng。投标人需提供NMPA获批产品加盖公章的说明书复印件并做标明。 #11.投标人参与投标的试剂盒在使用时,每个样本上机所分配的数据量不得超过0.2G。投标人需提供NMPA获批产品加盖公章的说明书复印件并做标明。 #12.投标人参与投标使用试剂盒的生产企业需同时具备使用该试剂盒进行临床检验的资质与能力,不接受关联企业。投标人需提供加盖公章的医疗机构执业许可证复印件。 13.投标人参与投标使用的试剂盒需有NMPA获批的配套基因突变分析软件,投标人需提供加盖公章的获批软件证书及专利证书复印件。 14.投标的生产企业提供分析和报告分析软件1套:样本fastq数据量≤1G,系统≤2小时可完成分析到报告生成流程;样本fastq数据量≤4G,系统≤4小时可完成分析到报告生成流程;可并行处理≥12个样本,可完全本地化进行数据分析和报告生成;需安装二代测序中文自动分析系统,一键式操作,测序完自动分析报告生成,无需监管,可以直接打印中文版报告;带有基因改变信息和丰度以及对应的临床靶点药物,没有生物信息基础的技术员经过1-2周的培训也可以掌握报告数据分析操作;分析和报告系统要求能够本地完成所有过程;生成报告模板可以根据需求调整,如增加医院标志等,方便客户化定制。 15.投标的生产企业需具备GMP认证生产车间,符合体外诊断试剂盒生产要求。 第二包:基因突变检测试剂盒2★1、试剂盒已获得NMPA批准上市,可提供III类医疗器械注册证书或备案凭证(提供产品注册证或备案凭证); ★2、目标区域采用杂交捕获法(提供说明书) #3、测序方法学:可逆末端终止测序法(提供产品注册证及注册证附件说明书); #4、产品属于创新医疗器械(提供国家药品监督管理局医疗器械技术审评中心公示截图); #5、用途:用于定性检测非小细胞肺癌患者经福尔马林固定的石蜡包埋(FFPE)组织标本,至少可检测EGFR、ALK、ROS1、BRAF及HER2等基因的多种变异(提供产品注册证); #5.1、获批可检测基因数≥6个(提供产品注册证); 5.2、样本量要求:提取后DNA 总量不小于250ng,无需提取RNA(提供产品说明书); #5.3、伴随诊断药物:获批件随诊断药物≥4 种,至少包含ROS1融合,及奥希替尼用药指导(提供产品说明书); 5.4、可开放式检测ALK、ROS1 基因融合,包括EML4、KIF5B 在内的所有融合伴侣基因及所有突变亚型(提供产品说明书); 5.5、可开放式检测HER2 基因20 外显子插入突变,包括所有突变类型(提供产品说明书); #5.6、最低检出限满足:EGFR、BRAF、KRAS、HER2、ROS1 基因突变最低检测限≤1%,ALK基因融合最低检测限≤2.5%(提供产品说明书); 5.7、数据质控:Q30 碱基占比>75%,序列比对至参考基因组比例>90%,平均测序深度>700X; 6、产品检测全流程有证,包括核酸提取、纯化、上机测序等试剂,提供配套耗材注册证书; #7、投标产品具有适配生信分析软件,可用于EGFR、ALK、ROS1、BRAF及HER2等基因检测结果分析,提供相应软件注册证书; 第三包:基因突变检测试剂盒3★1.试剂获国家药品监督管理局III类注册审批,需提供产品注册证;★2.测序方法:采用可逆末端终止法测序,以注册证获批方法为准;3.检测试剂获批可用于:定性检测非小细胞肺癌(NSCLC)样本; #4.检测试剂获批可用于:定性检测结直肠癌(CRC)组织样本; #5.采用目标区域捕获建库方式。以注册说明书中的检测原理为准,需提供证明材料; #6.获批检测基因包括非小细胞肺癌相关核心基因:EGFR,KRAS,HER2,MET基因突变及ALK,ROS1,RET融合突变基因; #7.获批检测基因包含结直肠癌相关核心基因:KRAS NRAS PIK3CA,BRAF; 8.可检测≥4个EGFR ex20ins位点,以注册版说明书为佐证; #9.获批肺癌相关伴随诊断药物:有EGFR ex20ins伴随诊断药物,指导临床用药; 10.获批≥5个伴随诊断药物,需包含西妥昔单抗伴随诊断; 11.检测灵敏度:检测试剂盒可在DNA 水平上一次性检出包括点突变、插入缺失、融合(重排)等常见基因变异类型,有效测序深度≥500X能够稳定检测出样本中低至1%的基因突变;以注册版说明书为佐证; 12.质控要求:测序Q30≥75%;覆盖度≥98%,每个样品文库测序数据量不低于1 Gb。以注册版说明书为佐证; #13.试剂盒获得国家药监局创新医疗器械认证; 14.样本捕获探针优先采用DNA探针,适合处理降解或低质量的样本(如FFPE样本),便于检测未知区域的变异; 15.检测试剂盒配套分析软件获NMPA注册审批;可分析基因数量需≥检测试剂盒获批基因数; 16.获批分析软件获批适用癌种≥2个癌种; 17.具有专利建库技术,有效降低碱基错误率和捕获特异性,需提供专利证书等证明材料; 18.检测所需样本DNA最低投入量≥30ng,可用于检测保存年限18 个月内FFFE 样本;以注册版说明书为佐证;
|  /3
/3 