登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
你的基因还在玩"闪现"?慢病毒稳转株构建指南,让外源基因在细胞里安家落户,传 100 代也不丢!这把稳了
Section.01 为什么选慢病毒构建稳转株?
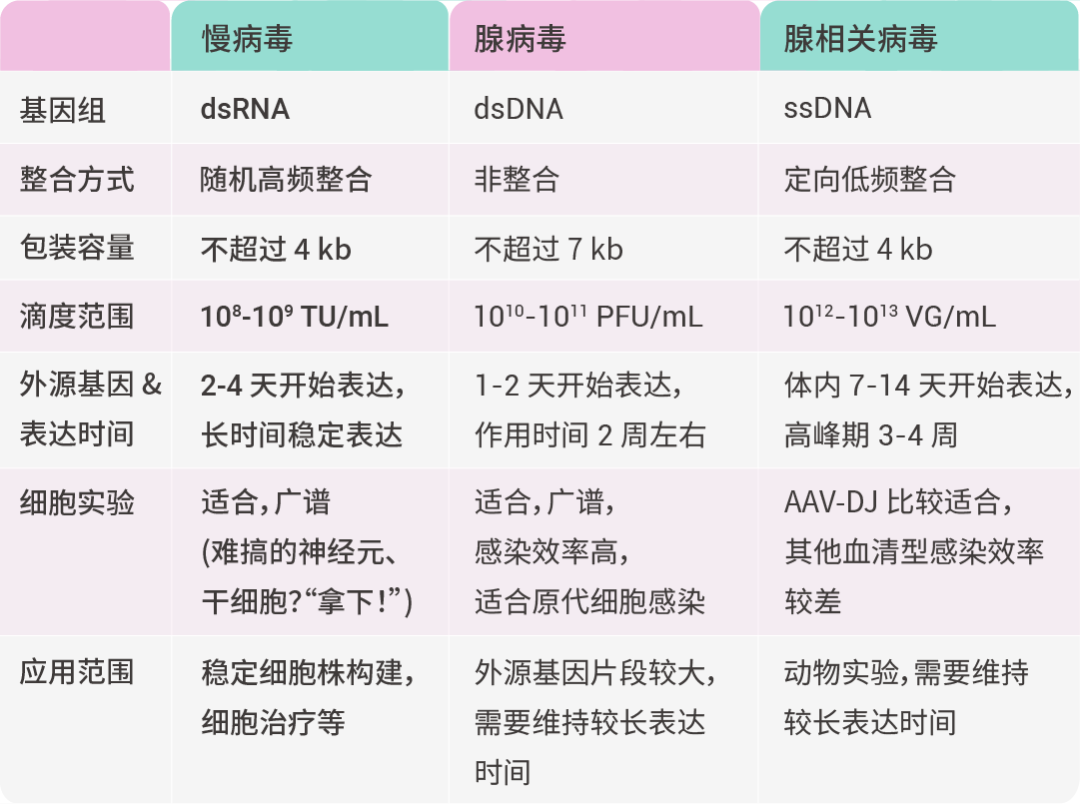
慢病毒 (Lentivirus) 载体是以人类免疫缺陷 1 型病毒 (HIV-1) 为基础开发的一种安全高效的基因治疗载体。它的“黑科技”在于:可将外源基因稳定整合到宿主细胞基因组,即使细胞分裂传代,也不会丢失,从而实现目的基因的长效、稳定表达。正因如此,慢病毒载体是构建稳定表达细胞株的理想工具。 表 1. 病毒特点及适用范围——慢病毒高频整合绝技,碾压其他病毒类型
名词解释:
• TU/mL (Transducing Unit/mL):用于慢病毒,表示能有效感染细胞并表达外源基因的病毒颗粒数。
• PFU/mL (Plaque Forming Unit/mL):用于腺病毒,表示能形成感染斑块的病毒颗粒数。 • VG/mL (Viral Genomes/mL):用于腺相关病毒 (AAV),表示病毒基因组数浓度,包括有功能和没有功能的病毒颗粒,不完全代表感染活性。
Section.02 三步搞定! 慢病毒稳转株构建指南 Step 1:载体构建——设计“基因快递单”
图 1. 慢病毒载体示意图。
一、载体元件选对,后续筛选更轻松,事半功倍不是梦 二、明确实验目的,精准选载体 实验小妙招:
• 基因 > 4 kb,滴度可能暴跌 → 先做小试包装验证
• 抗性浓度过高,细胞团灭 → 务必预试浓度梯度! • 荧光标签淬灭,传代后信号消失 → 早冻存早平安 • 表位标签掩蔽,蛋白折叠藏标签 → 改用柔性接头 (G4S) ×3 Step 2:慢病毒包装及收集——病毒“爆产能” *以 10 cm 细胞培养皿为例。
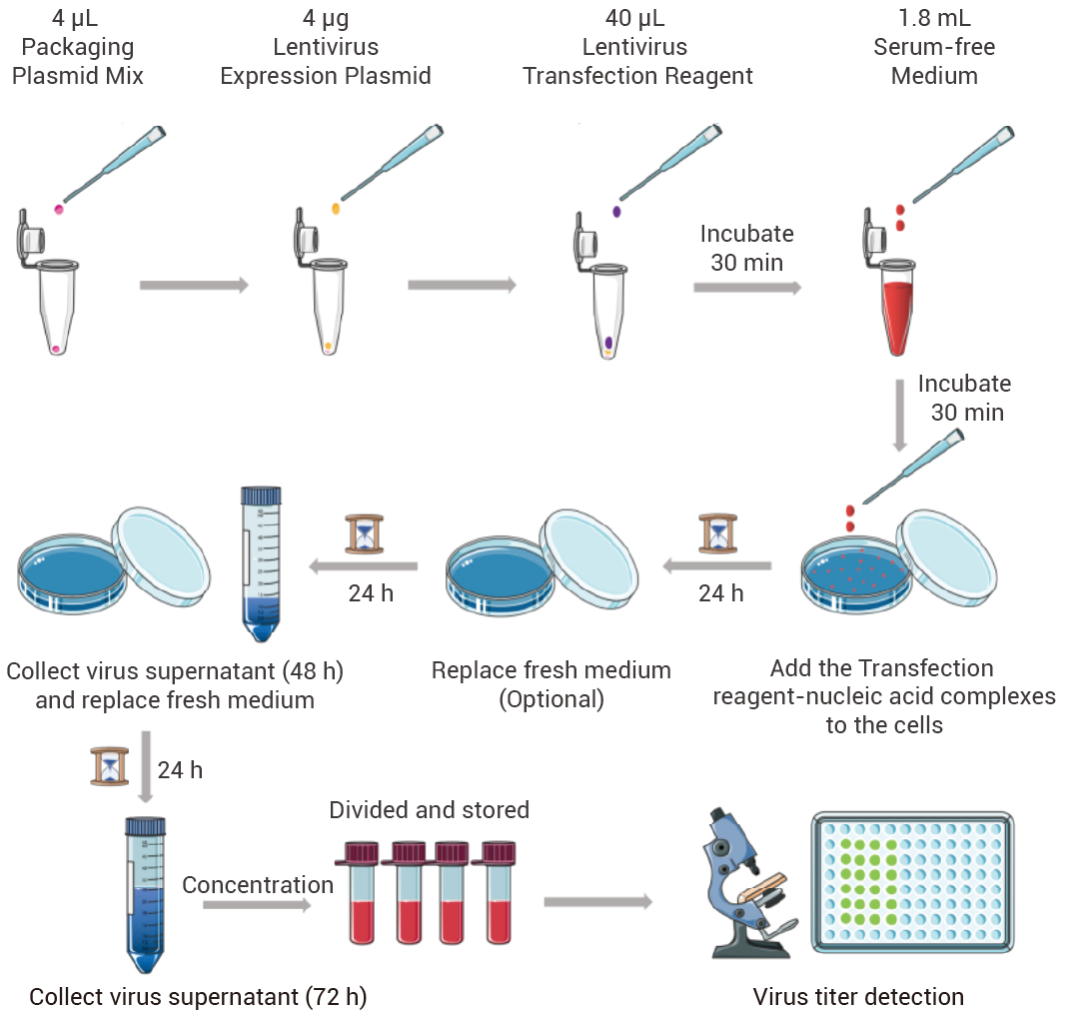 图 2. 慢病毒包装实验流程图。
一、准备待转染细胞 转染前一天,将 4-6 × 106 个细胞 (293、293T 等) 接种至 10 cm 细胞培养皿中培养,使其在包装时密度为 70%-80%。 注:为提高病毒包装效率,建议使用生长状态良好且生长处于指数期、存活率 > 90% 的细胞进行慢病毒包装。 二、慢病毒包装 (转染) 1. 取 4 μL 慢病毒包装辅助质粒混合物至 2 mL 离心管中,加入 4 μg 含有目的基因的慢病毒载体质粒,轻柔混匀,加入 40 μL MCE Lentivirus Transfection Reagent 与质粒混合,室温孵育 3 min。 注:通常情况下,转染复合物中 DNA (total μg) 与 MCE Lentivirus Transfection Reagent (μL) 的比例为 1:2.5。为提高转染效果,可在 1:1-1:5 范围内调整以优化转染效果。 2. 加入 1.8 mL 无血清基础培养基,轻柔混匀,室温孵育 30 min,即形成转染试剂-核酸复合物。 注:转染试剂—核酸复核物在室温下 4 h 内保持稳定。 3. 将转染试剂-核酸复合物 (1.8 mL) 逐滴均匀加入细胞中,轻柔混匀,置于 37°C 5% CO2 培养箱中培养。 注:注意在滴加时缓慢,避免将细胞冲起,需轻柔混合均匀。 三、收病毒 1. 转染 24 h 后,弃去初始病毒上清液,加入 10-15 mL 新鲜的完全培养基 (含血清),置于 37°C 5% CO2 培养箱中继续培养。 2. 转染 48 h 后,收集病毒上清液,再加入 10-15 mL 新鲜的完全培养基 (含血清),置于 37°C 5% CO2 培养箱中继续培养。 3. 转染 72 h 后,观察细胞状态并拍照,并收集病毒上清液,与 48 h 收集的上清液混合,800 × g 离心 10 min 以去除细胞碎片,使用 0.45 μm 滤器过滤,过滤后的上清液可直接感染目的细胞,或对其浓缩以获得更高滴度的慢病毒浓缩液。 注:冻融一次的病毒滴度将降低 10%-20%,慢病毒建议分装后保存于 -80°C,并于半年内使用,切忌反复冻融。 四、慢病毒滴度检测分析 使用梯度稀释法感染细胞,采用 PCR、qPCR 等方法测定病毒滴度。 Step 3:慢病毒感染靶细胞 以 Puromycin 抗性筛选为例 * MOI 值至关重要!不同细胞最佳 MOI 值不同,强烈建议预实验摸索。 MOI (Multiplicity of Infection):感染复数,即感染时病毒颗粒数与细胞数的比值。通常以达到约 80% 感染效率的 MOI 值为佳。
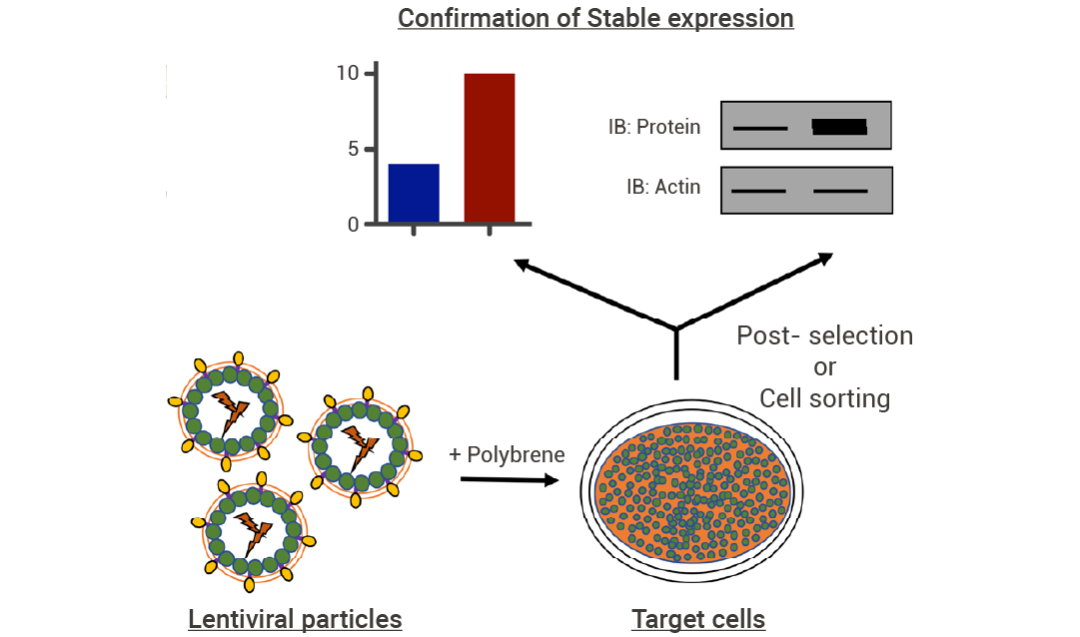 图 3. 慢病毒构建稳定细胞株流程示意图[1]。
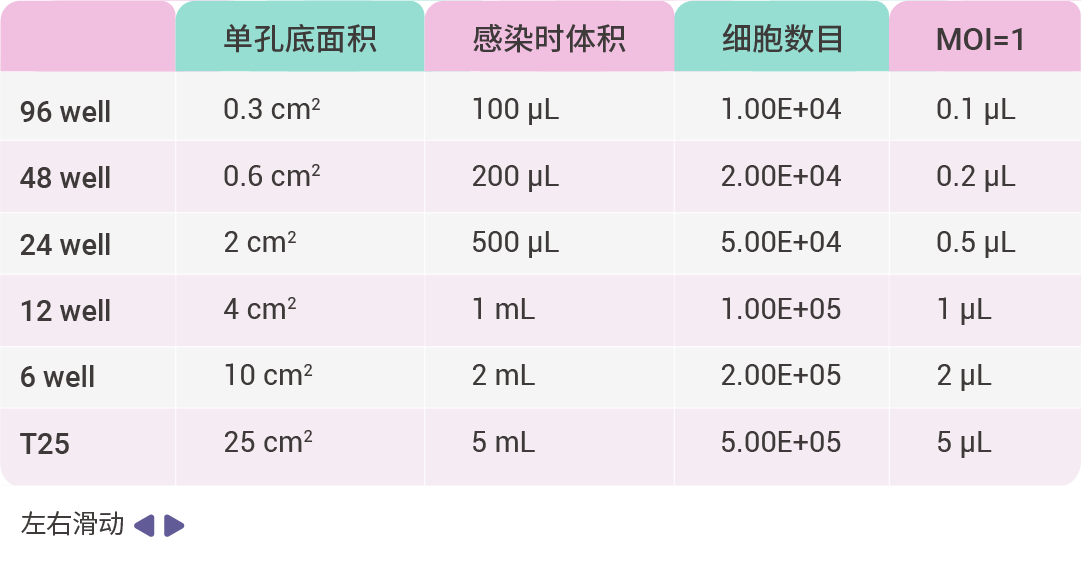
一、预实验:确定细胞最低致死浓度 (Puromycin Kill Curve) 1. 将培养好的靶细胞传至 24 孔板。 2. 配制 Puromycin 母液 (1 mg/mL),按下表定量加入 24 孔板细胞中。 3. 48 h 后细胞全部死亡的浓度即为靶细胞的 Puromycin 筛选浓度。 二、预实验:测定感染靶细胞的最佳 MOI 值 1. 接种细胞:实验前一天在 96 孔培养板中接种生长状态良好的细胞,每个孔内接种 0.5~1E+4 个靶细胞,铺板时的细胞融合率为 40% 左右,每孔培养基体积为 100 µL;进行病毒感染时细胞的融合度约为 70% 左右。 2. 稀释慢病毒:从 -80℃ 冰箱取出病毒,放冰上融化。取适量病毒原液,加 PBS 或无血清培养基稀释至 1E+8 TU/mL,剩余病毒 4℃ 保存。 3. 感染细胞:根据细胞数目、MOI 值以及病毒滴度,计算慢病毒感染细胞时所用病毒量,公式为:病毒加样量 (µL) = (MOI*细胞数目)/病毒滴度 × 1000。 下面以 MOI 值为 1、10、20、50、100,病毒滴度为 1E+8 TU/mL,计算病毒感染细胞所用病毒量,如表 2 所示。病毒准备好之后,从培养箱中拿出细胞,观察细胞状态,若细胞状态良好则加入计算好的病毒液,轻轻混匀。混匀后放于二氧化碳培养箱(37℃、5% CO2)孵育过夜。 表 2. 1E+8 TU/mL 病毒感染细胞所用培养基体积和病毒量参考
 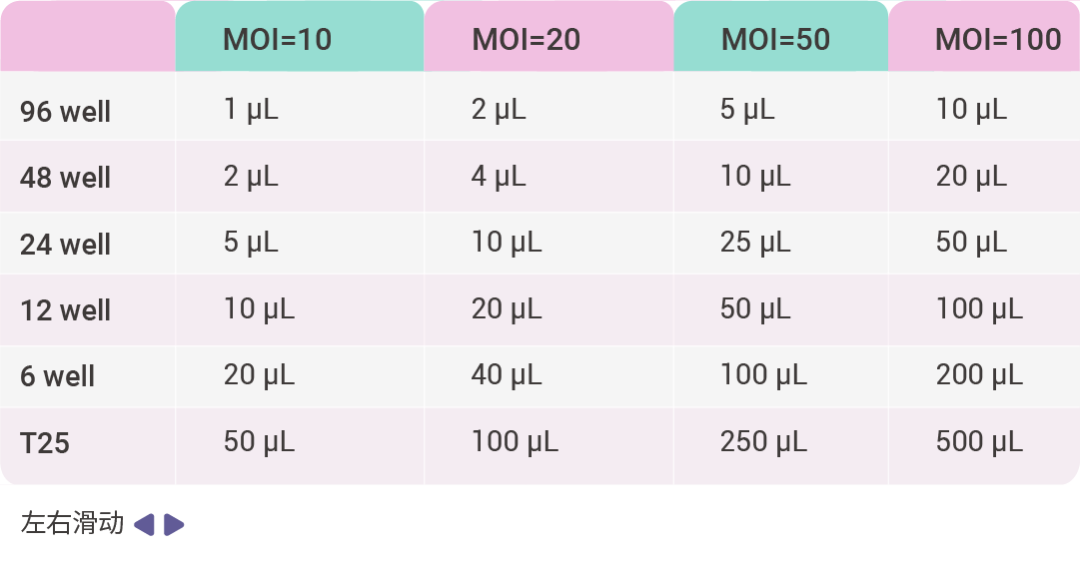 4. 感染 24~48 h 后,换新鲜培养液,并加入预实验 1 所测的 Puromycin 最低致死浓度筛选阳性细胞。培养 3~5 天,期间根据细胞生长状态及时更换新鲜培养液,显微镜下观察,选取细胞存活率较高且细胞状态较好的孔,对应为较适宜的 MOI 值。 三、正式实验:稳定株筛选 1. 按实际需要将细胞铺板,细胞数以第二天密度约 50% 为宜,37℃ 培养过夜。 2. 感染前,从 -80℃ 冰箱取出慢病毒,放冰上融化。加 PBS 或无血清培养基稀释至所需浓度,用枪吹打均匀。 3. 感染前给细胞换液,然后向每孔中均匀滴加稀释好的病毒液,轻轻摇匀,37℃ 培养过夜。 4. 感染 24 h 后,用 Trypsin 分离细胞并以低密度重新接种。接种 3 h 后,在培养基中添加 Puromycin 筛选阳性细胞。第二天换新鲜培养液,而后每隔一天进行一次细胞传代,维持 Puromycin 浓度。 5. 挑取由单细胞扩增形成的群落进行细胞扩增,并继续施加 Puromycin 进行维持性筛选培养。继续扩大培养。扩增完毕后 Western blot 或 PCR 或其他方式检测目的基因的表达。挑取鉴定结果较好的稳定细胞株,冻存保种。
Section.03 MCE 慢病毒包装服务
从精准的载体设计、高效的慢病毒包装,到优化的感染筛选方案,每一步都影响着最终稳转株的质量和实验成败。不想在复杂的流程中踩坑?渴望获得高滴度、高感染效率的病毒,收获稳定可靠的细胞株? MCE 提供专业的一站式慢病毒解决方案,为你的科研加速赋能,告别“昙花一现”,轻松拥有“基因永存”的稳转细胞株!
| 慢病毒转染试剂 (HY-K2015) 阳离子高分子聚合物转染试剂,显著提高慢病毒包装、转染效率。 | Polybrene (Hexadimethrine bromide) (HY-112735) 阳离子聚合物,常用于提高逆转录病毒载体介导的基因转移效率。 | 慢病毒溶解缓冲液 (HY-K1069) 可用于超速离心、PEG 沉淀或超滤浓缩后的慢病毒重悬。 | 嘌呤霉素无菌溶液 (HY-K1057) 从细菌链霉菌中分离的氨基糖苷类抗生素,可用于抗性筛选。 | 密度梯度培养基 (碘克沙醇) (HY-K3015) 无菌、控内毒的碘克沙醇水溶液,可用于体外分离生物颗粒。 | 支原体清除试剂 (BM-Cyclin) (HY-K1059) 有效抑制和清除在细胞培养中广泛存在的支原体污染。 |
 [1] Tandon N,et al. Generation of Stable Expression Mammalian Cell Lines Using Lentivirus. Bio Protoc. 2018 Nov 5;8(21):e3073.  
|  /3
/3 