金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
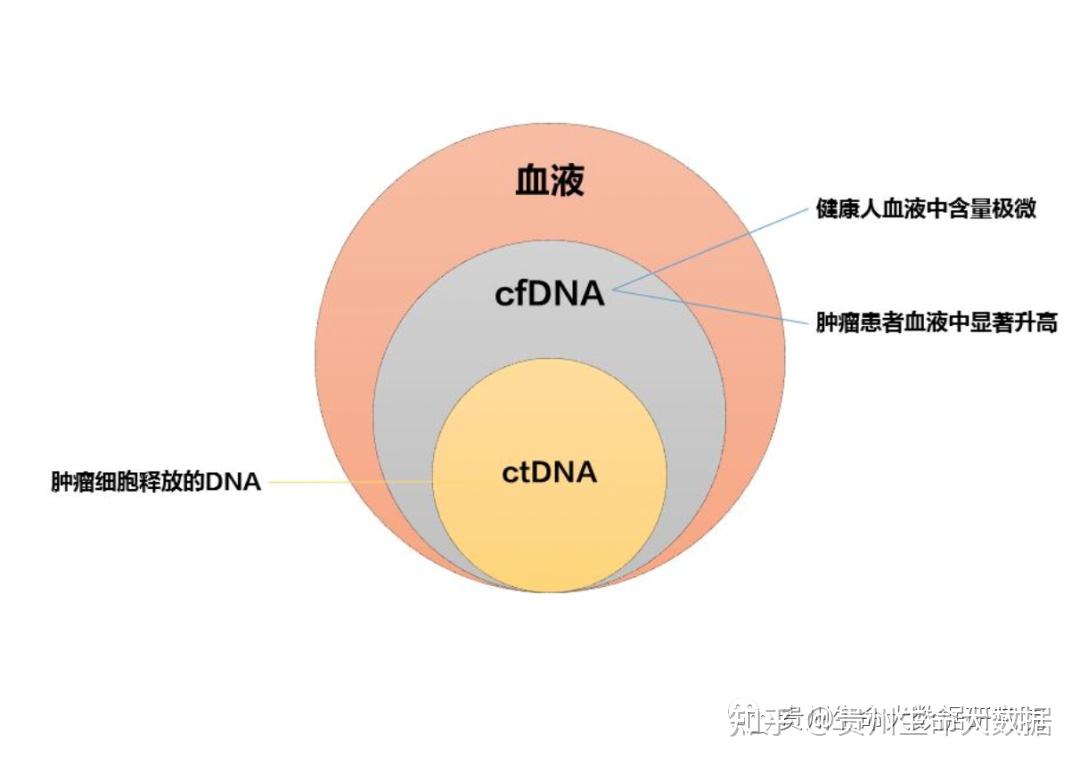
血液中游离的DNA简称cfDNA(circulating free DNA),是指循环血液中的核酸类物质。包括循环血液中细胞内的核酸,游离的内源性脱氧核糖核酸和外源性DNA与RNA,如真菌血症、细菌血症和病毒血症等病理情形下的血中外源核酸。血液中cfDNA在疾病的早期诊断、预后、监测等方面具有重要潜在价值。其具体医学应用大致包括以下三方面:
1、产前诊断
2、免疫性疾病等非肿瘤类疾病的病情分析与疗效观察
3、肿瘤相关分析
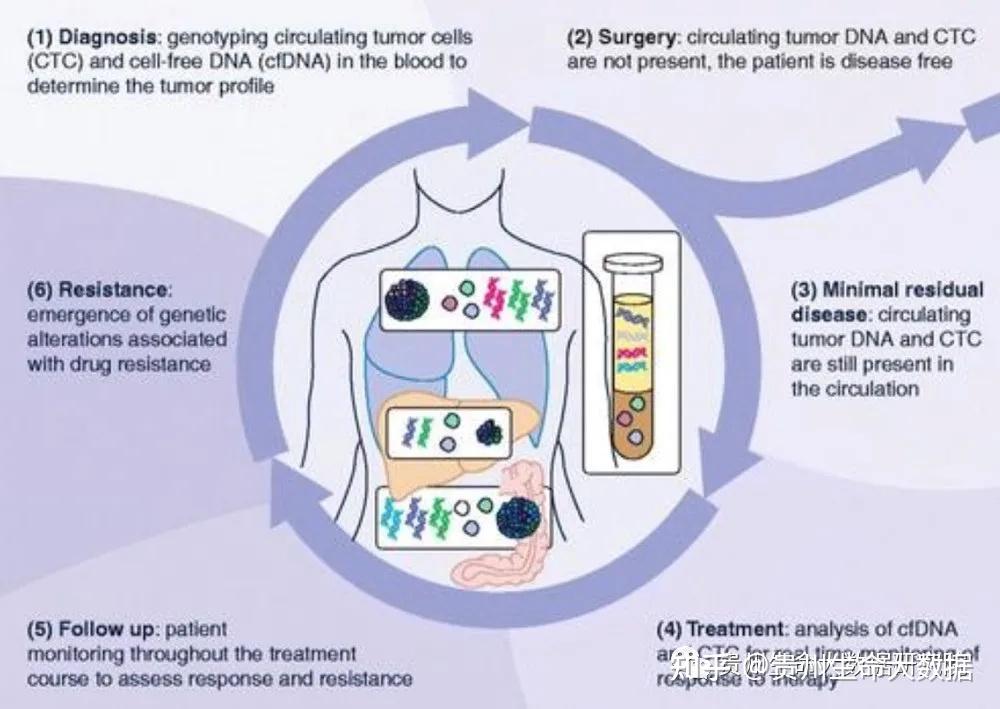
在上述三类应用中,其在肿瘤分析中的价值尤为重要,虽然目前血液中cfDNA分析尚未列为临床必需的检测指标,但大量的研究论文和大量一期和二期临床试验的数据,有力支持这一新技术在肿瘤防治中的巨大应用价值。下面我们来介绍一下cfDNA的一些相关知识。
01、cfDNA的来源
01、外源的DNA,如病毒、细菌、真菌、,饮食中含有的核酸;
02、坏死(适合手术、外伤、器官移植对机体影响的研究)
在细胞能量产生和再生功能丧失的时候发生的偶发性细胞死亡,这时细胞会细胞器膨胀,碎裂,染色质融合, 以及非特殊性消化。细胞坏死比细胞程序性死亡发生得快,但是由于它产生的DNA是大片段的(~10000 bp),程序性死亡的片段(~140-200bp),所以坏死的细胞更难从机体里面移除。
03、外伤和手术
血浆DNA水平与外伤或者手术的严重程度和并发症成正比,细胞的死亡会导致血浆DNA水平的升高。血清里面DNA的浓度与手术前后某些酶浓度显著相关。在外伤过程中上升的mtDNA水平并不是细胞坏死造成的,它在术后7小时内下降,但会在术后至少5天保持上升。
04、移植器官
在器官移植过程中的手术以及排斥现象都会造成细胞坏死。因此,cfDNA会和细胞坏死的相同。(原因是细胞坏死,通过检测片段大小来确定细胞死亡原因)
05、细胞凋亡
细胞凋亡或许是最常见的cfDNA产生的机制。但是由于机体对这种死亡机制的清除作用是很高效的,因此它产生的cfDNA的半周期很短(利于随时检测机体的情况)。细胞凋亡的吞噬是一个非免疫的,非发炎的过程伴随着中性粒的募集。如果凋亡的细胞没有通过吞噬作用被清除(由于吞噬作用的错误摄入或者过量的细胞死亡,那么就会一直有细胞成分泄漏到环境中,就会产生发炎,暴露自身抗体和耐受性的扰乱)。伴随着升高的免疫力(通过切割,蛋白的交联和重新定位),自身抗原的暴露程序性坏死会产生自我免疫。这些抗原会递呈给Tcell,然后开始一个免疫反应。这种自然免疫会取决于经历凋亡的细胞种类,哪一种细胞去吞噬它,以及到底相关抗原有没有被识别。健康(锻炼)的人群以及孕妇并没有发炎和自我免疫反应。说明细胞凋亡并不是癌症或者其他疾病的主要来源。而且特定的癌细胞可以抵制凋亡继续繁殖,并伴随着cfDNA的增加。
06、细胞焦亡
细胞焦亡是促炎的,依靠caspase1程序性死亡的,会导致炎症因子:IL-1b, IL-18的释放。过程也是迅速的。表现为细胞膜皱缩,细胞核完整,显著的细胞核浓度,细胞膜上形成孔,细胞体积增加,促炎因子的释放。细胞焦亡不会引起线粒体降解和释放细胞色素,因此不会产生mtDNA的释放。(结合细胞形态以及炎症因子以及长度可以区别凋亡,焦亡,坏死,以及无法及时被吞噬的凋亡细胞造成的cfDNA上升)
07、主动地被释放的DNA
活细胞(健康细胞,肿瘤细胞,病变细胞)会释放DNA到环境里,但是死细胞不会。被释放的DNA不一定是被包裹着释放的,而是和某种复合体一起释放的。
08、核酸的胞外囊泡(extracellular vesicles)运输(癌症以及癌症进程)
胞外囊泡分为外泌体(30-100nm)、凋亡小体(<4000nm)、蛋白聚合物(40-490 nm)、大脂质体(500-1000nm)以及微泡(MV)(100-1000 nm)。外泌体是细胞间交流作用的。不同来源的外泌体中会含有转座元件,单链DNA,基因组DNA,mtDNA。血清中的cfDNA来自于外泌体。且93%的血浆DNA积聚于外泌体中。(也就是说其实ctDNA是主动释放的,而不是因为细胞死亡造成的)。脂质体转运原癌基因和癌症相关的信息。原癌小体是由以及变成阿米巴虫表型的癌细胞分泌而来。癌细胞也会分泌外泌体,使得体液中的肿瘤DNA水平上升,促进癌症进程。分泌EVs也是耗能且受调控的。EVs的包含物受环境以及来源细胞的影响。
09、红细胞细胞核摘除
红细胞在成熟的过程中会去掉细胞核,在去掉细胞核的过程中释放cfDNA。
10、NETosis (适合癌症,外源感染的研究)
这种现象仅限于特定的造血细胞。是快速的,类似于爆炸似的过程。这个过程包含了细胞核的分裂,细胞死亡,导致NET,积累抵抗性相关的物质以及入侵的微生物。巨噬作用对于预防炎症,自我免疫,不可避免的组织损伤有着重要作用。这个清除的过程会导致核酸降解。但是核酸并没有被完全降解,最终流入体液中。被巨噬作用吞噬的NET(中性粒的胞外陷阱)紧接着会被脂多糖刺激,导致促炎因子IL-1B, IL-6,和癌症坏死因子(TNFa)的释放,表明了巨噬作用为感染或者受伤做的准备。因此,巨噬作用可以被当成cfDNA的来源。它也被视为参与进或者诱导cfDNA的释放,例如炎症。
02、 cfDNA 释放的原因
(1)从死细胞或者活细胞中由吞噬-介导DNA的释放。细胞凋亡,但是需要吞噬细胞清除凋亡细胞,然后吞噬细胞死亡后将DNA释放出来。
(2)自噬(适合癌症研究):细胞降解的清除:一般是清除细胞器,如果清除了核将会导致细胞死亡。线粒体的清除会释放mtDNA到血浆中。自噬作用与NETosis一样,早期抑制癌症,后期促进癌症。早期时会造成癌细胞的死亡。抑制自噬会增加癌症的风险。所以正常的自噬并不会直接导致cfDNA,但是在特殊的环境下也会导致cfDNA。
(3) 老化:90岁以上和年轻的人的总cfDNA,非甲基化cfDNA, RNase P-coding cfDNA 和Alu 重复的含量以及水平是不一样的。越高的cfDNA的总量和非甲基化cfDNA总量代表身体的力量越小,还代表意识损伤,下降的每日身体功能和灵活性。mtDNA的拷贝数只能代表身体机能上的衰弱。
(4)DNase的作用:在各种疾病以及癌症中,越低的cfDNA水平伴随着越高的DNase活性。但是不同来源的DNase会带来不同的清除以及释放效果。NET-在细菌,真菌,以及其他病原物中的抗性也是由DNase介导。胞外的核酸酶会导致NETs的DNA框架降解,最终释放到体液循环中。NET-抗性的病原体在病人感染中,会产生外源的和内源的cfDNA。
(5)脓毒症:超过800ng/ml cfDNA的脓毒症患者为重症患者。这部分患者的cfDNA一部分来源于宿主,另一部分来源于病菌的DNA,但是来自病菌的部分只有很少一部分。NET的形成会增加cfDNA的水平,特别是在NET-抗性的细菌侵入后。ROS也可以不依靠caspase激活中性粒细胞,导致NETs的释放。但是,也有报道cfDNA的升高并不一定是中性粒细胞的NETs导致的,而有可能是因为其他种类的细胞,因为体液中的H3组蛋白并没有增加。推测或许是因为坏死组织或者细胞凋亡。
(6)氧化压力:它参与很多疾病,心脏病,癌症,神经错乱,肥胖,关节炎, 老化,脓毒症。它会造成或者参与NETosis和细胞凋亡。最终造成cfDNA的释放。
(7)无菌发炎:没有细菌的条件下机体也会发炎:因为1)当细胞或是神经细胞收到刺激就会释放促炎因子。2)受伤流血时使用止血剂。3)细胞死亡。无菌发炎是一个机体自我保护的机制。它的目的是移除细胞残留物,可溶性的致伤物质,通过增加血流量和体液的释放以及招募巨噬细胞。发炎细胞所产生的物质还可以促进细胞分裂,和血液供应。NETs也会在发炎的过程中形成。
(8)锻炼:高强度的身体锻炼会导致白细胞的发炎反应,和oxidative stress。但是有研究报道说锻炼时产生的cfDNA是独立于白细胞氧化爆发,白细胞或者肌肉细胞凋亡的。说明不同形式的锻炼引发不同形式的cfDNA的释放。所以取血时候要注意患者的背景,不然会误判。
(9)癌症:癌症患者的cfDNA来源于癌症细胞和周围组织的细胞。细胞死亡是阻止癌细胞的,但是癌细胞会逃避这个过程。躲避死亡会增加cfDNA的含量。死亡也可能会促进癌症,可能是分泌MMP,生长因子,和细胞因子。
03、cfDNA的检测方法及目的
检测方法:
1、检测cfDNA片段大小
- 凝胶电泳,但是不能精确检测片段大小;
- qPCR, 但只能检测事先选定的位点,并不适合基因组范围的分析;
- 电镜, 但费时费力,效率低;
- 大规模测序平台;
2、cfDNA相关的分子检测
- Windowed protection score(片段大小测量工具=在基因组里面一个特殊的点内跨越120bp的DNA片段数量-有端点的片段的数量)。它和核小体距离有相关性。我们可以根据核小体的距离来推测cfDNA的来源。
- 甲基化检测:plasma DNA tissue mapping
检测目的:
1、检测cfDNA的大小可以知道它是由哪种细胞死亡机制产生的:~10000bp的cfDNA由细胞坏死产生;140-200bp的cfDNA由细胞凋亡产生;313-798bp的为孕妇cfDNA;
2、检测 cfDNA相关分子信号,比如甲基化,以及核小体距离可以追溯它的组织来源;
3、检测特定序列的cfDNA的种类数量的变化可以判断癌症,以及相关疾病。
参考文献:
[1]Aucamp, Janine, et al. "The diverse origins of circulating cell‐free DNA in the human body: a critical re‐evaluation of the literature." Biological Reviews 93.3 (2018): 1649-1683.
[2]Jiang, Peiyong, and YM Dennis Lo. "The long and short of circulating cell-free DNA and the ins and outs of molecular diagnostics." Trends in Genetics 32.6 (2016): 360-371.
原文地址:https://zhuanlan.zhihu.com/p/353155940 |
|
 /3
/3 