登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
脂质纳米颗粒,做药物递送的小伙伴一定不陌生!遥想当年,小 M 也是看着同门拿着仪器挤膜,做表征,来来回回……本期就给大家整理下关于脂质纳米颗粒那些事儿~ 01脂质纳米颗粒LIPID NANOPARTICLES脂质纳米颗粒 (Lipid Nanoparticle,LNP) 是一种脂质类物质组成的纳米粒子,具有均匀脂质核心,广泛用于小分子和核酸药物的递送 (详见往期:药物如何递送 ?脂质纳米颗粒!)。 LNP 通常由可电离阳离子脂质 (Ionizable lipids)、胆固醇、PEG 脂质 (PEGylated lipids)、结构脂质 (辅助脂质) 四个部分构成,一个典型的 LNP 包含多种组分以及包载内容 (Payload)。 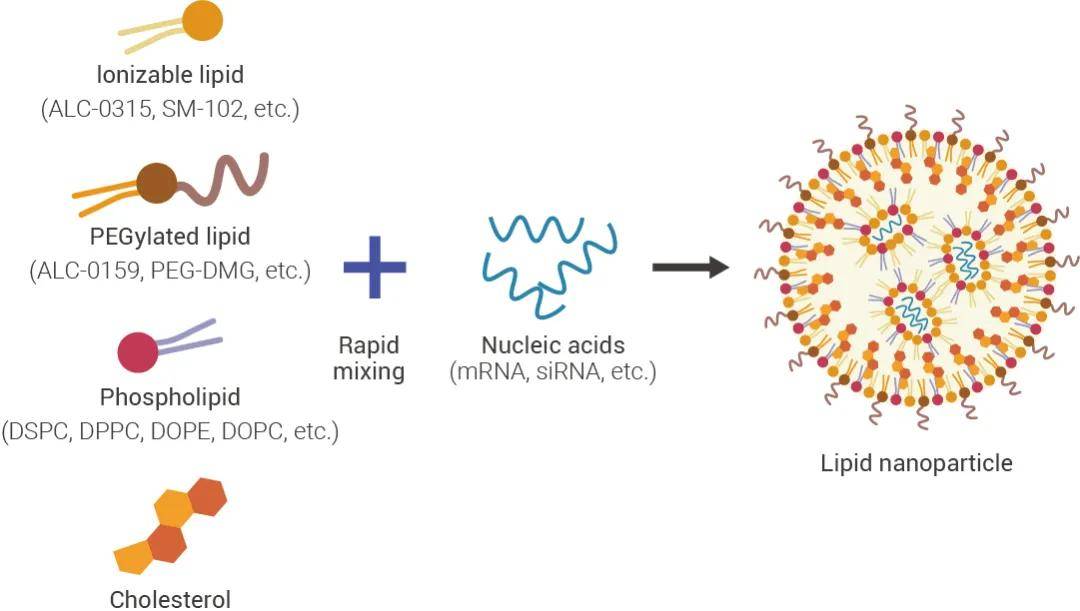 图 1. 脂质纳米颗粒基本组成[1]。 图 1. 脂质纳米颗粒基本组成[1]。 表 1. 脂质纳米颗粒组成、特点及应用[1-8]。 表 1. 脂质纳米颗粒组成、特点及应用[1-8]。脂质纳米颗粒递送系统的优势: • 低免疫原性、具有良好的生物相容性和安全性 • 稳定性强,在体内不易变形 • 核酸包封率高 • 细胞穿透性强、转染效率高 • 内体逃逸能力强 02如何制备?HOW TO PREPARE?脂质纳米颗粒 (LNP) 的制备依赖于自组装的能力,带负电荷的核酸和带正电荷的脂质之间产生静电络合,LNP 通过脂质组分之间的疏水作用和范德华作用相互生长。 LNP 的制备可以通过多种方式进行,例如脂质囊泡的挤出、脂质膜的再水化、纳米沉淀、微流体混合,一般的制备方式是将水和脂质成分快速混合。小 M 为大家整理了高分文献中常用的制备方案,大家可以根据自己的实验目的进行脂质搭配比例上的调整~ 具体操作 (供参考[9]) LNP 制剂的制备 • 天平称取 15 mg DLin-MC3-DMA (MC3),然后加入 200 μL 纯乙醇溶解 MC3,使其浓度达到 75 mg/mL; • 天平称取 10 mg DSPC,然后加入 1.0 mL 纯乙醇溶解,终浓度为 10 mg/mL; • 天平称取 10 mg 胆固醇,加入 1.0 mL 纯乙醇溶解,终浓度为 10 mg/mL; • 天平称取 10 mg DMG-PEG,然后加入 1.0 mL 纯乙醇溶解,终浓度为 10 mg/mL; • 将 13.3 μL DLin-MC3-DMA 溶液、24.6 μL DSPC 溶液、46.4 μL 胆固醇溶液和 11.7 μL DMG-PEG 溶液,充分混合得到澄清的混合溶液 I。混合溶液 I 每 μL 纯乙醇中含有 19 μg 的总脂质。 mRNA 包载物 mRNA 应溶解在 10 mM 柠檬酸盐缓冲液 (10 mM,pH 4) 中,将上述步骤中得到的脂质混合溶液与含有 mRNA 的水性缓冲液快速混合以实现 40/1 (总脂质/mRNA,wt/wt) 的最终重量比。 注:mRNA 比例可以增加以降低潜在的脂质毒性 mRNA –LNP 的制备 有三种常用的方法可以实现混合脂质溶液和 mRNA 溶液的快速混合:移液管混合法 (小规模制备)、涡旋混合法 (中等规模制备) 和微流体混合法 (大规模制备) 。 01 移液管混合法 (小规模制备) 1. 将 16.8 μL 上面得到的混合溶液 I 加入不含 RNA 酶的 1.5 mL 试管中; 2. 向试管中加入 1.2 μL 乙醇,充分混匀得到混合溶液 II; 3. 取另一个不含 RNA 酶的 1.5 mL 试管,加入 46 μL 柠檬酸缓冲液 (10 mM,pH 4),向试管中加入 8 μL mRNA (1.0 mg/mL),混合均匀; 4. 取 54 μL mRNA 缓冲液 加入步骤 2 中获得的混合溶液 II,立刻吹打混匀 20-30s (手动混匀); 注:水:乙醇的体积比为 3:1,混合后立即吹打混匀。否则可能影响 mRNA-LNP 混合物的活性。 5. 将步骤 4 得到的溶液在室温下孵育 15 min; 6. 使用透析管 (MWCO 3500) 在 1 x PBS 中透析上述溶液 1 h 以上,以除去乙醇和酸性缓冲液; 7. 透析后,将溶液转至不含 RNA 酶的 1.5 mL 试管中,测量体积; 8. 加入 1 x PBS 溶液,使总体积达到 800 μL。 注:这步得到的溶液可以在 4℃ 短期保存。 02 涡旋混合法 (中等规模制备) 1. 将 21 μL 上面得到的混合溶液 I 加入不含 RNA 酶的 1.5 mL 试管中; 2. 向试管中加入 9 μL 乙醇,充分混匀得到混合溶液 II; 3. 取另一个不含 RNA 酶的 1.5 mL 试管,加入 80 μL 柠檬酸盐缓冲液 (10 mM,pH 4),向试管中加入10 μL mRNA (1.0 mg/mL),混合均匀; 4. 将涡旋混合器设备设置为“ON”,速度水平设置为“1”; 5. 在涡旋混合器上以中速涡旋 mRNA 缓冲液,再移取 30 μL 混合溶液 II 快速加入涡旋溶液中,将所得混合溶液涡旋 20-30 S; 注:水:乙醇的体积比为 3:1,混合后立即吹打混匀。否则可能影响 mRNA-LNP 混合物的活 6. 将步骤 5 所得溶液在室温下孵育 15 min; 7. 使用透析管(MWCO 3500) 在 1 x PBS 中透析上述溶液 1 h 以上,以除去乙醇和酸性缓冲液; 8. 透析后,将溶液转至不含 RNA 酶的 1.5 mL 试管中,测量体积; 9. 加入 1 x PBS 溶液,使总体积达到 1000 μL。 注:这步得到的溶液可以在 4℃ 短期保存。 03 微流体混合法 (大规模制备) 具体操作方案使用仪器相关度很高,建议参考具体使用的仪器官网步骤进行。 03LNP 的表征Characterization of LNPs为了确保 LNP 的质量和有效性,需要对 LNP 进行参数表征,例如尺寸、PDI、电荷、RNA EE。 • Zeta (平均直径/粒径): 通过动态光散射 (DLS) 检测。 • PDI (Polydispersity index, 多分散指数) :范围 0-1,数值越高表示多分散性越强,数值越小表示粒度越均匀,通过动态光散射 (DLS) 检测。 • Charge (电荷):对于基于 RNA 的 LNP,通常优选近中性电荷,通过 ζ 电位分析仪测量。 • Morphology (形态):通过电子显微镜 (TEM、Cyro-EM、SEM、AFM 等) 检测。 • RNA EE (RNA Encapsulation Efficieney%, RNA 包封效率) :可通过 Ribogreen 测定来测量,先测定 LNP 外的 RNA 浓度,然后使用表面活性剂溶解 LNP 来测量 LNP 内部和外部的总 RNA 浓度,计算公式如下: 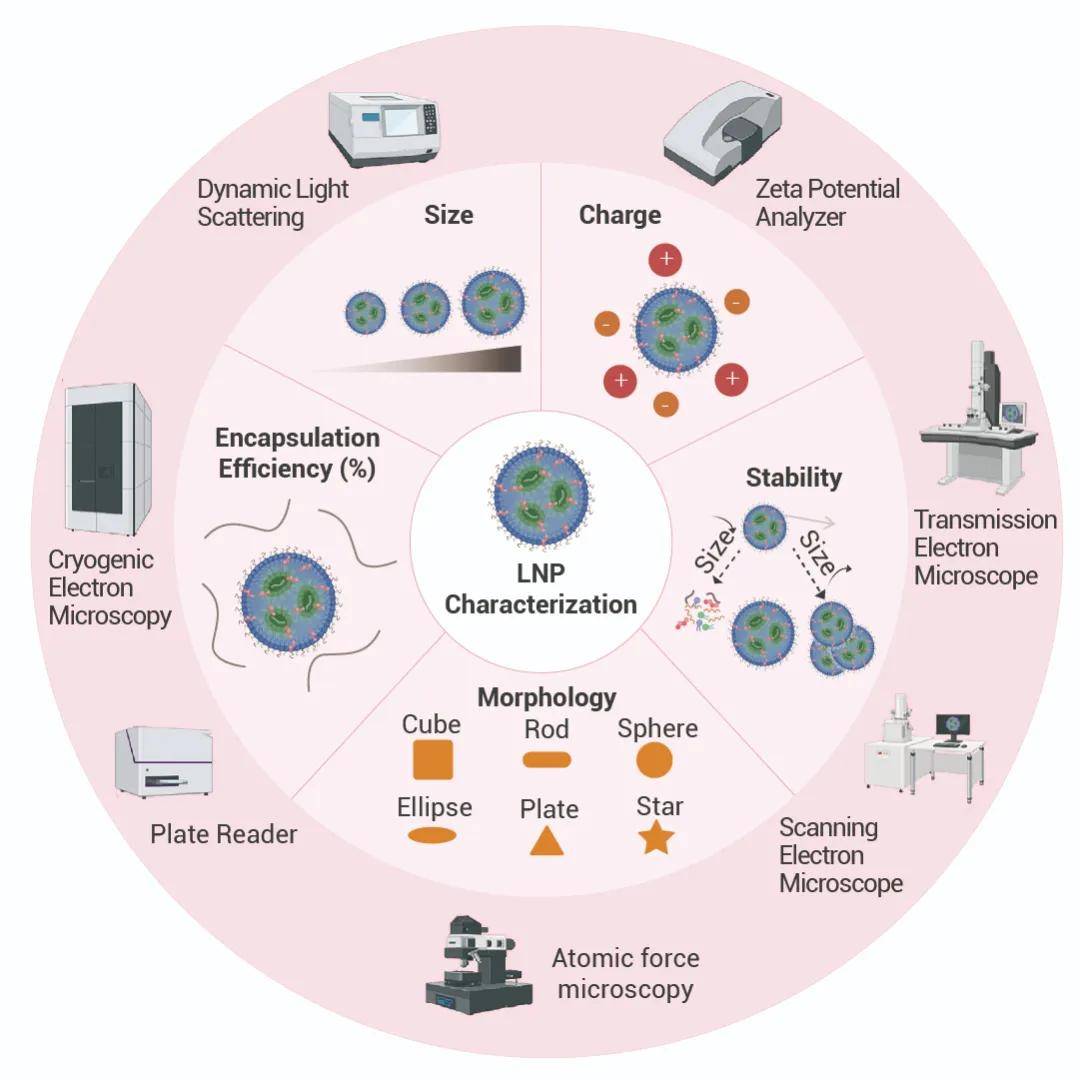 图 2. LNP 的表征参数与相关检测仪器[10]。 图 2. LNP 的表征参数与相关检测仪器[10]。LNP 是目前临床应用上最广泛的核酸药物递送载体,目前已有近 80 种基于 LNP 为递送载体的基因药物进入临床开发阶段,大大加速了基因治疗的发展[10]。但是,LNP 在实际应用中仍存在许多问题,其一是因为 LNP 在经过体循环后通常在肝部富集,对其他给药器官的靶向困难[11]。其二是 LNP 只能作为载体参与药物递送,无法协同 mRNA 治疗。 目前针对 LNP 体系的改良都和这两个方向有关。包括通过对 LNP 基本四组分的改造与优化增加 mRNA 递送效率并提高安全性,或者通过引入第五组分来改善肝外靶向递送[12]。 另外一种主流的优化方案是通过引入带修饰的脂质原料,对 LNP 表面改性实现精准靶向。例如上面提到过的,使用马来酰胺化 PEG 脂质,与蛋白\抗体相连接,实现靶向组织、器官或细胞。 后续我们会出一期推文整理不同的修饰基团在其中的作用,以及如何设计 LNP 感兴趣的老师可以继续关注~
参考文献: [1] Jung HN,et al. Lipid nanoparticles for delivery of RNA therapeutics: Current status and the role of in vivo imaging. Theranostics. 2022 Oct 24;12(17):7509-7531. [2] Vallazza B,et al. Recombinant messenger RNA technology and its application in cancer immunotherapy, transcript replacement therapies, pluripotent stem cell induction, and beyond. Wiley Interdiscip Rev RNA. 2015 Sep-Oct;6(5):471-99. [3] Kowalski PS,et al. Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery. Mol Ther. 2019 Apr 10;27(4):710-728. [4] Sebastiani F, et al.Apolipoprotein E Binding Drives Structural and Compositional Rearrangement of mRNA-Containing Lipid Nanoparticles. ACS Nano. 2021 Apr 27;15(4):6709-6722. [5] Reichmuth AM,et al. mRNA vaccine delivery using lipid nanoparticles. Ther Deliv. 2016;7(5):319-34. [6] Eygeris Y,et al. Chemistry of Lipid Nanoparticles for RNA Delivery. Acc Chem Res. 2022 Jan 4;55(1):2-12. [7] Knop K,et al. Poly(ethylene glycol) in drug delivery: pros and cons as well as potential alternatives. Angew Chem Int Ed Engl. 2010 Aug 23;49(36):6288-308. [8] Parhiz H,et al. PECAM-1 directed re-targeting of exogenous mRNA providing two orders of magnitude enhancement of vascular delivery and expression in lungs independent of apolipoprotein E-mediated uptake. J Control Release. 2018 Dec 10;291:106-115. [9] Wang X,et al. Preparation of selective organ-targeting (SORT) lipid nanoparticles (LNPs) using multiple technical methods for tissue-specific mRNA delivery. Nat Protoc. 2023 Jan;18(1):265-291. [10] Ma Y,et al. A perspective of lipid nanoparticles for RNA delivery. Exploration (Beijing). 2024 Apr 15;4(6):20230147. [11] Witzigmann D,et al. Lipid nanoparticle technology for therapeutic gene regulation in the liver. Adv Drug Deliv Rev. 2020;159:344-363.
|  /3
/3 