金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
目前缺乏有效评估肠癌MRD(minimal/measurable residual disease,微小/可测量残留病灶)水平的有效生物标物。根据2021 v2 NCCN指南,血液ctDNA被推荐用于“可切除结直肠癌的辅助化疗”患者MRD监测,希望能够提供预后信息,帮助II-III期肠癌患者的辅助化疗。此外,术后ctDNA也被认为是能够监测肠癌患者复发风险的标志物。
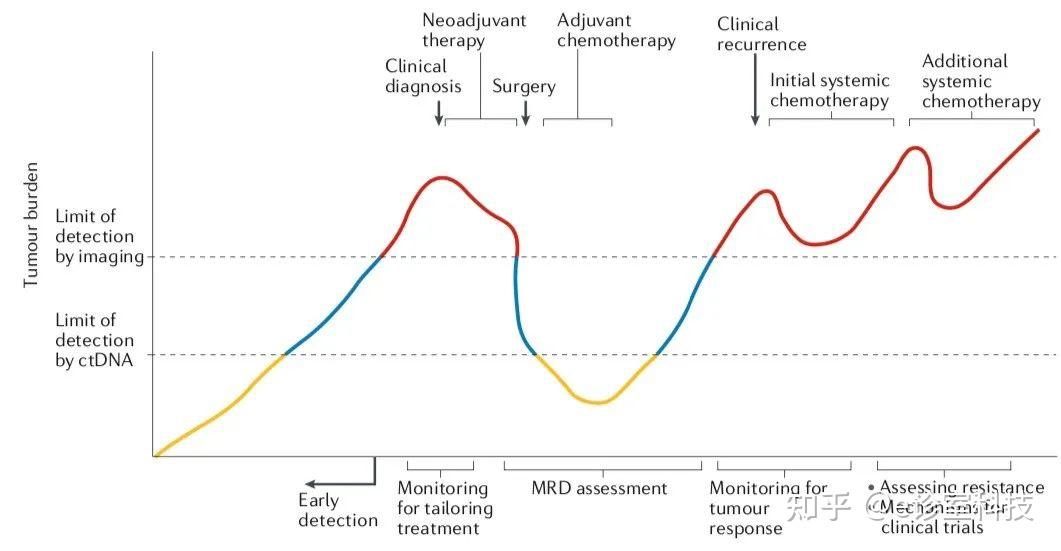
▲ ctDNA监测在肠癌中的应用场景
目前,大量的文章均证实,利用ctDNA进行肠癌MRD监测具有更高的灵敏度和特异性。根据马萨诸塞州总医院(MGH)的最新报道,他们开发出一种结合基因组和表观基因组癌症特征的纯血浆ctDNA分析方法以实现肿瘤MRD监测,相关的研究成果发表在《Clinical Cancer Research》。

背景
肠癌是全球发生率排名第三,癌症相关死亡第二的恶性肿瘤。对于较为早期肠癌患者,仅需要通过手术治疗,其中包含的部分高风险患者,术后需要辅助化疗延长患者生存。然而,除了根据肿瘤分期、临床标准和癌胚抗原(CEA)等进行危险分层外,目前还没有有效的临床工具来识别术后MRD。因此,利用更为敏感的指标来筛选出MRD阴性(低风险)患者,能够避免潜在的治疗毒性。
本研究中,研究人员开发了一种通过整合基因组和表观遗传学相关的癌症特征,可以在不依赖于肿瘤组织检测的情况下对肿瘤进行跟踪。因此,利用这种ctDNA检测技术能够提高临床应用。
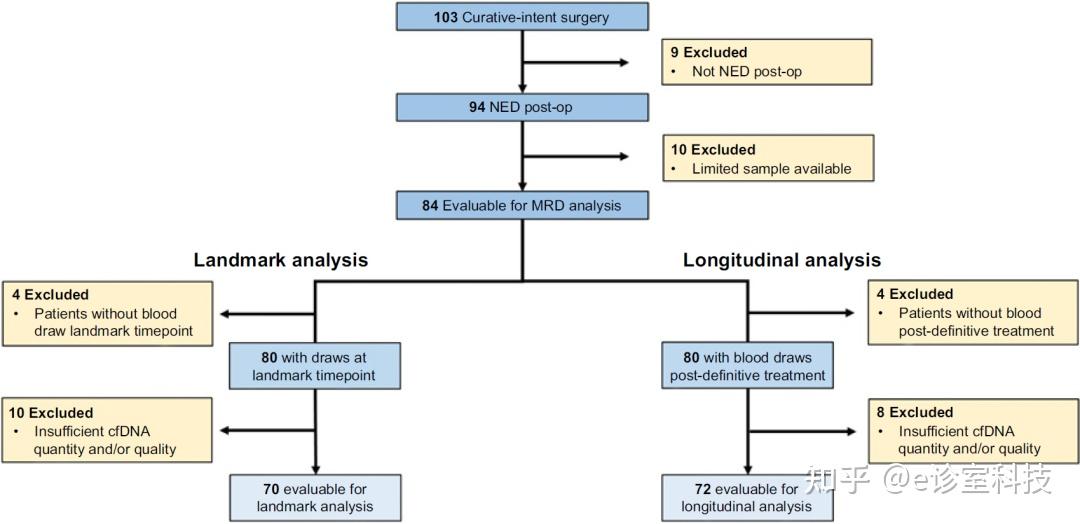
▲ 研究分析流程
研究结果
研究共纳入103例接受根治性手术的肠癌患者,其中 84例患者(包括接受手术后和辅助化疗完成的患者)在接受治疗后具有可评估的范围。研究结果显示,15例ctDNA阳性的患者最终都出现了复发;49 例ctDNA为阴性的患者,最终有12例出现了复发,敏感度与特异性分别达到55.6%和100%。
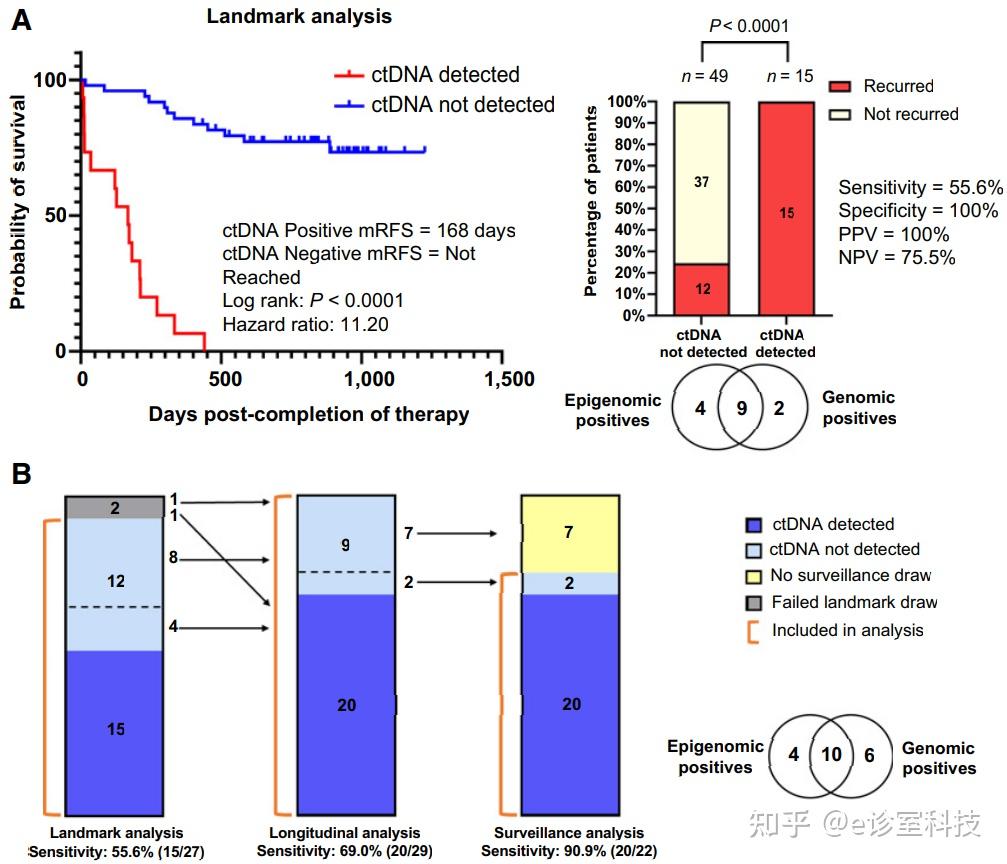
▲ ctDNA预测患者复发风险评估
此外,一项纳入2010例样本的研究数据证实ctDNA可作为预测III期肠癌预后有效标记物。

研究共纳入2010例患者,1017例患者被用于ctDNA分析,其中877例为ctDNA阴性,140例为ctDNA阳性患者,所有患者的中位随访时间为6.6年。
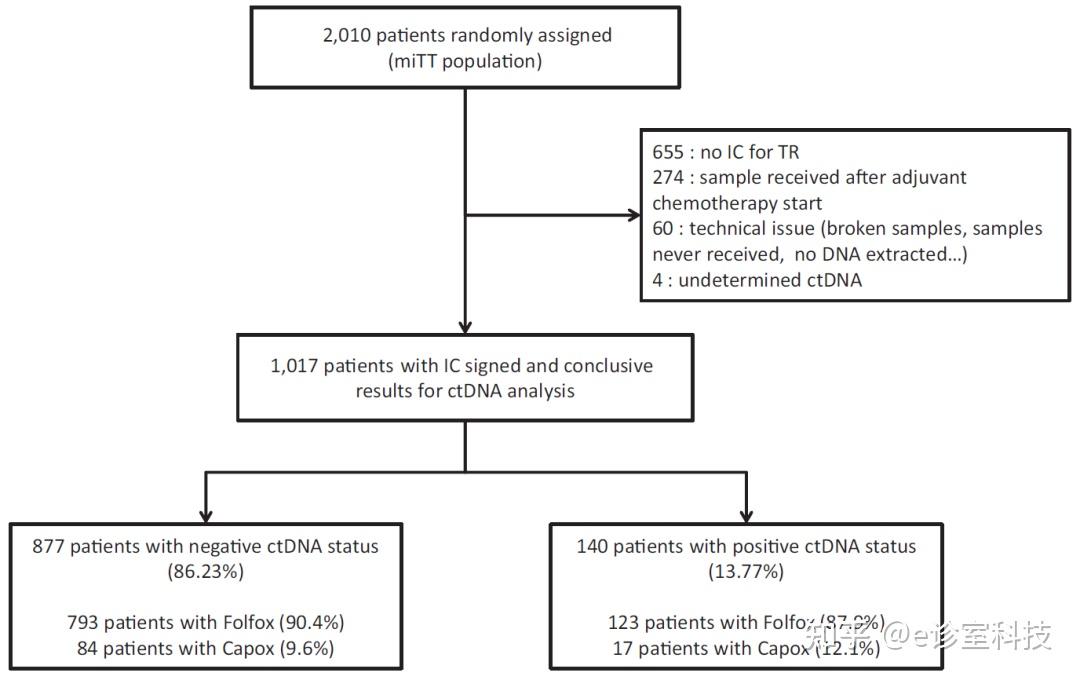
▲ 研究分析流程
研究结果显示,140例ctDNA阳性患者的3年无病生存(DFS)率为66.39%;877例ctDNA阴性患者的3年DFS率为76.71%(p = 0.015)。
研究证实ctDNA能够做预测患者DFS(HR 1.55,95% CI 1.13-2.12,p = 0.006)和总生存期OS(HR 1.65,95% CI 1.12-2.43,p = 0.011)独立的预后分子。
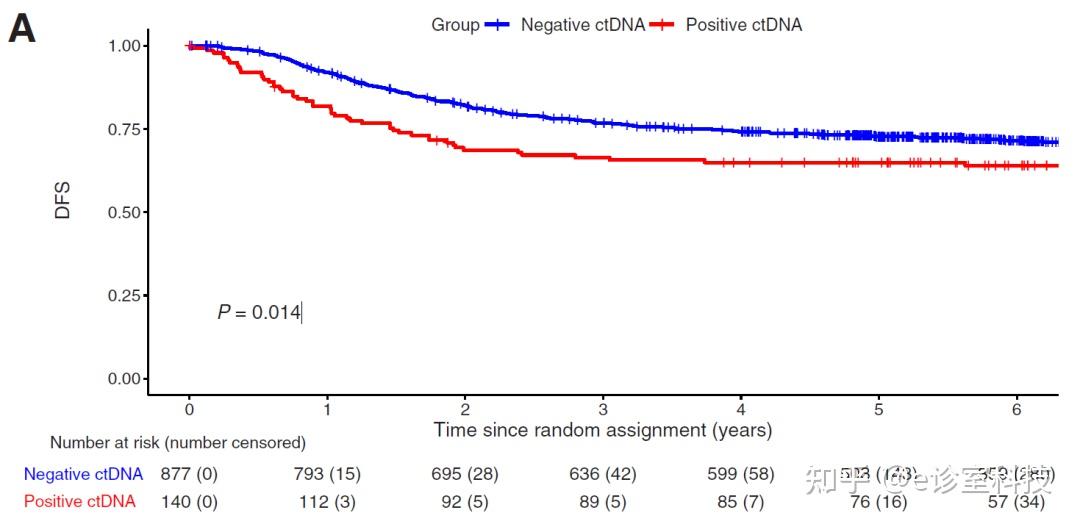
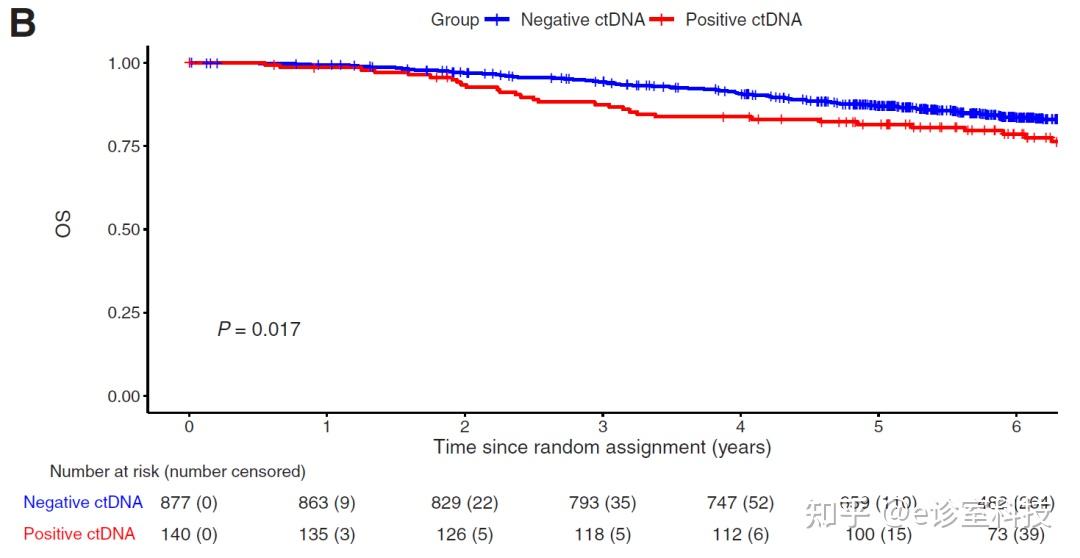
▲ DFS及OS分析
总结
ctDNA作为早期肠癌患者术后MRD监测,能够更加精确地预测患者复发,为早期肠癌患者提供临床获益。同时,对于中晚期肠癌患者,ctDNA能够预测患者的OS及DFS,这为临床医生制定治疗方案提供了有力的证据。
参考文献:
1. Grothey A, Sobrero AF, Shields AF, Yoshino T, Paul J, Taieb J, et al. Duration of adjuvant chemotherapy for stage III colon cancer. N Engl J Med 2018;378: 1177–88.
2. Tie J, Wang Y, Tomasetti C, Li L, Springer S, Kinde I, et al. Circulating tumor DNA analysis detects minimal residual disease and predicts recurrence in patients with stage II colon cancer. Sci Transl Med 2016;8:346ra92.
3. Tie J, Cohen JD, Lo SN, Wang Y, Li L, Christie M, et al. Prognostic significance of postsurgery circulating tumor DNA in nonmetastatic colorectal cancer: Indi- vidual patient pooled analysis of three cohort studies. Int J Cancer 2021;148: 1014–6.
4. Boeckx N, Op de Beeck K, Beyens M, Deschoolmeester V, Hermans C, De Clercq P, et al. Mutation and methylation analysis of circulating tumor DNA can be used for follow-up of metastatic colorectal cancer patients. Clin Colorectal Cancer 2018;17:e369–79.
5. Sorber L, Zwaenepoel K, Deschoolmeester V, Roeyen G, Lardon F, Rolfo C, et al. A Comparison of cell-free DNA isolation kits: isolation and quantification of cell-free DNA in plasma. J Mol Diagn 2017;19:162–16.
6. Almazi JG, Pockney P, Gedye C, Smith ND, Hondermarck H, Verrills NM, et al. Cell-free DNA blood collection tubes are appropriate for clinical proteomics: a demonstration in colorectal cancer. Proteomics Clin Appl 2018;12:e1700121.
声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。 |
|
 /3
/3 