金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
产品名称:25-羟基维生素D测定试剂盒(免疫荧光法)
标本类型:全血标本-EDTA K抗凝(参比与考核一致)
方案版本:V1.0
方案日期:20**年08月01日
试验时间:20**年09月至20**年10月
试验地点:******医院
产品注册申请人(盖章):******生物科技有限公司
注册申请联系人:***
注册申请联系人电话:22602207
报告版本:V1.1
报告日期:20**年10月18日
后文提到的相关统计,不用过于担心算法复杂,已整理成Excel计算模板,简单好用,相关使用见下面视频教程,你会复制、粘贴即可。
http://weixin.qq.com/r/shLy6vrEGadmrb6J90eg (二维码自动识别)
研究摘要
目的:评价******生物科技有限公司生产的25-羟基维生素D测定试剂盒(免疫荧光法)用于25-羟基维生素D检测时,其诊断检测能力与已上市的同类试剂盒无差异。
方法:本次临床试验采用同步盲法对比试验。
结果:******医院共检测112例受试者样本,按方案剔除标准共剔除样本0例,其中0例为线性范围外标本,0例为离群值标本,剔除率为0.00%,最终纳入分析112例,其中男性54例,女性58例,平均年龄43.46±27.77岁。
本次临床试验结果的Pearson相关系数接近1,说明两种试剂的相关关系越密切。回归方程的截距(a)的95%CI包括0,斜率(b)接近1,说明两种试剂的一致性比较好。根据说明书中对准确度允许偏差的标准,医学决定水平处偏倚均在允许偏差范围内。
考核试剂与参比试剂检测浓度的差值Bland-Altman散点图显示:两种试剂检测浓度差值为0.0377±1.1505ng/mL(均值±标准差),两种试剂检测浓度差值的均值±1.96SD范围在-2.2173ng/mL到2.2927ng/mL之间。超出置信区间的百分比为:3.57%。
考核试剂与参比试剂检测浓度比值的Bland-Altman散点图显示:两种试剂检测浓度比值为1.0001±0.0264(均值±标准差),两种试剂检测浓度比值的均值±1.96SD范围在0.9483到1.0519之间。超出置信区间的百分比为:0.00%。
经计算,考核试剂定性检测结果参考范围外标本符合率为93.94%(90.18%,96.32%),参考范围内标本符合率为100.00%(98.43%,100.00%),总符合率为98.21%(95.63%,99.28%)。进行Kappa一致性分析,Kappa值k=0.9563。对含干扰物质样本的检测,考核试剂和参比试剂检测结果无差异,表明考核试剂和参比试剂的抗干扰性能有较好的一致性。
结论:本中心在本次临床试验共检测112例有效样本,通过对考核试剂和参比试剂检测浓度的Pearson相关系数、回归方程、Bland-Altman图进行分析,显示两种试剂检测全血25-羟基维生素D浓度有良好的一致性。符合率及Kappa一致性分析显示考核试剂与参比试剂对结果的判断有良好的一致性。
备注:国家药监局关于发布免于临床试验的体外诊断试剂临床评价技术指导原则的通告(2021年第74号)新法规颁布后,要求有变化,参考时请结合相关要求。
一、基本内容
1.1引言
1.1.1临床试验背景
25-羟基维生素D是维生素D在体内的主要存在形式。维生素D为类固醇衍生物,属于脂溶性维生素。维生素D主要由人体皮肤经紫外线照射后合成。少部分从食物或补品中摄入。维生素D不仅仅影响钙磷代谢,而且具有广泛的生理作用,是维持人体健康、细胞生长和发育的必不可少的物质,与多种疾病密切相关。血液中25-羟基维生素D的高低可以反映人体维生素D的储存水平,并且与维生素D缺乏的临床症状是相关的。
由于25-羟基维生素D是人体内维生素D的主要储存形式,因此,通过检测25-羟基维生素D可以确定总体维生素D的情况。25-羟基维生素D检测的临床应用主要与佝偻病(儿童),骨软化症、绝经后骨质疏松和肾性骨病的诊断、治疗和监测有关。维生素D缺乏还和许多其他的疾病、自身免疫性疾病、糖尿病和抑郁症。测定25-羟基维生素D可应用于:(1)监测骨相关疾病例如佝偻病(儿童)、骨软化症、绝经后骨质疏松症和肾性骨病或非骨相关疾病补充维生素D的效果。(2)诊断维生素D毒性,例如有可逆毒性的患者(高钙血症)。(3)诊断维生素D不充足或者缺乏,有助于确认那些可能通过补充维生素D达到最佳水平从而收益的个体。
目前,临床或实验室对于25-羟基维生素D检测的方法有荧光免疫层析法、胶体金免疫层析法、化学发光法和酶联免疫法等。胶体金免疫层析法检测技术具有技术操作简便、检测快速、便携性强、样品用量少等优点,但其精密度受到一定限制,仅能做定性或半定量的检测。荧光免疫层析法是免疫荧光技术和传统免疫层析技术相结合发展创新的一种定量新型检测技术。该技术在保留胶体金免疫层析技术操作简便、检测快速、便携性强等优点外,还通过荧光示踪增强技术实现了检测结果的定量。
为验证******生物科技有限公司生产的25-羟基维生素D测定试剂盒(免疫荧光法)是否具有临床应用价值,根据《免于临床试验的体外诊断试剂临床评价技术指导原则(2021年第74号)》开展临床评价,以验证产品的临床效果。
1.1.2产品的检验原理、方法
******生物科技有限公司生产的25-羟基维生素D测定试剂盒(免疫荧光法)采用竞争法免疫层析原理研制,检测人全血/血清或血浆中25-羟基维生素D含量。样本中的25-羟基维生素D抗原与荧光乳胶标记的25-羟基维生素D单克隆抗体结合形成抗原-抗体复合物。未与样本中抗原结合的荧光乳胶标记抗体层析至检测区(T),与预包被的的25-羟基维生素D抗原结合,呈现荧光条带。抗原-抗体复合物,及未与检测区(T)包被的抗原反应完全荧光乳胶标记抗体,层析至质控区(C)与预包被的羊抗兔IgG多克隆抗体结合,呈现荧光条带。检测时,***生物科技有限公司干式荧光免疫分析仪检测模块通过发光二极管发射特殊紫外光,当紫外光照射到检测卡T线和C线时,T线和C线位置的荧光乳胶抗原-抗体复合物在紫外光的照射下呈现荧光条带,干式荧光免疫分析仪检测模块的光电二极管将检测到的荧光转化成电信号,测得T/C比值,通过干式荧光免疫分析仪的软件程序和二维码内参数将T/C比值换算为抗原浓度。
1.1.3预期用途
适用于体外定量检测人血清、血浆或全血中25-羟基维生素D的含量,临床上主要用于维生素D缺乏相关疾病的辅助诊断。
1.1.4临床评价单位情况说明
根据《免于临床试验的体外诊断试剂临床评价技术指导原则(2021年第74号)》,并考核医院该项目的临床开展情况,申办方(******生物科技有限公司)选择******医院开展临床评价试验。
1.2研究目的
评价******生物科技有限公司生产的25-羟基维生素D测定试剂盒(免疫荧光法)用于检测25-羟基维生素D时,其诊断检测能力与已上市的同类检测试剂盒无差异。
1.3对比试剂-待评价试剂描述性比对分析
对比试剂需满足以下条件:
①境内已经取得上市许可;
②与待评价试剂具有相同的预期用途;
③对于定量试剂,对比试剂与待评价试剂的检测结果应具有相同的计量单位或二者之间的计量单位可相互转化。
④ 优先选择与待评价试剂检测结果偏差较小的试剂,不建议选择性能劣于待评价试剂的作为对比试剂。
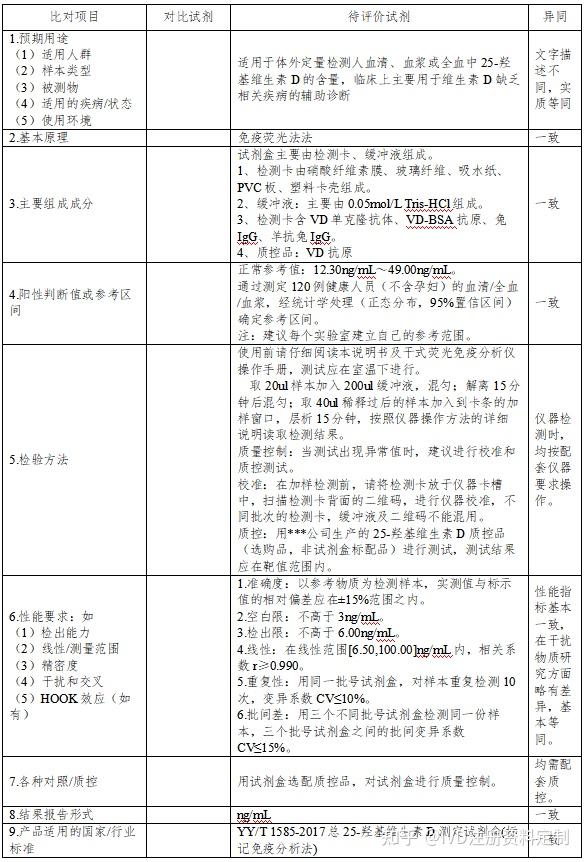
1.4比对性能数据
1.4.1基本信息
1.4.1.1申请人名称
**市*****有限公司
1.4.1.2试验人员
试验操作人员应为具有相应试验能力的专业技术人员,并熟悉待评价试剂和对比试剂的检测流程。
1.4.1.3试验时间及地点
试验应考虑到临床实际使用情况和日间重复性影响,在保证符合样本稳定性的条件下,设定合理的持续时间,如3~20天,应采用待评价试剂和对比试剂分别对所有样本进行编盲、随机检测,整个试验应有内部质量控制。
申请人可根据产品特点自行完成试验或委托其他有能力的实验室完成试验。
试验过程由申请人进行管理并负责试验数据的真实性、合规性及完整性。境外申请人如需进行中国境内开展的方法学比对研究,应通过其在中国的代理人在中国境内开展试验。
申请人也可以提交在境外完成的试验资料,资料内容应满足本指导原则的技术要求,并应充分考虑流行病学差异、受试人群的差异,使用的环境与条件差异等对研究结果产生的可能影响。必要时,申请人应针对差异因素在我国境内进行补充研究。
1.4.1.4待评价试剂名称
25-羟基维生素D测定试剂盒(免疫荧光法)
1.4.1.5对比试剂/参考测量程序或诊断准确度标准
采用方法学比对方式进行评价,对比试剂为****有限公司生产的25-羟基维生素D(25-OH-D)检测卡(荧光免疫层析法)。
1.4.1.6配套使用的其他试剂/仪器的产品名称、生产企业、规格/型号和批号等。
***公司生产的荧光检测仪。
1.5试验设计(试验方法)
1.5.1同品种方法法学对比研究。
⑴与已上市产品进行比较研究:通过选择目前临床普遍认为质量较好的产品作为比对试剂对**市*****有限公司生产的25-羟基维生素D测定试剂盒(免疫荧光法)进行评价,以判断其诊断检测能力与已上市的检测试剂盒无差异。
⑵盲法检测:由样本筛选人员对入选样本编号,再由试验操作人员使用考核试剂和参比试剂对同一样本进行同步检测,入选样本的临床诊断等信息在检测前对操作人员保密,以保证盲法;检测完成后,对检测结果进行一致性分析。
1.5.2试验设计及试验方法选择
1.5.2.1样本量及样本量确定的依据
按《免于临床试验的体外诊断试剂临床评价技术指导原则的通告(2021年第74号)》,定量产品可选择总样本量不少于100例并分别采用待评价试剂和对比试剂/参考方法进行单次测定的方式。
本临床研究为方法学比对设计,采用相关系数检验(连续变量)计算样本量,根据美国国家临床实验室标准化委员会制定的CLSI EP9-A2标准,考核试剂与参比试剂的检测结果的相关系数不得低于0.975,预计本试验的相关系数在0.985以上,故设定参数: α=0.05,s=1(单侧),β=0.2,ρ0=0.975,ρ1=0.985,根据相关系数检验(连续变量)样本量估算公式),计算样本量,具体如下:
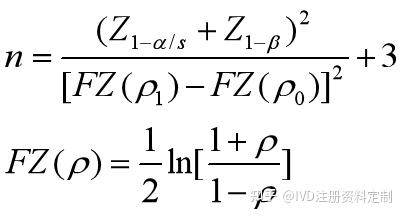
相关系数检验样本量计算
根据以上公式计算得出样本量为96例。
结合法规要求及统计学要求,考虑5%的脱落剔除率,本次临床试验最终样本量确定为不小于100例,若试验过程中有脱落样本或所测量数据不满足分析要求,则需补充样本量,直到满足统计学或法规要求。
1.5.2.2样本选择依据
本次临床试验旨在考查25-羟基维生素D测定试剂盒(免疫荧光法)检测性能,评价其诊断检测能力与已上市的同类试剂盒有无差异。
根据法规要求:样本所来源的病例应涵盖预期适用人群,样本浓度应覆盖线性/测量范围,并包括医学决定水平的样本和干扰样本。
结合本产品的预期用途,本次选择需要评估25-羟基维生素D浓度的临床样本,另外,在临床试验中选择部分含干扰物质的样本进行对比研究,以从临床角度验证试剂的特异性。
1.5.2.3入选标准需满足以下所有条件方可入选:
病例组:
临床上需要评估25-羟基维生素D浓度的临床样本,如:
诊断维生素D毒性,例如有可逆毒性的患者(高钙血症);
诊断维生素D不充足或者缺乏;
或其他类似的疾病患者病例作为入选样本,性别、年龄不限。
对照组:医院其他科室与病例组疾病不相关的样本以及正常健康人群的均可入选,性别、年龄不限。
病例组和对照组样本保存条件应满足对照与待测试剂盒要求。
1.5.2.4排除标准样本符合以下任意一条,则不能入选:
⑴ 样本收集时间或病例信息不明确;
⑵ 试验操作中因失误导致样本量不足检测者;
⑶ 研究者认为该样本不满足检测要求。
1.5.2.5剔除标准
⑴ 因仪器或人为因素(操作过程中样本受到污染)导致无法完成双管平行测定试验过程的样本;
⑵ 被测物质浓度超过试剂的线性检测范围;
⑶ 双管平行测定结果只有考核试剂(或参比试剂)的检测数据。
1.5.2.6样本要求
待测试剂盒:
a、全血。
b、全血的收集:含EDTA-K抗凝剂(不建议使用EDTA以外的抗凝剂)的采血管或抗凝管,将采集血样加入并摇匀备用;避免溶血样本用于本试剂,如不能及时测试可将标本置2-8℃贮存,可存放72h,不得冻存。
对照试剂盒:
a、全血。
b、全血的收集:含EDTA-K抗凝剂(不建议使用EDTA以外的抗凝剂)的采血管或抗凝管,将采集血样加入并摇匀备用;避免溶血样本用于本试剂,如不能及时测试可将标本置2-8℃贮存,可存放72h,不得冻存。
1.5.2.7考核试剂说明
产品名称:25-羟基维生素D测定试剂盒(免疫荧光法)
包装规格:25人份/盒。
批号:20220702
有效期至:20230719
生产商:**市*****有限公司
生产地址:**市**区***
生产许可证号:*食药监械生产许200***号
注册证号:*械注准201****
保存条件及有效期:
储存条件:2℃-8℃,无腐蚀性物质的环境中避光保存。
有效期:12个月。试剂开封后应尽快检测,暂不能检测时,可在2℃-8℃,无服饰性物质的避光环境中密封保存,可放置72小时。
适用仪器:
**市***有限公司生产的荧光免疫层析分析仪。
1.5.2.8参比试剂说明
产品名称:25-羟基维生素D测定试剂盒(免疫荧光法)
包装规格:25人份/盒。
批号:20221024
有效期至:20231023
生产商:****有限公司
地址:****。
产品注册证号:***
保存条件及有效期:
贮存于2℃-8℃,有效期为12个月。
适用仪器:适用于***分析仪。
对比试剂确立依据:***公司生产的25-羟基维生素D(25-OH-D)检测卡(荧光免疫层析法)与考核试剂方法学、检测物质、临床预期用途、主要性能指标、推荐的阳性判断值或参考区间等方面基本一致,且参比试剂的临床应用广泛,产品质量好。因此,选择该公司生产的试剂作为参比试剂。
1.5.2.9质量控制方法
在使用待评价试剂和对比试剂对临床样本进行测试前,需对系统进行质控。
质控方法:校准完成后,校准完成后,用待评价试剂和对照试剂测试25羟基维生素D欧盟参考物质(SRM1950)对每个标准品重复测试三次,结果应该靶值10%范围内。
1.5.2.10数据统计分析
在数据收集过程中,应对所有数据及时记录并检查。如确定某些异常结果由可解释、可接受的原因引起,应记录原因并将其排除出数据分析。如不能确定原因,须将原始结果保留在数据集中。
⑴离群点检查
表1方法间离群点检查样表
| 样本编号(i) | 考核试剂(Xi) | 参比试剂(Yi) | 绝对差值(Di) | 相对差值(Di') | | 1 | X1 | Y1 | D1 | D1' | | 2 | X2 | Y2 | D2 | D2' | | 3 | X3 | Y3 | D3 | D3' | | 4 | X4 | Y4 | D4 | D4' | | … | … | … | … | … | | 平均值 | / | / | E | E' |
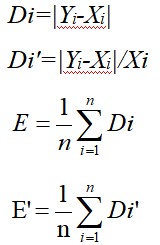
离群值计算公式
检测界限为4E与4E',把每一个Di和Di'分别与4E和4E'比较,标记超出4E和4E'的点。
任何一点(Xi,Yi)如同时未通过上述两种检测方法,则判断为离群点。
如果出现一个以上的离群点,但它们并未超出医学上有临床意义的界限,则可保留并使用这些数据。如果离群点超出医学上有临床意义的界限,应删除该点,但每组数据中被删除的离群值不能超过2.5%。如果超过2.5%,则应调查是否存在干扰、人为错误或仪器故障。如果有几个分析物同时在同一仪器设备上评价,检查出现明显偏差的样本的其它分析物的结果,同时也应检查同一分析批的质量控制结果。
⑵考核试剂与参比试剂定量结果评价
依据两种方差差值或相对差值数据的分布情况,选择最小二乘法(普通线性)回归、加权最小二乘法回归、Deming回归、Passing-Bablok回归分析。
2.1最小二乘法(普通线性回归)
以考核试剂检测结果为Y轴,参比试剂检测结果为X轴作散点图。采用最小二乘法进行线性回归分析,计算斜率(b)和截距(a),建立回归方程Y=a+bX。

最小二乘法回归系数计算
2.2Deming回归分析a和b的估计值的计算过程如下:

Deming回归计算公式
2.3加权最小二乘法回归计算

加权最小二乘法回归计算公式
2.4Passing-Bablok回归计算

Passing-Bablok回归分析计算公式
2.5相关系数计算:

相关系数计算公式
3) Bland-Altman图
以同一样本考核试剂与参比试剂检测浓度的均值为X,检测浓度的差值(考核试剂-参比试剂)或差值百分比((考核试剂-参比试剂)/考核试剂与参比试剂均值)为Y轴作散点图,并标注两种试剂检测浓度的差值或差值百分比的均值、一致性界限(Mean±1.96SD)。
4) 医学决定水平处的偏倚
根据考核实际与参比试剂检测结果计算医学决定水平处偏倚,偏倚的计算方法参考YY/T1789.2。
①最小二乘法医学决定水平处偏倚计算公式如下:

最小二乘法医学决定水平处偏倚计算公式
②对于Deming回归,医学决定水平处偏倚计算公式如下:
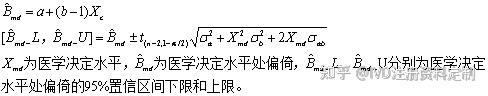
Deming回归医学决定水平处偏倚计算公式
③对于加权最小二乘法回归,医学决定水平处偏倚计算公式如下:

加权最小二乘法回归医学决定水平处偏倚计算公式
④对于Passing-Bablok回归,医学决定水平处偏倚使用Medcalc软件进行计算。
5)含干扰物质样本相对偏差计算
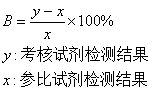
⑹考核试剂与参比试剂定性结果评价(符合率及Kappa一致性分析)
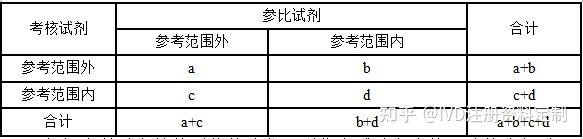
按下表对结果进行分类后计算。
定性检测结果配对四格表
定性检测结果配对四格表
根据文献《定性检测体外诊断试剂临床试验方案的设计策略》以及《WS/T505-2017定性测定性能评价指南》以及YY/T 1789.6-2023 体外诊断检验系统 性能评价方法 第6部分:定性试剂的精密度、诊断灵敏度和特异性算法:
参考范围外标本符合率按公式按a/(a+c)×100%计算;
参考范围内标本符合率按公式按d/(b+d)×100%计算;
总符合率按公式按(a+d)/(a+b+c+d)×100%计算;

率的置信区间计算公式
Kappa计算公式如下:
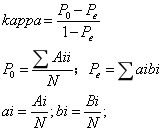
Kappa计算公式
亦可用统计软件进行计算。
1.5.试验实施情况,具体包括:
1.5.1样本选择情况,包括例数和样本分布等。
1.5.1.1样本例数
按样本入选标准共搜集了118例受试者样本,按排除标准共剔除样本0例剔除率为0.00%,最终纳入分析118例。
入选与排除概况

入选与排除情况
1.5.1.2样本分布
*****院、*******医院最终纳入检测样本112例,其中男性54例,女性58例。
1.5.2试验过程描述。
按盲法检测要求,由样本筛选人员对入选样本编号,再由试验操作人员使用考核试剂和参比试剂对同一样本进行同步检测,入选样本的临床诊断等信息在检测前对操作人员保密,以保证盲法;检测完成后揭盲,然后再对检测结果进行一致性分析。
1.6试验管理
1.6.1参加人员
试验操作人员应为具有相应试验能力的专业技术人员,并熟悉待评价试剂和对比试剂的检测流程。
1.6.3数据管理
(1)研究者根据受试者的原始观察记录,将数据及时、完整、正确、清晰地载入数据采集表;
(2)监查员监查试验的进行是否遵循试验方案。确认所有数据采集表填写正确完整,并与原始资料一致。如有错误和遗漏,及时要求研究者改正。修改时需保持原有记录清晰可见,改正处需经研究者签名并注明日期;
(3)经过监查员检查数据采集表无误后,及时送交临床试验数据管理员。对于完成的数据采集表在研究者、监查员、数据管理员之间的传送应有专门的记录,收到时应有相应的签名,记录需妥善保存。
1.6.4质量控制
校准完成后,用待评价试剂和对照试剂测试25羟基维生素D欧盟参考物质(SRM1950)对每个标准品重复测试三次,结果应该靶值10%范围内。
待评价试剂和对照试剂的质控结果
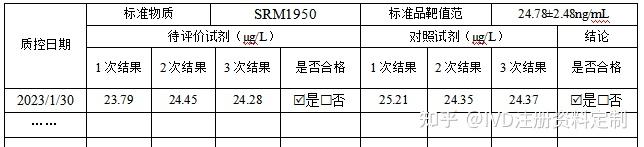
质控结果
1.6.5试验样本
应采用与预期用途声称样本类型一致的人体样本进行试验,样本背景信息应清晰,样本来源应可溯源。样本背景信息包括但不限于:样本来源、唯一且可追溯的编号、样本类型和其他相关背景信息(如年龄、性别、干扰因素等);对于试剂检测结果有明确疾病指向的产品,其纳入的样本所来源的病例应有明确的临床诊断信息。
样本采集方式及稳定性应符合待评价试剂和对比试剂说明书有关要求。原则上,应采用临床真实样本进行研究。当遇真实样本浓度无法覆盖检测范围时,应充分阐述无法获得的依据,酌情采用稀释或者经处理去除分析物获得低浓度样本、添加分析物获得高浓度样本等人工制备样本,人工制备样本应充分考虑样本的背景信息,基质效应等影响因素,一般而言,人工制备样本不应超过总样本量的20%。
1.6.6出现的问题及处理措施
临床试验开始时,临床试验单位应做好充分的准备,掌握试验产品的使用方法和相关技术,确保有充足的人力和时间来保障试验的进行。申办者对试验产品的使用及相关技术对临床试验人员进行充分的培训,并提供足够的试验试剂。在没有做好充分的准备前,不开展临床试验。
本试验产品为体外诊断试剂,不会对受试者造成直接的伤害。在进行临床验证时,不会产生不良反应。测试采集尿液样本属于医疗常规项目,风险极小。
本产品在试验中若出现和预期严重不相符的情况,应立即暂停试验,找出原因,再重新开始或停止临床试验。
1.7临床试验结果及分析
1.7.1入选与剔除
******医院共检测112例受试者样本,按方案剔除标准共剔除样本0例,其中0例为线性范围外标本,0例为离群值标本,剔除率为0.00%,最终纳入分析112例。详情见下表。
入选与剔除概况
| 入选样本(例) | 剔除样本(例) | 剔除率 | 符合样本(例) | | 112 | 0 | 0.00% | 112 |
1.5.2基线情况
******医院最终纳入分析112例,其中男性54例,女性58例,平均年龄43.46±27.77岁。
基线概况
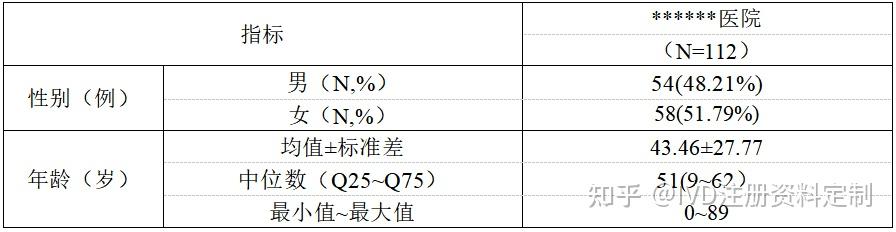
基线情况
1.7.3样本浓度分布情况
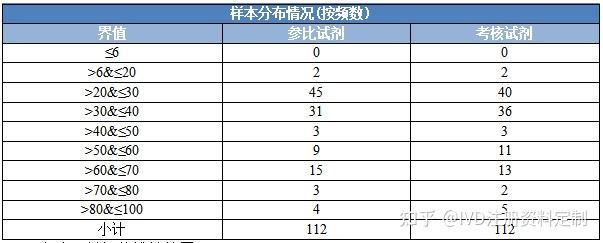
备注:拟评价线性范围6.5~100ng/mL
样本在线性范围各浓度区间内,均有分布,能确定产品在线性范围内的一致性得到评估。
1.7.4绝对差值散点图及排序偏差图
以考核系统与参比系统检测浓度均值为X轴,以考核-参比为Y轴绘制散点图如下:
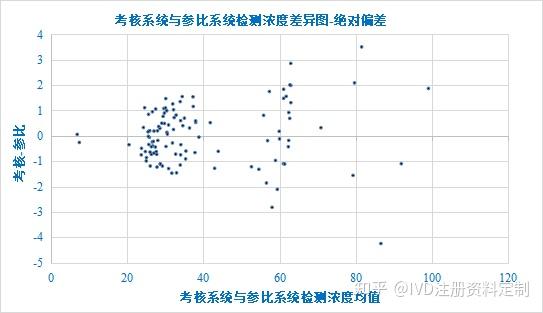
浓度差异图
以参比系统检测浓度秩次(由小到大排序)为X轴,以相对差值为Y轴绘制排序偏差图如下:
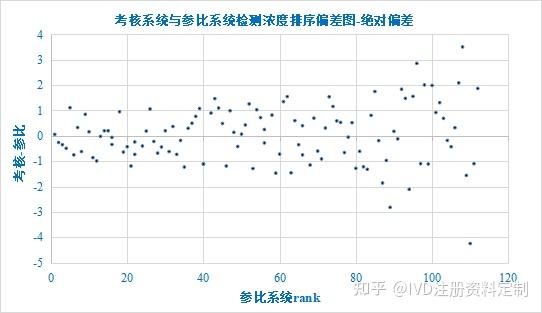
浓度排序偏差图
以考核系统与参比系统检测浓度均值为X,考核-参比为Y,进行回归分析,同时对绝对偏差进行正态分布检验,结果如下:
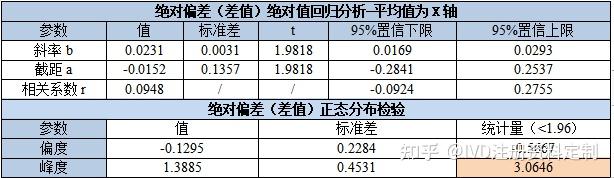
差值回归分析
斜率、截距、相关系数95%CI置信区间均包括0,但斜率95%CI置信区间不包括0,说明差值和均值之间存在一定的线性关系,即两种方法检测结果的差值随浓度增加略有增加,同时观察散点图及排序偏差图,恒定偏差(恒定SD)模式不明显,进一步进行相对偏差分析,确定回归模型。对差值进行正态分布检验,差值偏离正态分布,对绝对偏差数据进行Bland-Altman一致性分析供参考。
1.7.5相对差值散点图及排序偏差图
以考核系统与参比系统检测浓度均值为X轴,以相对差值为Y轴绘制散点图如下:
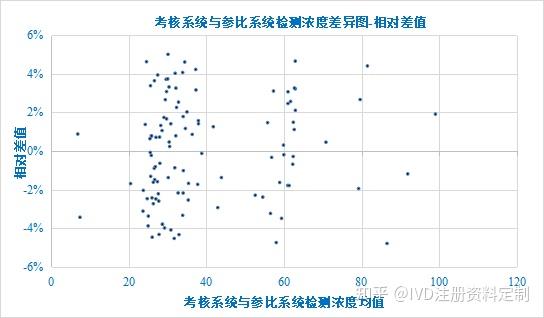
浓度差异图
以参比系统检测浓度秩次(由小到大排序)为X轴,以相对差值为Y轴绘制排序偏差图如下:
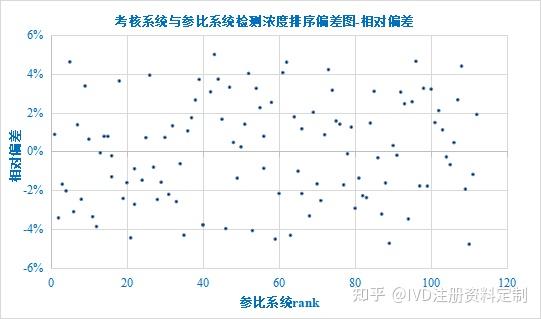
排序偏差图
以考核系统与参比系统检测浓度均值为X,相对偏差为Y,进行回归分析,同时对相对偏差进行正态分布检验,结果如下:
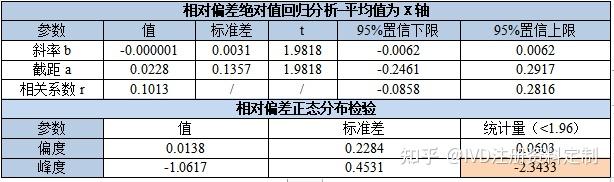
斜率、截距及相关系数95%CI置信区间包括0,说明相对差值和均值之间不存在任何线性或非线性关系,即两种方法检测结果的相对偏差不随浓度增加而增加(或减少),且散点图及排序偏差图里的数据点大致在±6%的等宽范围内,数据呈恒定CV模式,可进一步对数据进行Deming回归分析,进行一致性评价。相对偏差正态分布结果显示数据不符合正态分布,绘制相对偏差Bland-Altman一致性分析结果供参考。
1.7.6离群值
根据离群值检查方法,对*****院、*******医院纳入的112例受试者样本检测浓度进行方法间离群值检查,共0例被判定为离群值。
1.7.7线性回归与相关
1.7.7.1最小二乘法回归分析
根据回归分析和相关分析计算公式,计算******医院数据Pearson相关系数r=0.9979,如图。进行回归分析,计算得截距(a):-0.1228(-0.7301,0.4844),斜率(b):1.0041(0.9900,1.0181),回归方程为:Y=-0.1228+1.0041X,决定系数r2=0.9959。
Pearson相关系数接近1,说明两种试剂的相关关系密切。回归方程的截距(a)的95%CI包括0,斜率(b)95%CI包括1,说明两种试剂的一致性比较好。
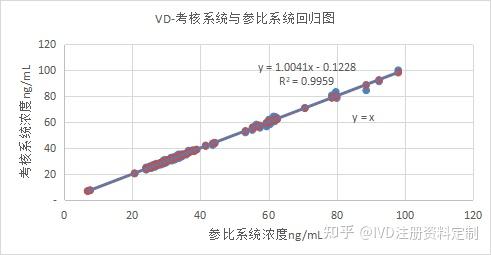
回归分析图
1.7.7.2Deming回归分析
根据Deming回归分析和相关分析计算公式,计算*****院、*******医院数据Pearson相关系数r=0.9979,决定系数r2=0.9959,Pearson相关系数接近1,说明两种试剂的相关关系密切。进行Deming回归分析,计算得截距(a):0.2044(-0.3159,0.7244),斜率(b):0.9939(0.9819,1.0059),回归方程为:Y=-0.2044+1.0059X。回归方程的截距(a)的95%CI包括0,斜率(b)95%CI包括1,说明两种试剂的一致性比较好。
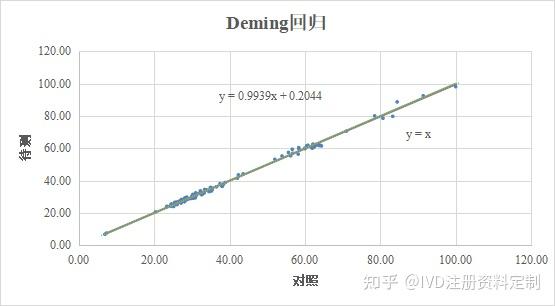
Deming 回归分析图
1.7.8Bland-Altman图
以考核试剂与参比试剂检测浓度的差值百分比为Y轴,均值为X轴绘制Bland-Altman散点图:两种试剂检测浓度差值为0.0377±1.1505 ng/mL(均值±标准差),两种试剂检测浓度差值的均值±1.96SD范围在-2.2173ng/mL到2.2927ng/mL之间。超出置信区间的百分比为:3.57%。两种试剂检测浓度差值的变化呈检测浓度均值越大差值越大的趋势。如下图所示:
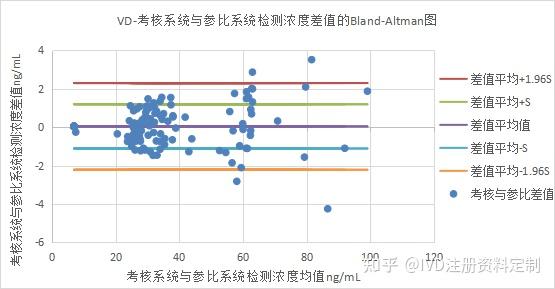
Bland-Altman散点图
以考核试剂与参比试剂检测浓度的差值百分比为Y轴,均值为X轴绘制Bland-Altman散点图:两种试剂检测浓度比值为1.0001±0.0264(均值±标准差),两种试剂检测浓度比值的均值±1.96SD范围在0.9483到1.0519之间。超出置信区间的百分比为:0.00%。两种试剂检测浓度差值百分比基本在±SD之间均匀分布,如下图所示:
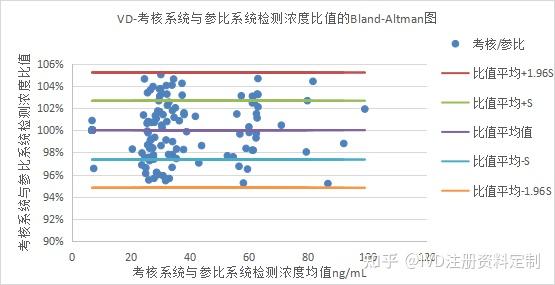
Bland-Altman散点图
1.7.9符合率及一致性分析
1.7.9.1符合率分析
******医院共纳入EDTA-K抗凝全血样本112例,考核试剂与参比试剂均检测均在参考范围外的标本31例,均在参考范围内的标本79例,参比试剂检测在参考范围外且考核试剂在参考范围内的标本2例,参比试剂检测在参考范围内且考核试剂在参考范围外的标本0例,详见下表
定性检测结果配对四格表
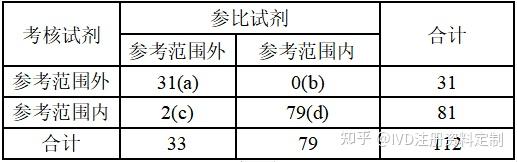
定性检测结果配对四格表
参考范围外标本符合率按公式a/(a+c)×100%计算;
参考范围内标本符合率按公式d/(b+d)×100%计算;
总符合率按公式(a+d)/(a+b+c+d)×100%计算;
符合率置信区间的计算公式采用WS/T505-2017定性测定性能评价指南的方法。
对考核试剂和参比试剂的检测结果进行Kappa值检验,当k>0.8时,考核试剂与检测试剂的检测结果高度一致。
经计算,考核试剂定性检测结果参考范围外标本符合率为93.94%(90.18%,96.32%),参考范围内标本符合率为100.00%(98.43%,100.00%),总符合率为98.21%(95.63%,99.28%)。进行Kappa一致性分析,Kappa值k=0.9563。详见下表:
| 考核试剂 | ******医院 | | 参考范围外标本符合率 | 93.94%(90.18%,96.32%) | | 参考范围内标本符合率 | 100.00%(98.43%,100.00%) | | 总符合率 | 98.21%(95.63%,99.28%) |
1.7.9.2不一致样本分析
******医院共2例样本考核试剂与参比试剂检测结果不一致,不再用第三方试剂复核。
不一致样本详情
| 样本编号 | 性别 | 年龄 | 参比试剂(ng/mL) | 考核试剂(ng/mL) | 临床诊断 | | 0711170570 | 女 | 57 | 6.85 | 6.91 | 体检 | | 0711153669 | 女 | 40 | 7.57 | 7.31 | 弥漫性甲状腺肿甲状腺机能亢进症 |
1.7.10含干扰物质样本检测
为综合、全面的评价考核试剂的检测性能,样本中应包括一定数量的含干扰物质的样本。检测结果如下表所示。试验结果说明,考核试剂和参比试剂检测结果无差异。表明考核试剂和参比试剂的抗干扰性能有较好的一致性。
含干扰物质样本详情
| 样本编号 | 性别 | 年龄 | 参比试剂(ng/mL) | 考核试剂(ng/mL) | 临床诊断 | 干扰物 | 相对偏差 | | 0711190463 | 男 | 1 | 26.55 | 26.12 | 黄疸(TBIL) | TBIL | 2.62% | | 0711192444 | 女 | 37 | 28.08 | 28.45 | 备孕(LH) | LH | -4.10% | | 0711184115 | 男 | 49 | 29.39 | 30.86 | 高脂血症(TG) | TG | -1.47% | | 0711192341 | 男 | 28 | 27.62 | 27.18 | 高脂血症(TG) | TG | -0.43% | | 0711156731 | 女 | 26 | 31.65 | 32.68 | 早孕(HCG) | HCG | -4.44% |
1.7.11医学决定水平处的偏倚
医学决定水平指在诊断及治疗工作时,对疾病诊断或治疗起关键作用的某一被测物浓度,临床上必须采取措施的检测水平。根据《临床检验定量测定项目的室内质量控制监测项目允许不精密度(变异系数)要求》,网址:https://www.nccl.org.cn/showEqaPtDetail?id=333,25羟基维生素D1/3室间质量评价标准(25):8.33ng/mL,即可接受的偏倚限值为(-8.33ng/mL,8.33ng/mL)。由于该项目尚无公认的医学决定水平,以参考区间的临界值计算偏倚。
①按最小二乘法计算医学决定水平处的偏倚:
12.3ng/mL处的偏倚为-0.0729ng/mL,偏倚的95%置信区间为(-0.4252, 0.2793)ng/mL。
49ng/mL处的偏倚为0.0760ng/mL,偏倚的95%置信区间为(-0.1172,0.2691)ng/mL。
偏倚均在可接受的偏倚限值内,说明医学决定水平处的偏倚是可以接受的。
②按Deming回归计算医学决定水平处的偏倚:
12.3ng/mL处的偏倚为0.1292ng/mL,偏倚的95%置信区间为(-0.0019,0.2603 )ng/mL。
49ng/mL处的偏倚为-0.0951 ng/mL,偏倚的95%置信区间为(-0.2356,0.0454 )ng/mL。
最小二乘法及Deming回归医学决定水平处的偏倚均在可接受的偏倚限值内,说明医学决定水平处的偏倚是可以接受的。
1.6讨论和结论
讨论:******医院共检测112例受试者样本,按方案剔除标准共剔除样本0例,其中0例为线性范围外标本,0例为离群值标本,剔除率为0.00%,最终纳入分析112例,其中男性54例,女性58例,平均年龄43.46±27.77岁。
本次临床试验结果的Pearson相关系数接近1,说明两种试剂的相关关系越密切。回归方程的截距(a)的95%CI包括0,斜率(b)接近1,说明两种试剂的一致性比较好。根据说明书中对准确度允许偏差的标准,医学决定水平处偏倚均在允许偏差范围内。
考核试剂与参比试剂检测浓度的差值Bland-Altman散点图显示:两种试剂检测浓度差值为0.0377±1.1505ng/mL(均值±标准差),两种试剂检测浓度差值的均值±1.96SD范围在-2.2173ng/mL到2.2927ng/mL之间。超出置信区间的百分比为:3.57%。
考核试剂与参比试剂检测浓度比值的Bland-Altman散点图显示:两种试剂检测浓度比值为1.0001±0.0264(均值±标准差),两种试剂检测浓度比值的均值±1.96SD范围在0.9483到1.0519之间。超出置信区间的百分比为:0.00%。
经计算,考核试剂定性检测结果参考范围外标本符合率为93.94%(90.18%,96.32%),参考范围内标本符合率为100.00%(98.43%,100.00%),总符合率为98.21%(95.63%,99.28%)。进行Kappa一致性分析,Kappa值k=0.9563。对含干扰物质样本的检测,考核试剂和参比试剂检测结果无差异,表明考核试剂和参比试剂的抗干扰性能有较好的一致性。
结论:本中心在本次临床试验共检测112例有效样本,通过对考核试剂和参比试剂检测浓度的Pearson相关系数、回归方程、Bland-Altman图进行分析,显示两种试剂检测全血25-羟基维生素D浓度有良好的一致性。符合率及Kappa一致性分析显示考核试剂与参比试剂对结果的判断有良好的一致性。
二、有关临床试验中特别情况的说明
暂无。
三、附件
3.1产品说明书
3.2已上市产品(对照试剂盒)的注册信息
3.3临床评价数据表
关于IVD临床的相关统计分析,已整理成Excel计算模板,相关使用见下面视频:
原文地址:https://zhuanlan.zhihu.com/p/584662571 |
|
 /3
/3 