金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
Flag:如果本回答赞超过1000,我就写个续篇,嘻嘻
<hr/>所谓“冷门细胞器”,要么是指没什么人研究的——既然没什么人研究,那通常不会有趣,那这个问题就自相矛盾了。所以我理解为新发现的而功能很重要的,甚至定义和存在性有争议的,而研究很不全面的,嗯,姑且认为是这个意思。
然而随着人们在细胞内发现越来越多的复杂机器以及对它们的认识不断加深,细胞器(organelles)这个概念正在被解构。
一般说细胞器分“膜性细胞器”和“无膜细胞器”,比如内质网、高尔基体和核糖体、中心体、剪接体,就好像它们的界限是泾渭分明的。
一些偏冷门的膜性细胞器包括:自噬体(autophagosome)(而且具有双层膜)、过氧化物酶体(peroxisome)等等;此外外泌体(exosome),以及前几年俞立等发现的迁移体(migrasome),也被标记为一种细胞器,其功能可能是作为细胞排出废物的机制,比如受损线粒体的清除。
然而现在,大型分子复合物(macromolecular complex)和相分离(phase separation)使我们对细胞器的认识越来越发生改变,出现了一些非同寻常的趋势:
一方面,这些分子机器和细胞器之间总是相互串扰,构成一张高度动态的巨大网络,有些复合物压根没有完整的形态(无法定义出一个标志它完整形态的分子组成),只能称为分子平台(platform)或分子通路(pathway);
另一方面,(液-液)相分离(LLPS)提供了不同于膜的分隔机制,甚至区室机制,其中一些蛋白或者lncRNA充当区室结构的边界支架。
此外有研究发现核糖体、内质网、高尔基体等细胞器的发生形成也依赖相分离过程。
此外还有几点值得注意:
- 一些相分离液滴甚至具有复杂结构,比如呼吸道合胞病毒(respiratory syncytial virus, RSV)的包涵体(inclusion bodies, IBs),病毒RNA在其中复制时又形成包涵体相关颗粒(IBAGs),导致包涵体看起来竟然活像一个细胞(下图[1])。
- 细胞器膜也是半透膜或条件透过膜,其上有各种孔蛋白在控制物质的进出。诸如内质网膜上的Sel1L-Hrd1复合物[2],过氧化物酶体上的Pex13-Pex5[3],线粒体外膜的Tom40-Tom20/22,线粒体内膜的Tim23/17-Tim44,溶酶体膜的LAMP2a等,可以对蛋白等大分子进行跨膜运输(但货物在运输时结构被破坏或不完整),而核膜上的核孔复合体(NPC)则可以完整地进行运输。即分隔程度/透过性只有大和小而非有和无的区别。
- 膜性细胞器的膜(注意是它们的膜,而不是其他组分)并非从头发生,而是要么依赖于核-内质网-高尔基体-质膜这个主轴膜系统,要么依靠同类细胞器发生裂殖或其他形式的自我复制而形成。真核细胞是否具有从头组装有功能的闭合膜腔的能力现在存疑。
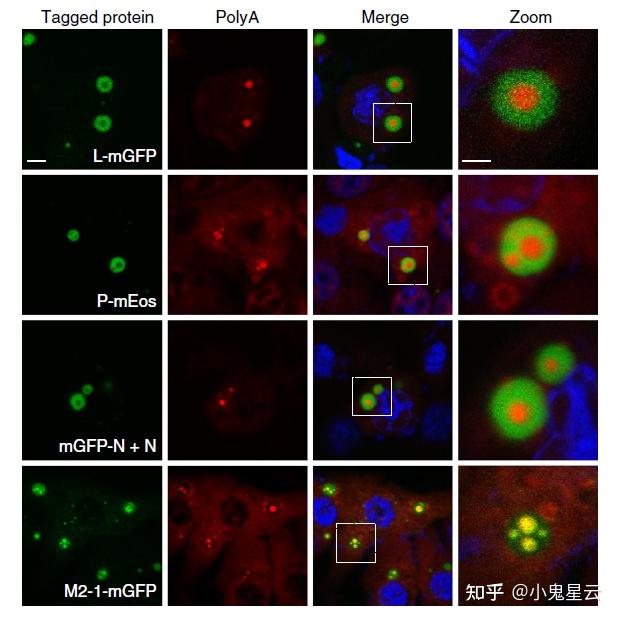
RSV感染后形成的包涵体(IB)和IBAGs。
于是,上面的情况结合起来,就形成了一座从简单大分子到复杂的典型细胞器的金字塔,每个层次都发挥着自己独特且重要的功能。
与之相比,现今的某些学者或者报道鉴定出新型的囊泡、大液滴或者蛋白机器就高兴地直呼自己“发现了一种新的细胞器”(比如这位:又一颗“细胞星辰”被点亮!康毅滨团队发现全新细胞器,并与癌症转移有关),这种做法其实令人颇感画风诡异。
好了说完了上面的这些,现在姑且来举几个“冷门细胞器”的例子吧。
迁移体[4]
应读者要求加上迁移体。顾名思义,其就是迁移中的细胞产生并且遗留于自己迁移尾迹上的,“石榴样”的囊泡性细胞器。
现在已经鉴定出,四跨膜蛋白tetraspanin(Tspan)家族成员,如Tspan4富集于迁移体中,可以作为一项标志物,也是迁移体发生机制中的中心角色。以后又鉴定出更多标志物如NDST1、PIGK、CPQ、EOGT、整合素、WGA(小麦胚芽凝集素,含有N-乙酰-D-葡糖胺和N-乙酰神经氨酸)等。Tspan4或其他Tspans,倾向于在尾迹上某些位置富集并鼓起,“某些位置”似乎是决定于几种整合素integrin如α1和α5及其在细胞外基质(ECM)中的特定配体的分布特征(有待进一步明确)。
有意思的是,直至与细胞的主体离得很远也还通过收缩纤维(retraction fibers, RFs)相连(下图),另外脱离的迁移体也不与外泌体等同,因为与外泌体相比仍有很大差别,只能被归为另一种特殊的外膜囊泡。
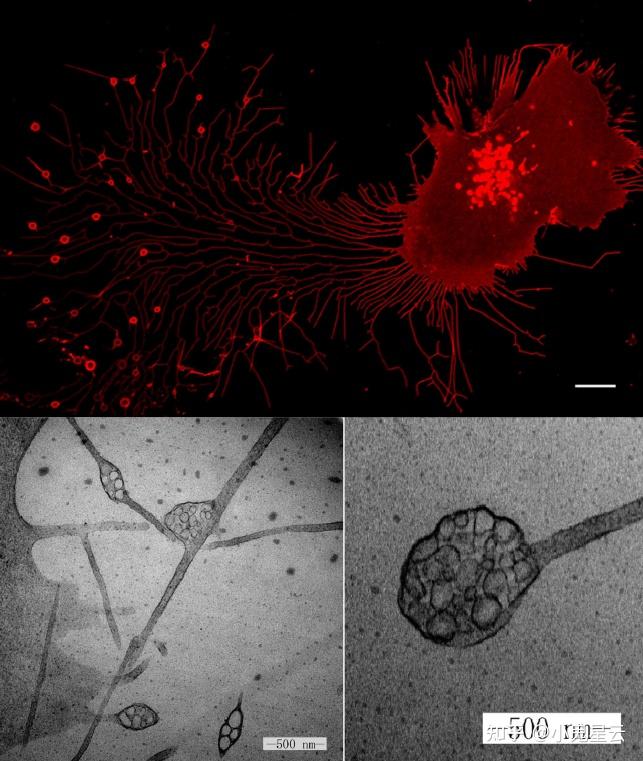
围绕迁移体的生物学功能目前提出了3个模型,各有证据和案例,更多的功能和机制也有待发掘:
- 包装信息,向周围细胞传递信号。如富集大量细胞因子、趋化因子、生长因子并在迁移体的所在位置缓慢持续释放,而不是一次性大量释放。
- 垃圾处理机制。比如发现了一种称为线粒体胞吐(mitocytosis)的机制,细胞将受损的线粒体分选进入迁移体中。其分选机制似乎跟受损线粒体无法结合动力蛋白dynein,反而去结合驱动蛋白kinesin I有关,导致受损线粒体被运送至细胞边缘区,并由肌球蛋白myosin19锚定于质膜上(myosin19又结合于细胞皮质肌动蛋白),最后被包装进迁移体中。线粒体胞吐仅在轻度线粒体应激时发生,(严重线粒体应激会引起细胞死亡。)受损线粒体通过迁移体外抛的实际数量小、速度慢,代表了一种线粒体质控机制,可能与线粒体自噬(mitophagy)协同作用。中性粒细胞(neutrophils)是线粒体胞吐活跃的细胞之一,其分泌的迁移体中含有受损线粒体,敲除Tspan9的小鼠循环中粒的存活性和线粒体膜电位严重降低。有意思的是,细胞移动是个相当耗能的过程,会引起轻度的线粒体应激。因此迁移体的出现完美地恰如其分。
- 功能分子如RNA和蛋白的水平转移(通过靶细胞内吞迁移体)。如发现将含有Pten mRNA的迁移体加入肿瘤细胞系共培养,于是在肿瘤细胞中发现Pten蛋白合成,Pten几乎完全阻断了P-Akt信号,并抑制了肿瘤细胞的增殖。不过目前并不清楚内吞的迁移体如何躲过被溶酶体降解的命运。
迁移体是新近发现的细胞器;迁移体的发现是本国科学家近年标志性的原创科研成果。不过,有关迁移体的研究需要时间沉淀,应该鼓励某些感兴趣却又抱有疑虑的人说:跟从他人创建的队列并不无趣或者可耻。
PML小体
PML是「原髓细胞性白血病」(promyelocytic leukemia)的意思。PML小体又称ND10(ND: nuclear domain)、Kremer小体,甚至有时简称核小体(nuclear bodies),简称PML-NBs。位于细胞核内,大小0.1 ~ 1.0μm,球形、无膜的区室;最初在急性早幼粒细胞白血病(acute promyelocytic leukemia, APL)细胞中被发现,发现其中染色体易位导致产生PML-RARα融合肿瘤基因,之后在许多其他类型细胞中都找到——典型的每个细胞核5~30个,并证实它与许多细胞功能有联系。之所以叫PML小体不是因为PML这种疾病,而是因为它标志性的骨架蛋白PML,大量PML蛋白围成了PML小体的边界。
PML蛋白[5]与PML小体的发生组装:PML又叫RNF71、TRIM19。RNF表示环指(RING finger),TRIM表示它是「三分模体」(tripartite motif, TRIM)包含蛋白家族成员。RING其实是“really interesting new gene”的缩写,是当时发现它的人起的可能是临时名字。882个残基(人)。虽然富集于PML小体中,但其分布位置其实遍及细胞各部。关键的结构特征包括:
- RBCC模体,就是上面所谓的“三分模体”,即:一个环指结构域,使得PML是一个E3 SUMO连接酶;两个富含半胱-组氨酸(CH-rich)的B-box结构域,可以结合Zn²⁺;一个卷曲螺旋(α-helical coiled-coil)结构域。缩写分别是R、B和CC。
- 核定位信号(NLS)。
- SUMO互作模体(SIM),可以与SUMO及SUMO化的蛋白质互作。
- K65、K160、K490及其他多个赖氨酸位点被SUMO化修饰。
根据相分离的理论,PML就是个典型的相分离分子。不过PML的相分离能力——虽然很重要,但不足以单独解释为什么PML形成PML小体的外壳(outer shell)而不是一个均一的PML液滴。
通常把PML称作“支架蛋白”(scaffold),而把PML-NBs内腔中的蛋白被称作“客户蛋白”(client)。之后有人提出了更复杂PML-NBs发生的模型(下图[6]),涉及到PML单体之间也可以发生分子间二硫键连接,以及可能是寡聚化形式而非PML单体最终形成了PML-NBs。
此外,结合在染色质上的PML也可能是PML-NBs发生启动开关,事实上转路活跃的区域常常是PML-NBs的发生位点,且刚转录出来的RNA常常位于PML-NBs内。
另外,K65、K160、K490三个位置的SUMO化(分别由PISA1、PIAS2和RANBP2介导)对PML-NBs的形成至关重要,诸如DNA损伤、病毒感染(已有报道的,包括人巨细胞病毒(HCMV)、单纯疱疹病毒(HSV)、HIV)、砷、细胞应激、细胞分化事件等因素可以调节PML SUMO化,IFN-α和IFN-γ信号可以刺激PML-NBs形成。特别值得注意的是砷在白血病中引起PML-RARα融合蛋白SUMO化和泛素化引起其降解,是一些砷剂在治疗白血病中的药理机制之一。
PML-NBs的内容物庞杂繁多,可通过内容物间接推测其功能,包括:Sp100(首个鉴定的客在蛋白),UBC9(目前唯一已知的E2 SUMO连接酶)、组蛋白及其变体(如H3.3),组蛋白伴侣(ATRX、DAXX、DEK、HIRA复合物(包括HIRA, UBN1, CABIN1,有时ASF1A))、染色质修饰酶(如CBP、MOZ/KAT6A、TIP60/KAT5是转乙酰基酶、HDAC7是IIA型去乙酰化酶、SETDB1是H3K9三甲基转移酶、SIRT1是去乙酰化酶、TET2是DNA去甲基化酶)。它与染色质动力学和基因表达调控之间的关系自然最令人在意;涉及的特定细胞功能则可能包括氧化/损伤应激、抗病毒免疫、衰老(因发现它与端粒的相互作用,更发现lnc-TERRA是PML-NBs的客在成分)等。
总而言之,PML-NBs发生过程复杂、组分繁多、结构高度动态,堪为典型的细胞器,而其在“细胞器金字塔”中的层次似乎介于膜性细胞器和典型的大蛋白复合物之间。
用抗Sp100抗体做免疫荧光以显示PML小体,可见其在核内呈点状富集。Sp100是第一个在PML小体中鉴定的成分。
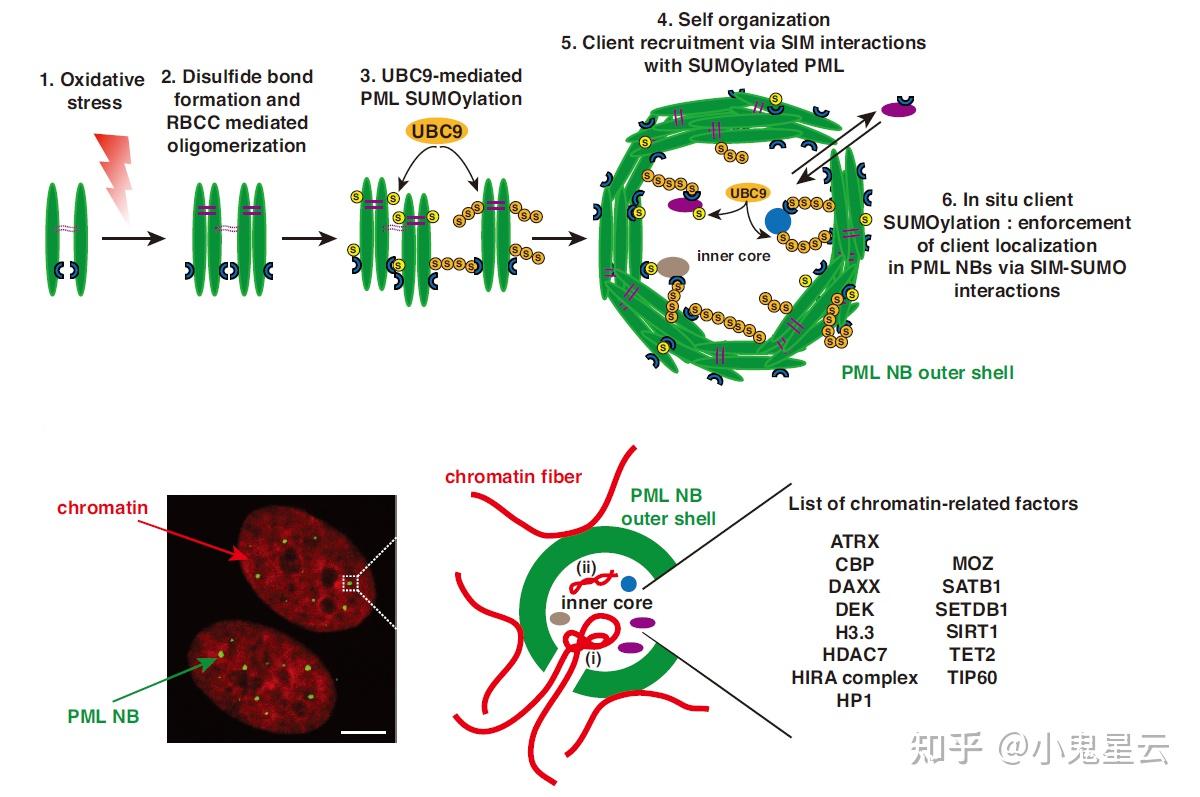
PML-NBs的发生模型。
核旁斑(paraspeckle)[7]
可能是个真正的冷门细胞器,因为总体上看研究得并不多。含有lnc-NEAT1和核心蛋白NONO、SFPQ、PSPC1等,已鉴定的核旁斑成分可见维基词条中的详表。位于许多真核细胞核内,其功能推测是通过液-液相分离(LLPS)机制“围困”RNA或蛋白质分子使其不能发挥功能、不能进入细胞质(核内滞留)或者不能进一步加工;此外还与调节基因表达、RNA剪接有关,但具体机制都有待阐明。
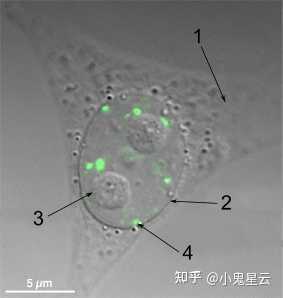
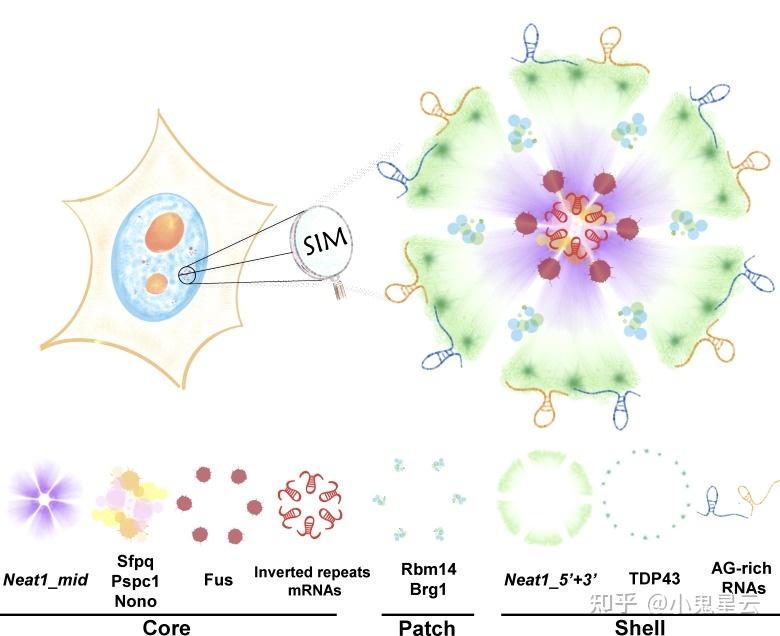
核旁斑的结构组织模式。
Cajal小体和剪接体[8]
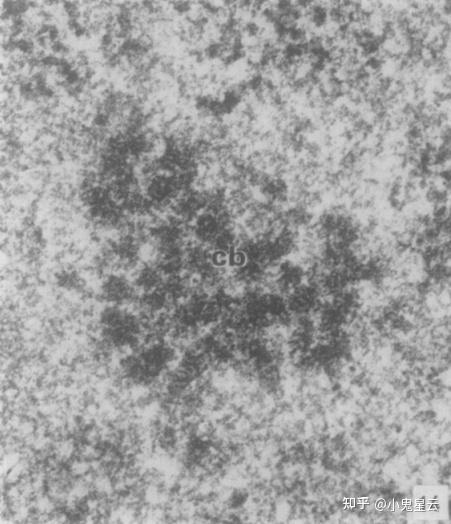
Cajal小体以发现该结构的Santiago Ramón y Cajal(1903)命名,又称盘曲小体(coiled body),简称CBs。之所以称作“盘曲小体”是因为在早期的形态学观察中,描述其内部结构就像盘曲的线团(coiled thread)一样(下图1[9]),直到1999年,才把一批在酵母、哺乳动物和植物中观察到的相似结构一并命名为Cajal小体(Cajal音“卡哈尔”)。
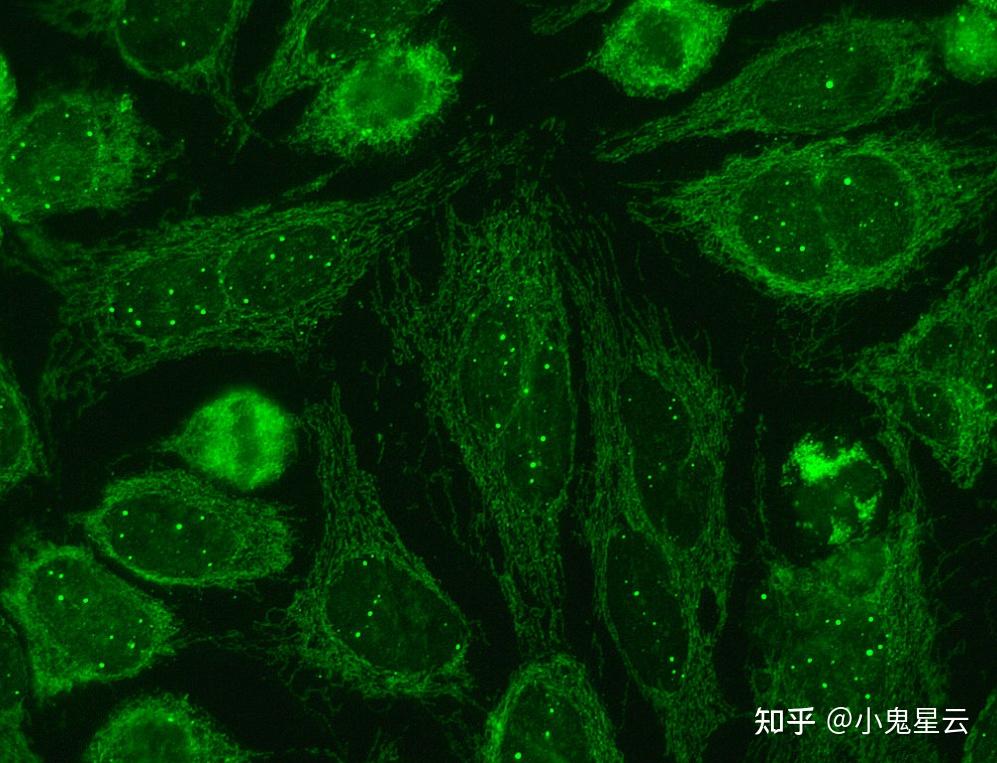
Cajal小体的分布范围局限,仅见于神经元和增殖或代谢活跃的细胞,如肝脏、胚胎和癌细胞等之中,就算这些细胞也不是每个都有。大小0.1 ~ 2.0 μm,无膜,最初被Cajal记录为神经元细胞核中嗜银的核仁附属颗粒,后来鉴定出盘曲蛋白(coilin/p80)作为Cajal小体的标志物(下图2[10]),有功能的盘曲蛋白也是有功能的CBs的必要条件[11]。
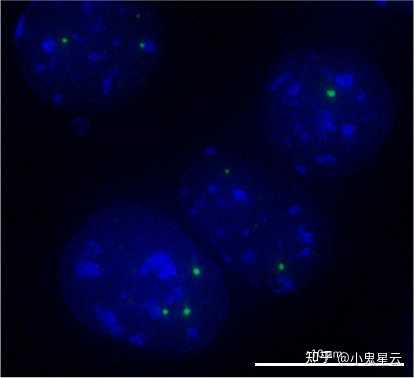
盘曲蛋白-GFP融合蛋白,将Cajal小体显示为细胞核中的绿色小点。
为了理解CBs的功能,需要先介绍一下「剪接体」(spliceosome)。一般读者很容易熟悉内含子和外显子,却对剪接过程一概不知,因为剪接过程实在是太复杂了。
剪接体的主体是一系列含有核内小RNA(snRNA)的RNPs:U1、U2、U5 snRNP和U4/U6 di-snRNP;(U4 snRNA和U6 snRNA部分互补配对而相互结合着,所以下面提到的U4/U5/U6 tri-snRNP的一个更标准写法是:“U4/U6.U5 tri-snRNP”。)U1~2, 4~6 snRNA被称为剪接体snRNA,而U3 snRNA与rRNA的加工有关,U7 snRNA与组蛋白mRNA 3&#39;端处理有关。另外,U6和U6atac snRNA是由RNA聚合酶III转录的,属于Lsm类snRNA,有5&#39;-γ-磷酸一甲酯(5′-γ-monomethylphosphate)帽,其特殊之处在于其对应snRNP的组装不是依赖Sm复合物,而是Lsm复合物,而且是直接在细胞核内,而不像其他snRNP那样在胞浆中进行组装;而其他的snRNA属于Sm类snRNA。之所以使用“Ux”标记因为它们富含尿嘧啶。其他snRNA还有U11和U12和U4atac,它们同U6atac和U5构成次要剪接体的snRNA[12]。
参与剪接循环的蛋白数量甚大,超过100种,剪接体是真正的巨型分子机器。
剪接循环(附图)[13]:
剪接信号的识别:U1 snRNP借助剪接因子ASF/AS2识别并结合在5&#39;-剪接信号(splicing signal, SS)即GU,其中U1 snRNA与5&#39;-SS互补配对。
E-复合物组装:U2辅助因子即U2AF复合物(U2AF65/U2AF1和U2AF35/U2AF2)识别并结合3&#39;-SS即AG、剪接因子SF1识别并结合分支点序列(BPS),此外还附带一些其他的剪接因子,形成E-复合物(E: early),或者称定向(commitment)复合物。
A复合物/前剪接体形成:U2 snRNP被招募至分支点序列(BPS),SF1被排除离开分支点,此步耗能(Prp5和Sub2/UAP56催化)。此时叫做A-复合物,也即“前剪接体”(pre-spliceosome),U2 snRNP与BPS紧密结合,其中U2 snRNA与BPS互补配对,但U2 snRNA中的一个假尿嘧啶(Ψ)使配对双链处于一种独特的构象,使得BPS中的一个腺嘌呤(A)核苷酸残基的2&#39;-OH处在一个有利于剪接反应发生的位置上。
B-复合物:U4/U5/U6 tri-snRNP在Cajal小体中组装,随后在Spf30的协助下装载,从而第一次形成完整的剪接体(前B-复合物)。然后在水解ATP(Prp28)的推动下,各snRNPs发生一连串位置重排,U1 snRNP被U6 snRNP排除出原来的位置而解离(耗能),最终B-复合物形成。
B*-复合物/剪接体的激活:U4 snRNP解离(耗能,Brr2催化),使U6 snRNA的分子内茎环(ISL)被释放出来,从而参与到剪接反应的活性中心的组成中。在这个过程中招募20余个蛋白组成十九复合物(nineteen complex, NTC)和NTC相关复合物(NTR)。NTC和NTR有稳定活性中心之构象的作用。在此之后,经过一步耗能反应(Prp2和Spp2催化),将SF3a复合物、SF3b复合物(此二者在E-复合物形成时被招募,可能在U2 snRNP招募和3&#39;剪接信号识别有关)、RES复合物和NTC的两个亚基Cwc24和Cwc27从剪接体上解离,使得BPS可以靠近活性中心。剪接体的激活完成,称为B*-复合物。
亚基组成:
- NTC复合物的核心组分包括Prp19/Cwf8、Cef1/Ntc85/Cdc5、Syf1/Ntc90/Cwf3、Syf2/Ntc31、Syf3/Clf1/Ntc77/Cwf4、Snt309/Ntc25/Spf27/Cwf7、Isy1/Ntc30和Ntc20,此外还有近20个NTC相关蛋白,复合物的名称源自于其中的一个亚基Prp19;
- NTR复合物的核心组分包括Prp45、Bud31、Ecm2/Cwf5、Cwc2/Cwf2、Cwc15/Cwf15、Prp45和Prp46/Cwf1等。(NTC和NTR二者的组成高度动态,无法列出完整的组分名单。)
- SF3a复合物包括SF3a60、SF3a66和SF3a120等。
- SF3b复合物包括SF3b14、SF3b60、SF3b66、SF3b155、SF3b145和SF3b10等。
- RES复合物包括Bud13、Pml1和Snu17等。
是不是看得头都大了?
C-复合物与P-复合物/剪接反应:在I步剪接因子Cwc25和Yju2的协助下,分支点腺苷酸(A)残基的2&#39;-OH对5&#39;-SS GU中的G发起亲核进攻,形成套索中间体,于是5&#39;-外显子被释放,此时称C-复合物。然后再次发生位置重排(II步剪接因子:Prp18和Slu7),3&#39;-SS进入活性中心,切断并连接两个外显子。此时称为P-复合物(P: post-catalytic)。
剪接体解体:外显子在Prp22的介导下释放,此时称内含子套索剪接体(intron lariat spliceosome, ILS),ILS在Prp43的介导下进一步解体。U4、U5、U6 snRNPs随后重新进入Cajal小体。
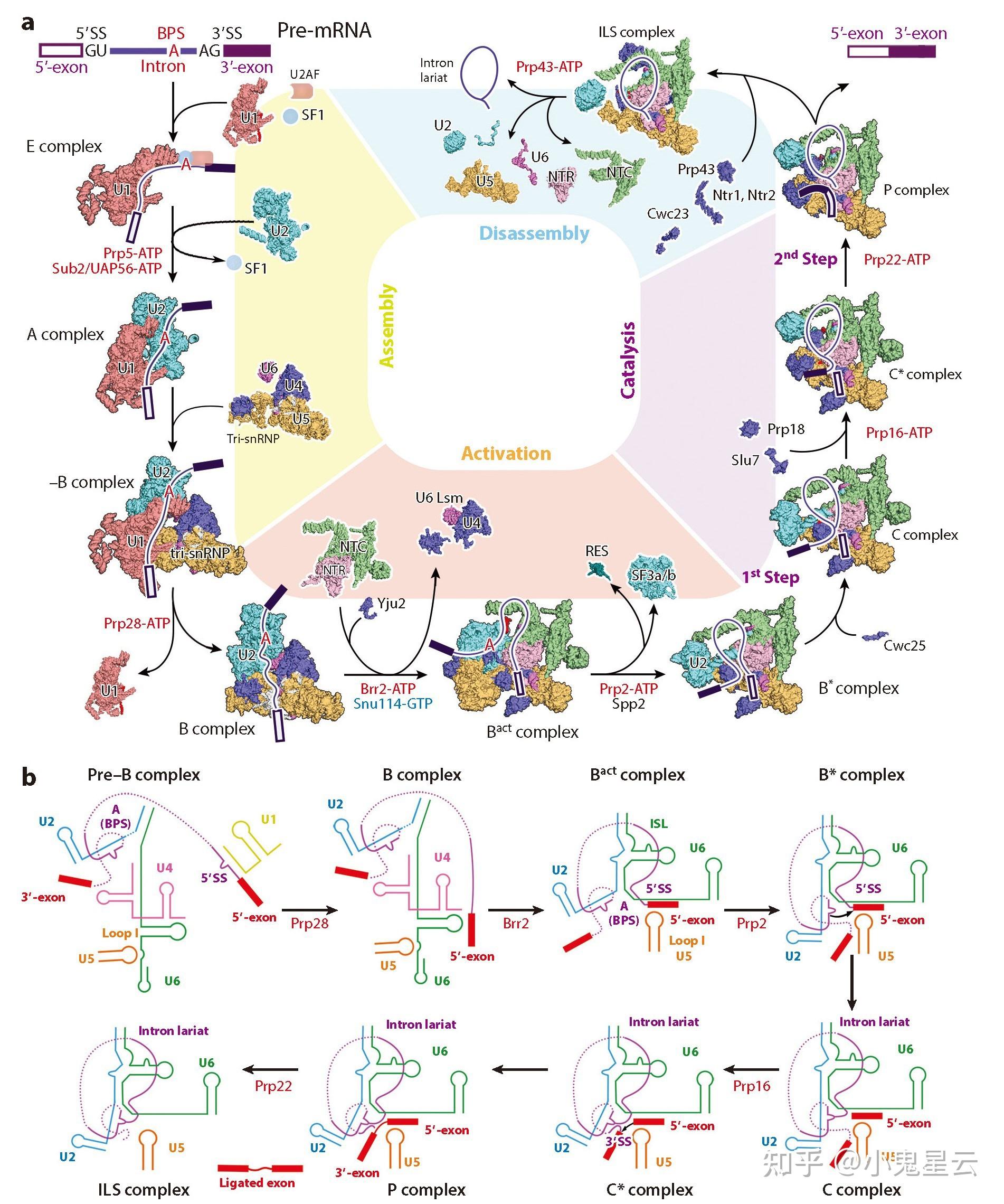
剪接循环
U1、U2、U4、U5 snRNAs在合成后进行m⁷G加帽并外输至胞浆,并在环形的Sm复合物(由三组亚复合物构成:SmB(B&#39;)-SmD3、SmD1-SmD2、SmE-SmF-SmG)的介导下组装为相应的snRNPs。
而这个过程又受到另一个复合物的协助,称为SMN复合物(SMN: survival of motor neurons),因发现SMN突变或者SMN水平过低或缺失,是脊髓型肌肉萎缩症(SMA)的致病基础。
SMN的核心蛋白包括SMN/gemin1,以及Gem相关蛋白Gemin2~8和unr互作蛋白unrip,SMN复合物一般还会进一步寡聚,在胚胎组织中称为“Gem小体”,于是SMN也是Gems的标志蛋白,此时在Cajal小体中则通常不容易检测到SMN。
SMN复合物招募PRMT5复合物(pICln、WD45/MEP50和PRMT5,PRMT是II型精氨酸甲基转移酶),催化Sm复合物几个核心蛋白(B(B&#39;)、D1和D3)发生「精氨酸对称二甲基化」即sDMA修饰,可促进完整功能性的Sm复合物的形成,以及随后U snRNP的组装。此外,SMN招募TGS1/PIMT甲基化酶,该酶将U snRNA的m⁷G帽子甲基化,成为三个甲基的2,2,7-m₃G帽子,这个帽子对snRNP的稳定性和回输细胞核至关重要。值得注意的是,在整个snRNA的生命周期中,只出这一次细胞核。回输细胞核的过程中SMN复合物会与snRNP相伴,SMN与盘曲蛋白直接互作,将snRNP送入Cajal小体,在Cajal小体内部,SMN与snRNP解离。之后去向不明,可能是回到细胞质中。
SMN蛋白的Tudor结构域与盘曲蛋白中被sDMA修饰的RG模体互作,这种互作模式十分保守,Tudor结构域失活可引起SMA。上面提到被PRMT5复合物,或者被甲基化小体(methylosome)[14]进行sDMA修饰的SmB(B&#39;)、D1和D3,其修饰也发生在RG模体中。此外还包括hnRNPs U, R, Q、核仁蛋白nucleolin、核仁纤维蛋白fibrillarin、GAR1(被I型精氨酸转甲酶PRMT1进行不对称二甲基化(aDMA)修饰,另外PRMT1位于细胞核而不是胞浆中)、EWS、RNA解旋酶A等,于是也相应地检出SMN与之相互作用。
在CBs内,已确知会发生的事件包括[15] [16]:
- U2 snRNA组装为U2 snRNP,并与SF3a和SF3b复合物附着在一起;
- U4/U5/U6 tri-snRNP的重新组装(剪接循环)和从头组装(snRNA转录之后);
- U snRNA的2&#39;-O-核糖甲基化和假尿嘧啶化,这种修饰需要scaRNAs(small Cajal body RNAs)的参与,后者的作用是将修饰酶引导至靶向的序列。scaRNA无论从结构还是作用模式都类似snoRNA即核仁小RNA,如box C/D snoRNAs也引导一种甲基化酶(含有核仁纤维蛋白),box H/ACA snoRNA也引导一种假尿嘧啶合酶(含有GAR1)。而snoRNA在进入核仁以前,也在CBs中进行2&#39;-O-核糖甲基化和假尿嘧啶化。连端粒酶RNA也存在于CBs中,至于干什么目前不清楚。
- U7 snRNP的成熟似乎也可能发生于CBs中,这个过程需要U2 snRNP的参与,另外发现CBs经常与组蛋白基因簇相互作用,但这个过程有太多细节不明。
下图[16]总结了CBs与剪接过程的关系:
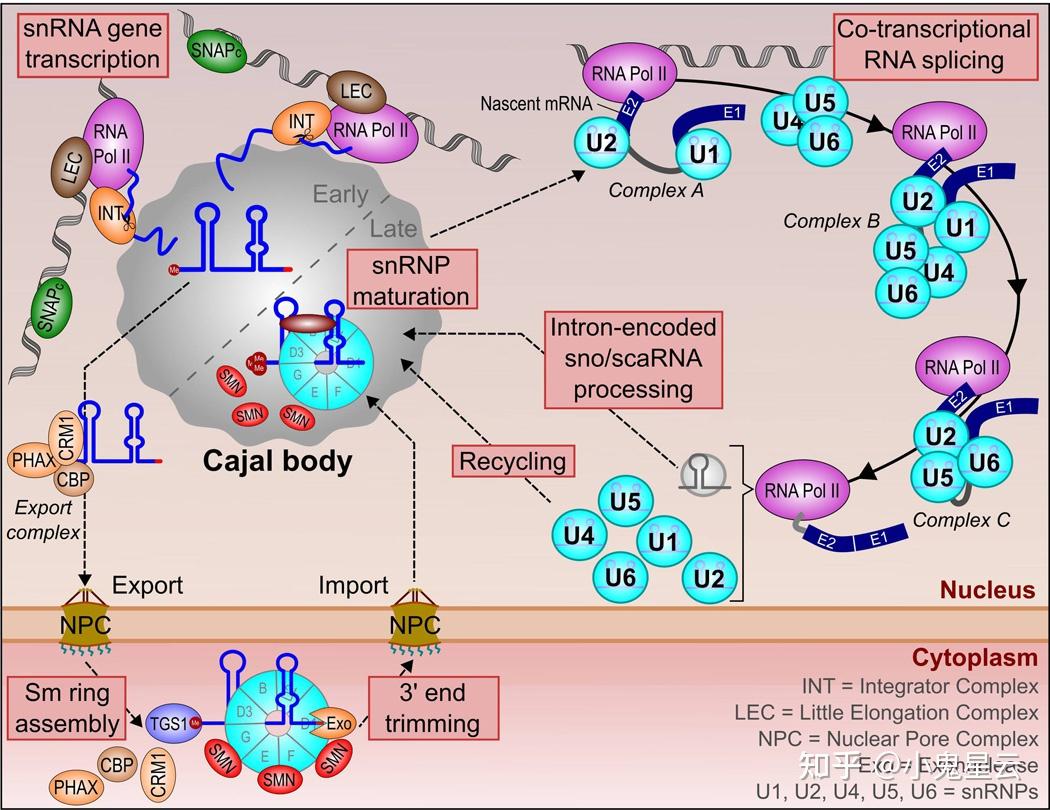
尽管如此,一般认为Cajal小体只是提高了有关过程的效率,而不是这些过程必须的。就连盘曲蛋白本身其实也只有很小一部分定位于CBs中。双敲盘曲蛋白的小鼠仍能存活,生活力轻微下降,对比之下,双敲SMN对小鼠来说是胚胎致死的。
突触带(synaptic ribbon)
又叫突触体或者稠密体(dense body),是带状突触(ribbon synapse)中特化的细胞器,或者说两者是相互锚定的概念。
突触带是平板一样的结构,厚度35nm,而长宽可达(1 ~ 2)μm × (0.2 ~ 0.4)μm,锚定在带状突触的活化带(active zone)上,其上挂满了内含神经递质的囊泡(下图1[17]),使得带状突触终末可以储存的囊泡比一般突触要多得多,可达数千甚至上万个。平板状结构的核心(也是几乎唯一的)蛋白组分为Ribeye,其他蛋白组分参与悬挂递质囊泡、锚定在活化带上等(下图2[18])。
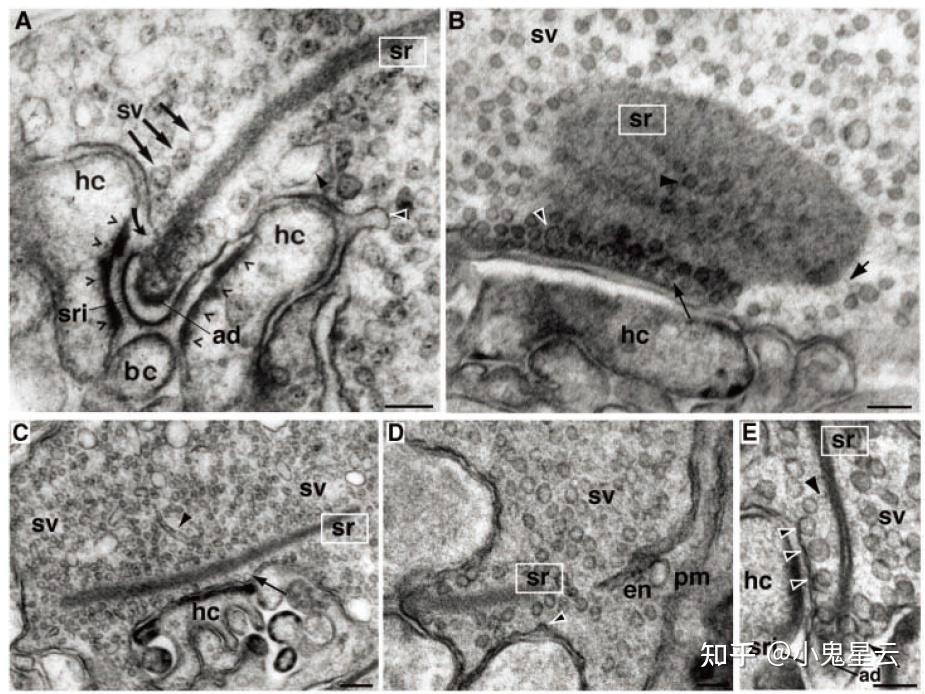
透射电镜图像。要成功捕捉到突触带,切片的功夫得讲究一下。
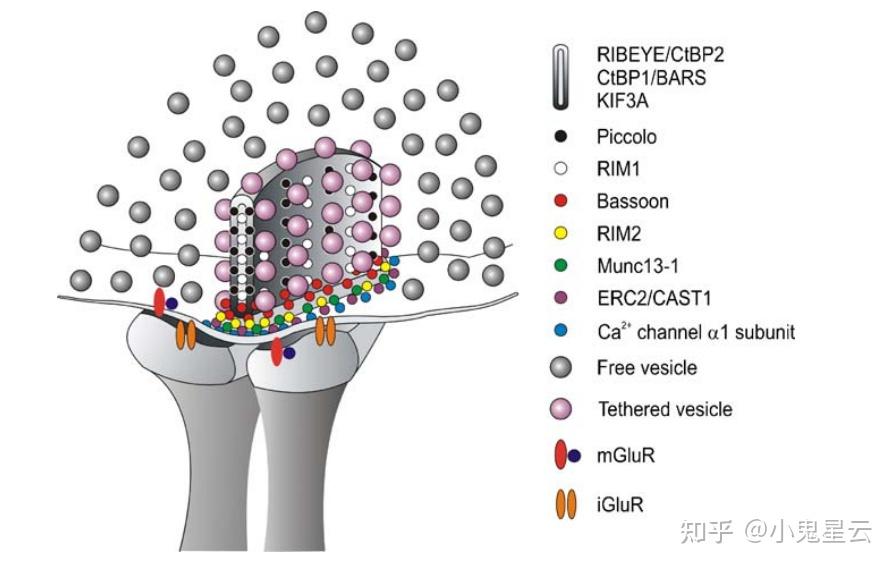
突触带的结构模式。
带状突触的分布极为局限,几乎仅在光受体(视杆和视锥)细胞、内耳毛细胞和前庭细胞的终末等处发现。与神经递质一般的释放方式不同,带状突触能够支持(尽管并不一定)以持续性恒定高水平模式释放大量的递质,这跟视锥细胞和毛细胞传递光声信号的工作方式有关。突触带结构也是相当动态的,例如在光受体细胞中,有光时突触带就倾向于解体,黑暗时就倾向于组装。
蛋白酶体(proteasome)[19]
蛋白酶体的功能就是专职降解胞浆中的蛋白质,与泛素(ubiquitin)和E1~4泛素连接酶一起构成「泛素-蛋白酶体降解(UPD)途径」。
泛素对于要被降解的蛋白来说,是一种标记,细胞就是这样实现选择性地降解那些要被降解的蛋白。蛋白酶体是个非常古老的细胞器,各个域的生物中都发现了,在古菌叫做PAN复合物(PAN: proteasome-activating nucleotidase)。
结构上,蛋白酶体包括核心颗粒(core particle, CP, 20S)即“绞肉机/滚筒洗衣机”催化亚基α₁₋₇β₁₋₇β₁₋₇α₁₋₇,和调节颗粒(regulatory particle, RP, 19S, 700~900kDa),RP的组成和结构相当复杂,其亚基也包括两组即RPT和RPN,RPT1~6是AAA+家族ATP酶,是「去折叠酶」(unfoldase),是“基座”(base)的主体;RPN中的大多数亚基是“盖”(lid)的主体,承担着识别泛素标记、移除泛素标记、结构支架之类的作用。
引入了蛋白酶体亚基的系统命名规则之后,蛋白酶体的亚基被分为几个组/家族:PSMA、PSMB、PSMC、PSMD、甚至PSME/F/G。PSMA就是核心颗粒的α亚基,PSMB是β亚基,RPT是PSMC,RPN是PSMD。PSME1~4分别对应PA28α~γ和PA200,是11S调节颗粒的组分,它们的作用是激活核心颗粒的酶活。
另外在免疫细胞中高表达「免疫蛋白酶体」(immunoproteasome),其与一般蛋白酶体的区别在于几个β亚基的不同,即β1, 2, 5替换成了β1i, 2i, 5i,延续PSMB的编号,分别称为PSMB9, 10, 8,其在基因组中的位置与编码MHC-I及MHC-II和TAP1/2的基因比较接近。免疫蛋白酶体的作用是处理抗原蛋白产生肽段以供MHC-I提呈,即「内源性抗原」的「胞质溶胶提呈途径」。
此外皮质胸腺上皮细胞还表达一种「胸腺蛋白酶体」(thymoproteasome),与一般蛋白酶体的区别是β5替换成β5t即PSMB11,作用不明,仅知道其对CD8⁺T细胞发育成熟非常关键。
2002年曾有一篇文章提出破碎体(clastosome)这个概念[20] [21],指的是一类富集着蛋白酶体、泛素、PML蛋白和有关底物的核内结构,似乎是细胞的蛋白降解活动高度活跃时通过某种机制把蛋白酶体富集而成的0.2–0.5 µm大小的隔室,而通常并不会出现在正常细胞中。类似地,剪接体富集时似乎也能形成核小点(nuclear speckle)这样的核内器(尽管剪接体本身已经非常庞大了),虽然核小点的结构比破碎体复杂得多。
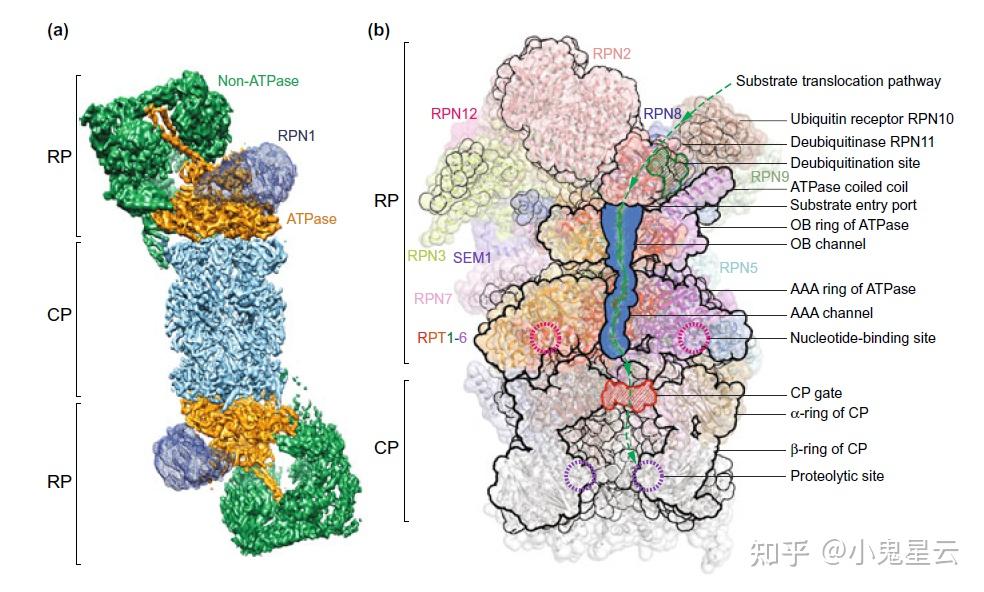
26S蛋白酶体概览。
中介体复合物(mediator)
中介体是最有名的转录共激活物(co-activator),参与增强子介导的转录调控,在增强子和RNA聚合酶II之间充当桥梁的角色,故名;另外还与粘合素(cohesin)一同参与调控染色质空间结构的组织,与粘合蛋白的互作和调控染色质空间结构现在成了中介体复合物功能中一个非常热门的研究方向[22] [23] [24]。酵母中介体有20个亚基,分子量~80万,哺乳动物的大些,有26个亚基,分子量~1.4MDa,亚基的系统命名采用[Med+编号]。
如果算上在整个「前起始复合物」(PIC)中,包括RNA聚合酶II完整的复合物的20左右个亚基,以及增强子和多种多样的转录激活子,整套机器可以变得异常庞大。
一般把中介体分成3个模块(module),即头部(head)、中部(middle)和尾部(tail)。头部和中部与RNA聚合酶II相互作用;而尾部的空间构象柔软多变,结合转录激活子。其中Med14和Med17是两个主要的支架蛋白,将三个模块紧密套接。在人类的中介体中至少9个亚基共同形成一个α-螺旋束作为中介体的骨架。另外还有一个中介体激酶模块(MKM),这个模块包含细胞周期素(cyclin)C、细胞周期素依赖性激酶CDK8(脊椎动物中是CDK19)、Med12和Med13,结合并不牢固,可解离,算上MKM就是中介体唯一有催化活性的部分,其底物谱很广,其中就包括一众转录因子(TF),MKM和中介体自身以及RNA聚合酶II,考虑底物的多样性,中介体的作用就变得更加复杂了。
另有意思的是,有人发现Med1跟溴结构域蛋白Brd4大量富集引起相分离形成大液滴,并富集转录机器,介导超级增强子调控基因表达的过程[25]。这种较为均质的大型液滴,大也可看作一种动态的细胞器,在细胞内非常多见。
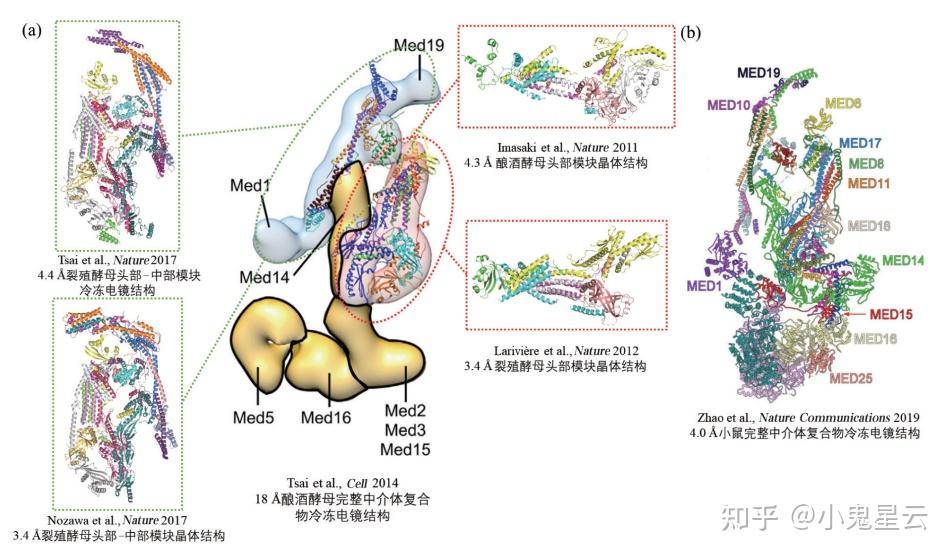
中介体复合物的冷冻电镜解析结构。
现在有关液-液相分离的研究和理论模型相当繁多,并且医学界和工程界已经在向调控甚至在细胞内有目的地引发、组装具有一定功能的相分离液滴进发了[26]。
更小、结构或功能更加不寻常,或者只在病理条件下出现的细胞机器。如:
- Ccr4-Not复合物:多功能、保守、必不可少;催化活性包括mRNA去除poly(A)尾以及E3泛素连接酶,另外还参与mRNA降解的许多其他环节,包含10余个亚基。
- 炎症小体(inflammasome):介导病原/损伤/危险相关分子模式(P/DAMPs)引起的炎症。
- 程序性死亡小体(apoptosome/necrosome/PANoptosome):即凋亡小体、坏死小体和泛凋亡小体,分别是介导细胞凋亡(apoptosis)、程序性坏死(necroptosis)和泛凋亡(PANoptosis)的分子平台。
- 细胞周期体/复合物(cyclosome/APC, anaphase-promoting complex):实质是E3泛素连接酶,给保全蛋白securin、细胞周期蛋白cyclin S和M加泛素,使其被降解,引起姐妹染色单体分离,细胞分裂从中期进入后期。
- TERX/TREX-2-EJC复合物:介导mRNA出核的接头蛋白,有些与剪接体重叠。
- Barr小体:高度异染色质化、转录沉默和挛缩的整条X染色体。仅见于女性和克林菲尔特综合征。
- 很多AAA+ATPase家族蛋白都会形成大型六/七聚体,以及进一步寡聚形成更大的机器,且往往执行非常保守的功能。如:Cdc48复合物、GroEL-GroES(真核生物中称Hsp60-Hsp10)等。
- 一些分子量巨大且多亚基的酶。
- 其他。
还有很多巨型机器存在于膜上,比如植物中的光系统、呼吸作用中的电子传递链复合物、核孔复合体(NPC),都是几十上百个亚基,分子量都在MDa以上。
总的来说,只要各位愿意探索,这些巨型分子机器都很有趣。 |
|
 /3
/3 