金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
0/注意点:
1、文章由于出版格式的问题,逻辑上可能出错,需要自己调整顺序以符合逻辑。
2、讲出为什么前人没有成功而他成功了
文章标题:
Intraoperative brain cancer detection with Raman spectroscopy in humans (2015)
1/ PI lab
Michael Jermyn最近在干嘛?
Michael Jermyn近年发表文章统计(在17年后主要研究成像技术,发文数量减少)
Cherenkov imaging(成像技术研究radiation therapy incidents)
16年:Neural Networks Improve Brain Cancer Detection With Raman Spectroscopy In The Presence Of Light Artifacts
Spectroscopic Imaging System For High-Throughput Viability Assessment Of Ovarian Spheroids Or Microdissected Tumor Tissues (Mdts) In A Microfluidic Chip(光谱成像技术研究)
麦吉尔大学神经内科和神经外科脑肿瘤研究中心
Kelvin Mok:
Kelvin Mok近年发文统计
neuro-navigation guidance
2/why? background补充背景信息
Diffusely invasive brain cancers:
locally invade the normal brain, generating a decreasing gradient of cancer cells that extends from the main cancer mass into healthy tissue. These invasive cancer cells cannot be detected using the technologies that are currently used clinically. ( )
3/做了什么,目标是什么?
4/结果是什么?抓关键key result 因为很多情况下result比较多,但核心的就一个
5/你认为作者做出的创新是什么?
6/作者做出了创新,so what?-介绍这个创新带来的意义与影响
7/你的展望,你认为这个研究有何局限性,你认为可以如何进一步优化?
文章各段结构:
INTRODUCTION:
第一段
1.Diffusely invasive brain cancers的情况,WHO分型 2. MRI--preoperative/unable todetect thefull extent of cancer cell invasion and suffers from inaccuracies 3.A newer fluorescence-guided approach ---只能标记GBM,但 limitations in its ability to detect grade 2 gliomas and the invasive cancer cells
第二段
1.不能全部的看到所有invasive brain cancers导致-- 次全手术切除术(解释:甲状腺次全切一般指只切除一部分甲状腺组织,主要包括病变腺叶及甲状腺峡部。 全切是切除全部甲状腺组织,包括两侧腺叶、甲状腺峡部,并进行淋巴结清扫 ); 再加上没有有效的化疗与放疗方法2.一些术后的影像学研究表明术后剩余的癌症细胞数量直接影响---癌症的复发/survival for all grades of invasive gliomas3.相反的,对正常脑组织的切除导致神经损伤.因此,神经外科可以从外科工作流程中引入的补充技术(本文的成果)中受益匪浅,这些技术不仅可以检测致密癌,还可以检测肿瘤周围和肿瘤边缘以外的浸润性癌细胞
第三段
目前在脑肿瘤切除中的进展--超越一般MRI探测效果的技术手段/术中及时效果评估--术后剩余的癌症细胞数量
1.氟乙基酪氨酸正电子发射断层扫描-Fluoro-ethyl-tyrosine positron emission tomography-showing greater sen sitivity than MRI for cancer invasion, with 88% sensitivity for detecting grade 3 to 4 gliomas, but with 54% sensitivity for lower-grade gliomas
2.超声(US)和光学相干断层扫描(OCT)等方式已被证明可以实时提供结构信息 provide structural information
in real time 但是 超声不能检测显微镜下的浸润unable to detect microscopic invasion
OCT跟术中共聚焦显微镜confocal microscopy,在一些病例研究中显示出效果,very promising,yes? 但:statistical power/equirementforacontrastagent/he need for surgeons to interpret complex, depth-resolved microscopy images ----not convenient
附-OCT原理/共聚焦显微镜原理
第四段
Raman spectroscopy:
拉曼光谱是一种非侵入性的方法,它基于入射光的弹性散射产生的分子特征来给出光谱组织特征。当光与物质相互作用时,发生非弹性散射,但其相对重要性被包括弹性散射和吸收在内的竞争现象所削弱。因此,在与神经外科工作流程兼容的时间框架内测量拉曼效应是一个挑战,需要复杂的光学技术,包括超稳定的单色光源,高灵敏度和高速光谱传感器,以及干涉光过滤方法。
通常Ramanspectroscopy is used to observe low-frequency vibrational modes in a system.
附-拉曼光谱的原理
第五段
拉曼光谱最早是由Haka et al.引入的for breast cancer margin detection
该技术已经被用来探测其他癌症,且敏感度较高:
for the detection of precancerous cervical lesions with a sensitivity of 82% and a specificity of 92% (22), and for the diagnosis of bladder can cer with a sensitivity of 85% and specificity of 79% (23).
在外科手术中,拉曼光谱的应用集中于离体活体啮齿类监测,例如小鼠的胶质瘤侵袭
第六段
作者干了啥?:
测试了一种术中基于拉曼的探针技术,用于实时检测患者的侵袭性脑癌。我们证明拉曼光谱在人脑癌手术中可以准确地检测体内2 - 4级胶质瘤,能够区分侵入大脑的癌细胞和正常大脑,灵敏度和特异性均>90%。
wetested an intraoperative Raman-based probe technique to detect invasive brain cancer in situ in real time in patients. We demonstrate that Raman spectroscopy can accurately detect grade 2 to 4 gliomas in vivo during human brain cancer surgery, with the ability to distinguish cancer cell invaded brain from normal brain, with sensitivity and specificity of >90%
这些成果是通过手持式接触式拉曼光谱探针照射直径为0.5 mm的组织区域完成的,采样深度为~1mm,采集时间为0.2 s。该技术被整合到神经外科工作流程中,用于实时识别浸润性癌症,其灵敏度超出了当前的成像能力。
RESULTS:
结果1.A handheld Raman spectroscopy probe
这个探头probe有啥特色?:探针包含光纤电缆,连接到发射波长为785纳米近红外光谱稳定激光器。
连接了高速高分辨率电荷耦合器件(CCD)光谱探测器/ The laser/computer
探测范围:The spectra covered a range of shifts from 381 to 1653 cm−1, with a spectral resolution varying between 1.6 and 2.1 cm−1.
附-啥是CCD:一种固态的固态成像器件(光电检测器)Denton与其同事们是将电荷耦合与电荷注入检测器(Charge-Coupled Detector and Charge-Injection Detector,简称CCD与CID)用于原子光谱分析的主要推动者。在这两种装置中,由光子产生的电荷被收集并储存在金属-氧化物-半导体(MOS)电容器中,从而可以准确地进行象素寻址而滞后极微。这两种装置具有随机或准随机象素寻址功能的二维检测器。可以将一个CCD看作是许多个光电检测模拟移位寄存器。在光子产生的电荷被贮存起来之后,它们近水平方向被一行一行地通过一个高速移位寄存器记录到一个前置放大器上。最后得到的信号被贮存在计算机里。CCD器件的整个工作过程是一种电荷耦合过程,因此这类器件叫电荷耦合器件。
我们知道---当入射光与物质相互作用时,会发生两种主要类型的散射:弹性散射和非弹性散射。弹性散射,也称为Rayleigh散射,是指光子在物质中传播时,仅改变方向而不改变频率的散射过程。而非弹性散射,也称为Raman散射,则是指光子在物质中传播时,不仅改变方向,还改变频率的散射过程。而且前者一般比后者小几个数量级,
实际应用中呀,探头接受到的有1、tissue inelastic scattering (我们要的)2、inelastic signal of the instrument itself 3、the elastic signal at the 785-nm excitation wavelength
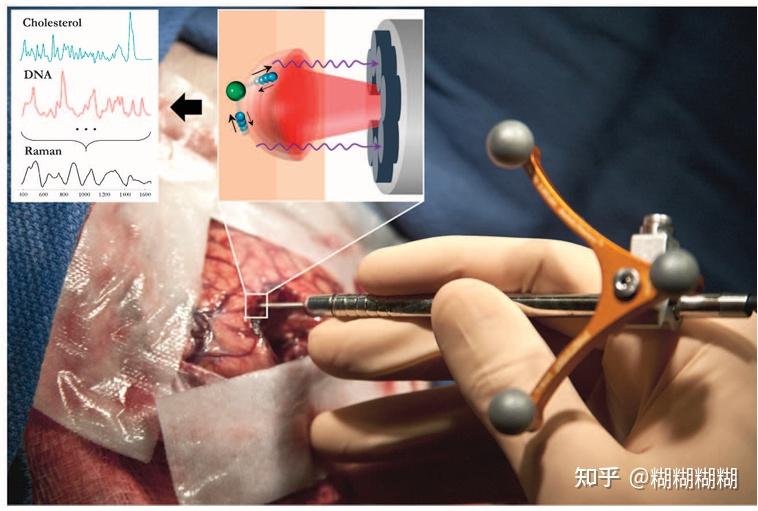
手术中使用探针,左上角的第一个示意图是胆固醇与DNA等分子激发后的谱线总和为样本的拉曼散射谱线(因为不同的分子有不同的振动模式),左上角第二个图则是演示近红外光使某分子激发后发出紫色的拉曼散射。
怎么解决?--在光纤的尖端加一个内嵌微米级的filter

拉曼显微系统 在右侧的探头细微结构中由下到上:LP filter,长通滤波器BP filter带通滤波器;aman collection fibers 指的是拉曼光谱收集光纤,7×300um core" 描述了光纤的核心尺寸,表示光纤的横截面由两个直径均为300微米的圆形组成,每个圆形有7条线用来引导和聚焦光束
效果怎么样?
总采集时间为0.2 s,三次拉曼光谱采集加上一次背景测量(无激光激发)。探头的圆形激光光斑直径为0.5 mm
sampling depth ofthe probeassociated with 95% ofthe Ramansignalcomesfrom the first ~1 mm beneath the surface(如下图,这个探头采集到的拉曼散射信号中95%都是从其下方1mm处得到的)
A signal-to-noise ratio of 15.8 was calculated for the system (信噪比)
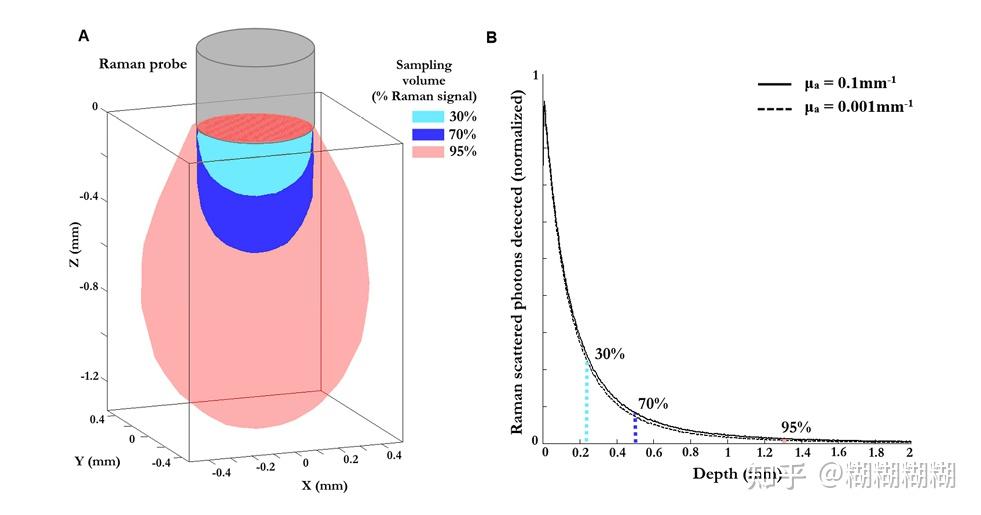
文章附件里的fig.S1
结果http://2.In vivo imaging protocol体内成像方案,protocol:a plan for performing a scientific experiment or medical treatment,重点在如何做的
在看到这个标题的时候我做好了接受一大堆机器学习以及图像识别算法的心理准备,结果。。。
用结果1的探头测量了来自17位患者的161个手术中的h WHOgrade2to4 gliomas神经胶质瘤样本
重点:interrogating (obtain message) brain regions both within the MRI-defined dense cancer and outside (up to1.5cm) of theT1-gadolinium enhancing and T2-weighted hyperintense regions in grade 2 to 4gliomas.
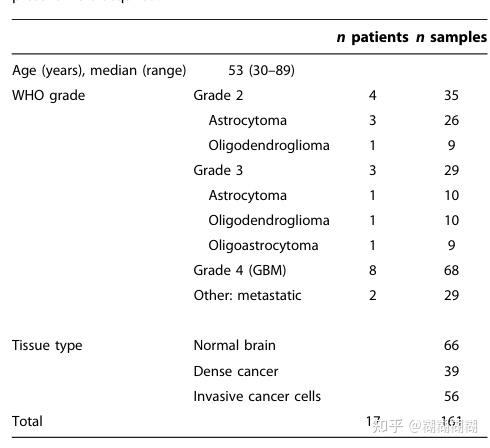
不同患者样本的组织学诊断,总共收集了161个
Astrocytoma:星形细胞瘤
Oligodendroglioma:少突神经胶质瘤
在这项测量中MRI信息仅仅定性地用于可视化和估计术前图像上每个拉曼测量的位置
例如:术前mri 2级和4级胶质瘤的拉曼光谱测量
用探针探测后活检并存档,用于术后与组织病理学分析。在161个探测点中,外科医生还根据组织外观(通过手术显微镜进行视觉评估)和导航数据(术前MRI空间配准手术视野),判断是否可能对应正常的大脑(癌细胞阴性)或癌细胞。基于组织学病理分析,每个样本被分类为正常脑(无癌细胞)、正常脑浸润有浸润性癌细胞(≤90%癌细胞)或致密癌(>90%癌细胞)如上表;
红色为preoperative T2-weighted MRI 技术得出的2级星形细胞瘤区域
几个点是采用拉曼光谱测量技术,对2级胶质瘤进行检测,识别为结果蓝色(正常)和黄色(癌症)点的位置。
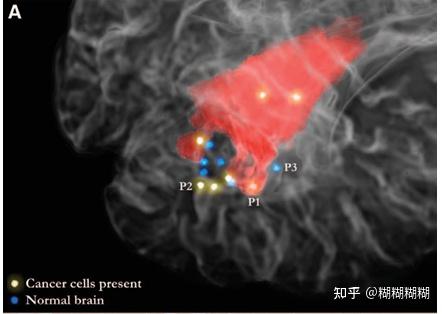
MRI技术进行可视化
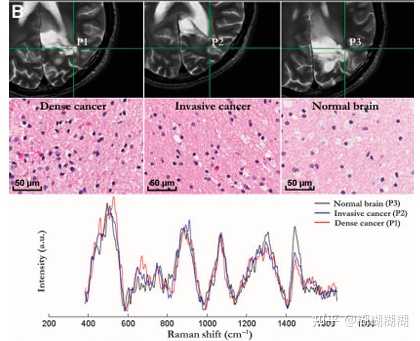
正常脑(无癌细胞)、正常脑浸润有浸润性癌细胞(≤90%癌细胞)或致密癌(>90%癌细胞)三类典型样本的样本位置、组织病理学图像、以及对应的拉曼光谱
到这儿我明白了,原来这个protocal创新之处就是MRI+RAMANshift呗。。。
而这个“+”就是基于结果1中的探头
结果3.Intraoperative Raman spectroscopy for real-time detection of brain cancer能够实时监测脑癌的术中拉曼光谱
与之前工作相一致的是:结果2中被分类的三种组织拉曼光谱的molecular signature有差异--在700和1142cm−1处的脂质带处
作者想更进一步:利用拉曼光谱仪中可用的所有光谱信息
we used the boosted trees machine learning method to analyze the spectra and determine classification criteria, al lowing samples from all cancer tissue categories to be separated from samples corresponding to normal brain 。
用了这个boosted trees machine learning method 效果还挺好:
distinguish normal brain from tissue with the presence of cancer cells 的能力,与传统外科医生使用明场显微镜和MR引导进行目视检查后的结果相比:

敏感性、特异性巴拉巴拉的定义
ROC曲线:
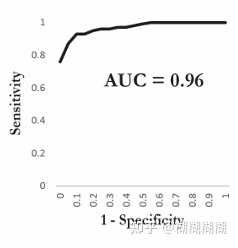
roc曲线医学信息学有讲过,稍等我查查哈
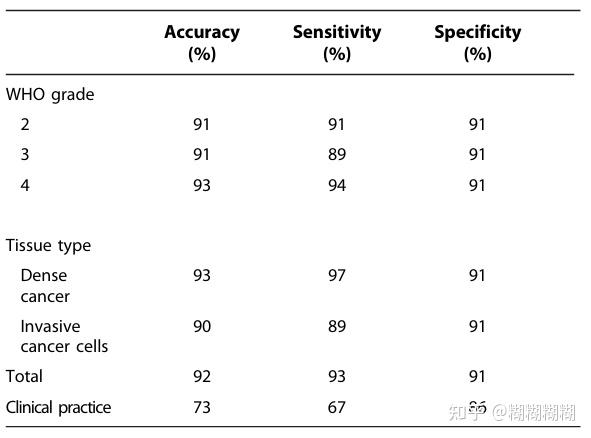
看最后两行,Total-使用作者的方法的结果;clinical practice-外科医生临床实践的结果
结果4.Cancer cell threshold癌细胞阈值
癌症细胞密度阈值
56 samples designated as normal brain infiltrated by invasive cancer cells中的14个癌细胞密度最低的样本
这十四个样本中有五个Ramanspectroscopy分类的假阴性(也就是raman分类的是阴性但是用HE染色后发现了癌细胞,实际上是阳性的)
对14个样本中的每个样本,在250mm×250mm的范围内标定区域,统计这些区域中的
The cancer cell count per area, the total cell count per area, and the cancer cell burden (cancer cell count divided by the total cell count)
这些假阴性的样本中 cancer cell burden小于15%,所以,本文中的拉曼探测装置可以探测的极限是
17 human cancer cells/0.0625 mm2.
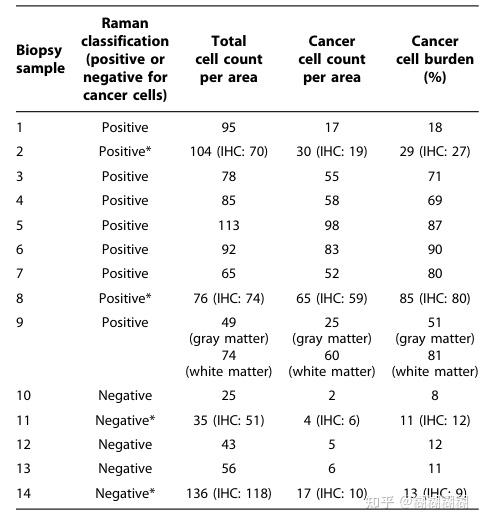
这14个样本的具体情况
discussion部分:
脑瘤的主要治疗目标是
1、最大限度地减少术后残留癌症的体积
2、延长生存期和缓解症状,同时尽量减少切除导致的神经损伤
要实现这一目标具有挑战性,因为2级至4级胶质瘤细胞具有高度浸润性,这表现为这些癌症不仅限于MRI对比剂摄取和/或T2高信号区域。
胶质瘤侵入MRI可见边界之外,在手术过程中使用常规技术无法检测到远处的癌细胞浸润
但是:我们的vivoRamanspectroscopy够厉害,iscapableofaccurate, sensitive, andspecifictissueclassificationofinvasive braincancersforgrade2to4gliomas.
怎么做到的呢:用到结果1的设备,能捕获反应0.5到1.5mm深度的的分子组分的信息,这个水平对于外科手术来说足够了
而且我们这个优点有:手持式拉曼探头很小,实时操作,方便脑癌治疗从而 可以快速地在医生诊断有疑问的部位进行肿瘤检测,无需进行活检和冷冻
这种细胞分辨率水平的检测超出了当前通过明视场神经外科显微镜、术中MRI和5-ALA–PpIX成像的视觉检查标准护理能力
拉曼光谱不需要使用外源化合物提供光学对比度,简化了临床使用。该技术的用途是为外科医生提供特定位置的快速癌症检测,特别是在白质纤维束浸润的情况下。从这些区域切除的组织通常使用显微解剖技术进行,并经常进行功能监测,这使得探头成为适合用于术中神经外科指导的工具。尽管具有高癌症检测准确性和易于使用的特点,该仪器本质上是受到相对狭窄的视野限制的(与神经外科显微镜相比),并且需要引入额外的仪器到手术工作流程中。因此,在胶质瘤手术中,有使用补充成像技术进行指导的潜力。5-ALA–PpIX荧光引导手术允许在GBM中通过与神经外科显微镜相同的视野识别大面积的肿瘤。荧光成像可以补充拉曼光谱对周围浸润的非增强位置的单点检测。
总的来说:
这项工作提出了一种用于体内术中快速识别浸润性脑癌的技术的准确性>90%,并为临床试验奠定了基础,以评估其在手术指导和早期胶质瘤检测方面的有效性,并使用标准护理技术。
MATERIALS AND METHODS部分
Studydesign部分主要讲怎么样取舍样本与对医生的盲实验验证,略去
HandheldcontactRamanspectroscopyprobe部分为了讲解通畅调整到了结果1.中,该研究的数据处理均采用matlab
Intraoperative optical data acquisition and tissue sample collection procedures部分讲的是使用MRI与probe探头测量样本的具体流程,略去
Statistical analysis and tissue classification部分:(感兴趣的可以了解)
对拉曼光谱的结果处理:
each corresponding spectrum 中background reference measurement was subtracted,为了环境光源相对应
之后光谱进行预处理:迭代四阶多项式来normalize for laser power and to remove intrinsic tissue fluorescence
选择The boosted trees method的原因:It is robust to noise in the training data as well as the test data, an important quality given the rarity of the Raman effect relative to background signal。此外even for a large amount of spectral information,这个算法也不会make assumptions about feature independence and performs consistently。(因为Raman shift太小了,背景噪声的剔除显得尤为重要)
作者对增强树算法的介绍原文在下面:
Boosted trees operates by constructing an ensemble of decision trees from training data. Each decision tree has a classification rule and operates on the residual of the classification determined by the previousdecision tree (33).Classification was appliedusingaleave one-out cross-validation approach. Cross-validation analysis was also used to determine the optimal number of decision trees for use in the classification, resulting in the use of eight decision trees. This was to avoid overfitting the data while maintaining sufficient complexity for proper classification. |
|
 /3
/3 