金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
WB,(Western Blotting),中文名蛋白质印迹,又称免疫印迹(immunoblotting),用于检测特异性目的基因表达的蛋白成分。比如说你要用大肠或者酵母表达某种目的蛋白,把基因克隆到宿主后,要检测的目的蛋白的表达就可以用western blot。总体来说有5个步骤,样品制备,蛋白电泳,转膜,封闭,抗体杂交,条带检测。
1. 样品制备
① 裂解:
细胞:弃培养上清,无菌 PBS 清洗 1-2 遍(去除细胞和培养皿表面残留的培养基,因为培养基中血清含有丰富蛋白质),加入细胞裂解液(80-100ul/60mm dish) 和蛋白酶抑制剂,置摇床上摇动裂解,注意随时观察。最好冰上裂解(摇床上放冰盒,培养皿放在冰盒中)。
组织:将组织块切割成合适大小,无菌 PBS 漂洗 1-2 遍,加入细胞裂解液和蛋白酶抑制剂,高速匀浆机匀浆(低温匀浆:装有组织块的 2ml 平底 EP 管外面套一个装满碎冰的小烧杯)或高通量组织破碎仪破碎(提前预冷裂解液,把破碎过程分成几段,缩短每一小段的破碎时间,破碎的间隙把装有组织的 EP 管埋在碎冰里降温几分钟,再接着下一小段的破碎过程)。最好低温裂解。
② 去除碎片(充分裂解细胞或组织后,会有一些细胞碎片没办法完全溶解在裂解液中,需要去除):4℃下 12000rpm 离心 10-20min,取上清。(离心后细胞碎片沉在管底,上清中是抽提出的蛋白)
③ 蛋白定量:BCA 法测定蛋白浓度后分装。
④ 蛋白变性:加 loading buffer,沸水浴煮 5min。(沸水浴容易把 EP 管盖冲开,为了防止污染,也可以用金属浴或 PCR 仪来使蛋白变性。)
⑤ 保存:分装变性后的蛋白质样品-20℃保存,长期保存-80℃。也可以一裂解完就冻存在-80℃,样品凑齐后再拿出来一起做去碎片、定量、变性等后续步骤。
推荐试剂:
捷倍斯(GBCBIO),Western 及 IP 细胞裂解液(G3423) 裂解 GBCBIO™ BCA Protein Assay Kit(G3522) 蛋白浓度测定,推荐用 96 孔板+酶标仪来做,省试剂(一孔 200ul BCA 工作液),省事省时间(酶标仪一扫,把数据贴到 excel 里,就能算出每个蛋白的浓度,还可以第一次计算时保存好模板,下次直接往模板里填数据就能得到各个浓度和每管分装体积)。
BCA 法标曲制作:(官方说明书操作较复杂,简化一下)试剂盒自带的 BSA 标准品浓度是 2ug/ul,设标曲梯度:准备 7 个孔,每孔依次加入 20, 19,18,17,16,15,14 ul 去离子水,0,1,2,3,4,5,6ul BSA 标准品,因此得到的标曲的蛋白点就是 0,2,4,6,8,10,12ug (可以覆盖普通裂解液蛋白抽提范围,超高浓度的蛋白不适用)。
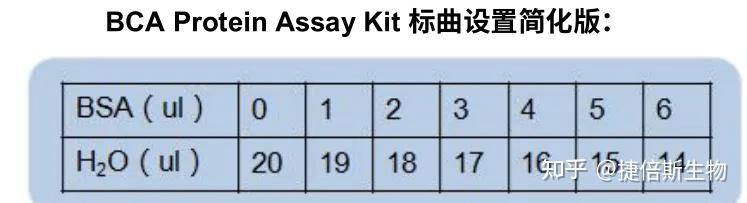
图源:https://blog.csdn.net/zea408497299/article/details/125289061
捷倍斯(GBCBIO),5X SDS-PAGE loading buffer(Odorless)(4552) 蛋白变性,蛋白沉底好,不容易飘,上样顺畅。
2. SDS-PAGE 胶制作及电泳分离
2.1 灌胶
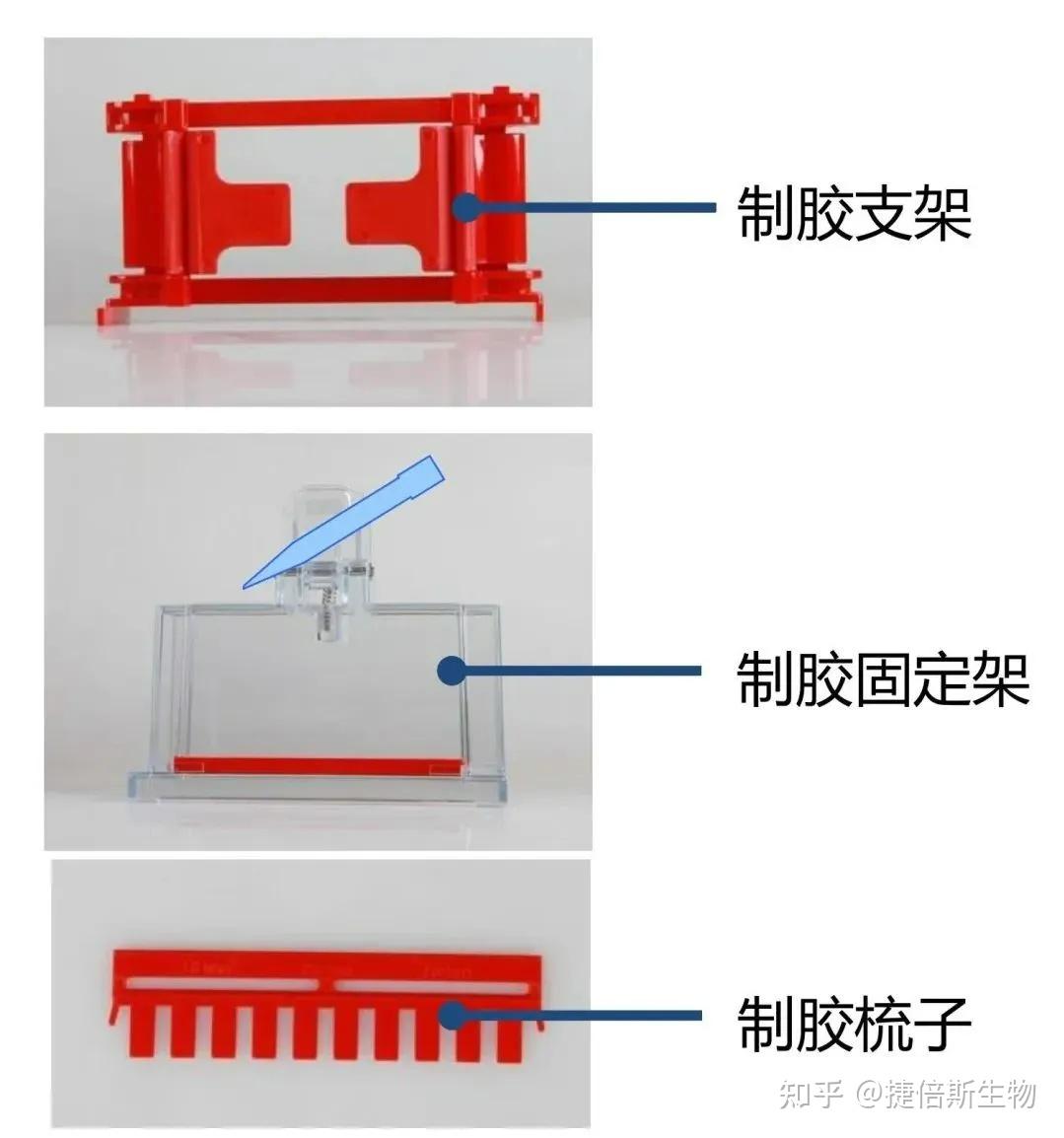
① 洗玻璃板:玻璃板有不同规格的,能制备不同厚度的 PAGE 胶,要注意选择合适的制胶玻璃板,在制胶前,要使用洗涤剂充分洗净玻璃板和制胶梳子,去离子水冲洗数遍,把玻璃片斜靠在网篮里自然晾干,注意不要有水渍。
② 装配制胶架:玻璃板应该是配对的(一片是带玻璃直角的厚板,一片是平滑的薄板),把配对的玻璃板对好,保持两片玻璃板的底边在同一水平面,用制胶支架固定住,再安装到固定架上。注意制胶支架松紧度(紧)、制胶固定架上的夹子上的弹簧的弹性(紧)以及固定架上胶条是否干净,是否具有很好的回弹力,灌胶时要时刻注意是否漏胶,如果稍有些漏,可以在固定架上卡一个 1ml 枪头,如上图,可以人为把固定架上的夹子弄紧一点。如果漏得厉害,就没辙了,只能重新把这一套组装起来。所以最好是同时配几块,总有一块是能用的。
③ 配胶液:在 western 中用的 PAGE 胶是不连续的,分两层,上层是积层胶,下层是分离胶。配的时候先配下层的分离胶,使用 500ul 无水乙醇将胶压齐(比水压的效果好),待分离胶凝固后,倒掉无水乙醇,待乙醇挥发后,灌进去离子水清洗一下残余的乙醇,再配上层的积层胶。积层胶需要有一定高度的,一般上样孔底到分离胶之间的距离要有 1-2cm,距离太短了压得不好,太长了分离胶就短了,影响蛋白分离。
④ 插梳子:梳子有不同规格,适用于不同厚度的胶和上样体积,需要注意。积层胶液灌进去后要立即插梳子,动作要快,否则上样孔容易变形。插梳子时最好拿张厚草纸挡一挡,因为没有凝固的丙烯酰胺是有毒的,插梳子时不挡着很容易喷一脸,要注意防护。完全聚合成凝胶的聚丙烯酰胺就要安全多了。所以在丢弃剩余的胶液时,可以在等它完全凝固后再丢弃。有时候梳子拔掉了发现上样孔之间的间隔东倒西歪的,那准是插梳子时动作慢了。
⑤ 拔梳子:积层胶凝固后不要急着拔梳子,而是应该把玻璃板-胶-梳子这一套作为一个整体拆下来,装进电泳槽,倒好电泳液后再拔,电泳液里含 SDS,拔梳子时会更顺滑。
SDS-PAGE 胶配方:
表中最后的 X% 是通用的计算公式,随 30%丙烯酰胺的量调整 ddH2O 的量。
10% AP 和 TEMED 是催化剂,催化丙烯酰胺聚合,TEMED 可以在 4℃保存较久;10% AP 在 4℃保存不能超过一周(建议买 10g 装的小瓶 AP 粉末,P 粉末室温会吸湿,逐渐失效,因此买回后直接配制好后分装 500ul 一管,冻存在-20℃,用时取出一管溶解,一周之内用完。)
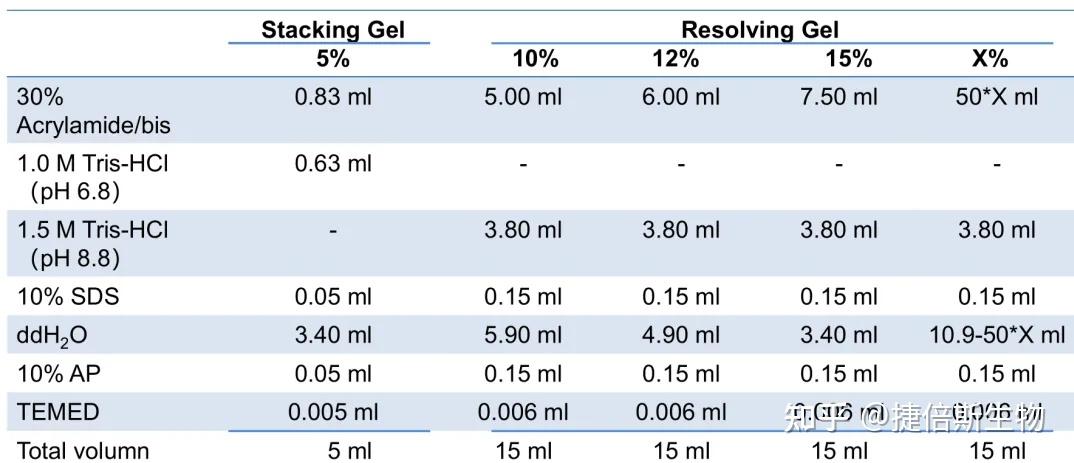
图源:https://blog.csdn.net/zea408497299/article/details/125289061
注意:TEMED易燃,有腐蚀性,具有强神经毒性。
捷倍斯生物(GBCBIO)的 PAGE凝胶快速配制试剂盒-G3402N 配套提供 改良型促凝剂 ,其具有更好的稳定性和催化效能,配胶过程中无需额外添加 TEMED,采用上层胶和下层胶的预混配方,只需加入10% APS即可凝胶,简便快捷,而且有多种浓度比例可选择。
https://www.rjmart.cn/#/productDetail?suppId=113&productId=200006215760&code=424156812183343112&rm=33 (二维码自动识别)
2.2 电泳分离
原理:样品在 5% 积层胶里会被压缩成一条细线,这是缓冲液中甘氨酸盐离子 Gly-和 Cl- 的作用。在积层胶里,Cl-跑在最前面,中间是蛋白样品,最后是 Gly-盐离子,Gly-和 Cl-之间形成一个电压梯度,压缩蛋白样品;到分离胶时,Gly-、Cl-跑在蛋白前面,蛋白样品脱离了电压梯度限制,开始按蛋白大小以不同速度泳动,从而按蛋白大小分离开来。电泳胶原理可参考:WB做了那么久 看了这篇终于把蛋白电泳的原理搞懂了!
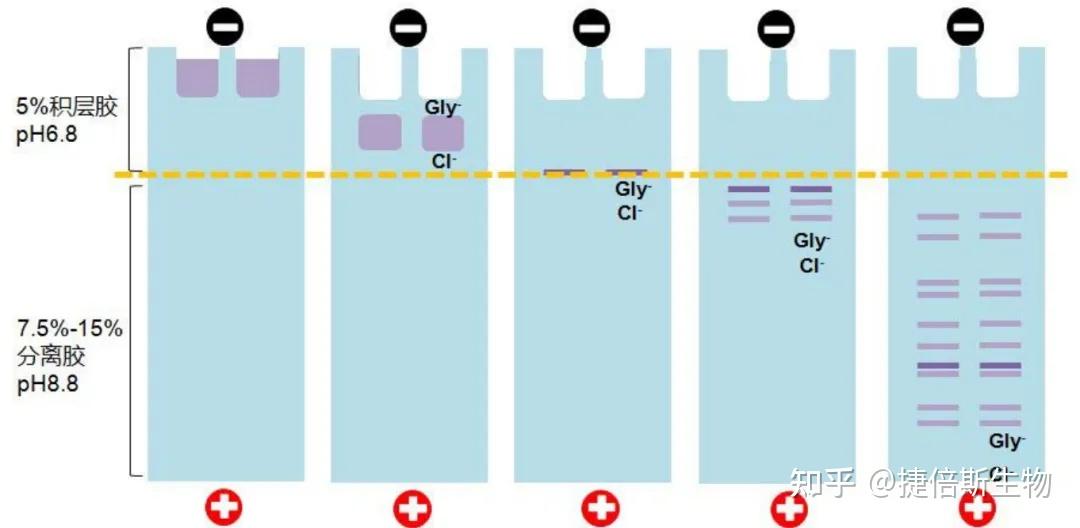
图源:百度百科
积层胶浓度:5%左右,pH 6.8。
分离胶浓度:7.5-15%,pH 8.8。不同浓度的分离胶对蛋白样品的分离能力是不同的。浓度越低,分离度越好,但小蛋白容易跑出去;常用 10-12%。
电泳注意事项:
① SDS-PAGE 对离子敏感,使用去离子水配电泳液,电泳槽和配电泳液的容器也需要用去离子水润洗。
② 在上样之前,先用胰岛素针把上样孔冲一下。
③ 提前一天配好电泳液,混匀放 4℃,到用时,电泳槽稍倾斜,电泳液沿槽内壁缓缓倒入,等液体没过 PAGE 胶底边时,再把电泳槽放平,这样可以保证 PAGE 胶底边没有气泡。(电泳液中含 SDS,如果现配现用,SDS 产生的泡沫会影响电泳,如堆积在 PAGE 胶底边,导致各个泳道出现差异。)
④ 往孔里加蛋白样品慢一点,且各孔的上样体积最好保持一致,没有蛋白的那个孔也用 loading buffer 给加到同样的体积,这样跑出来的蛋白条带才能比较均一,否则会出现蛋白条带往体积小或者空的孔那边飘。别忘了上一孔预染蛋白 marker。
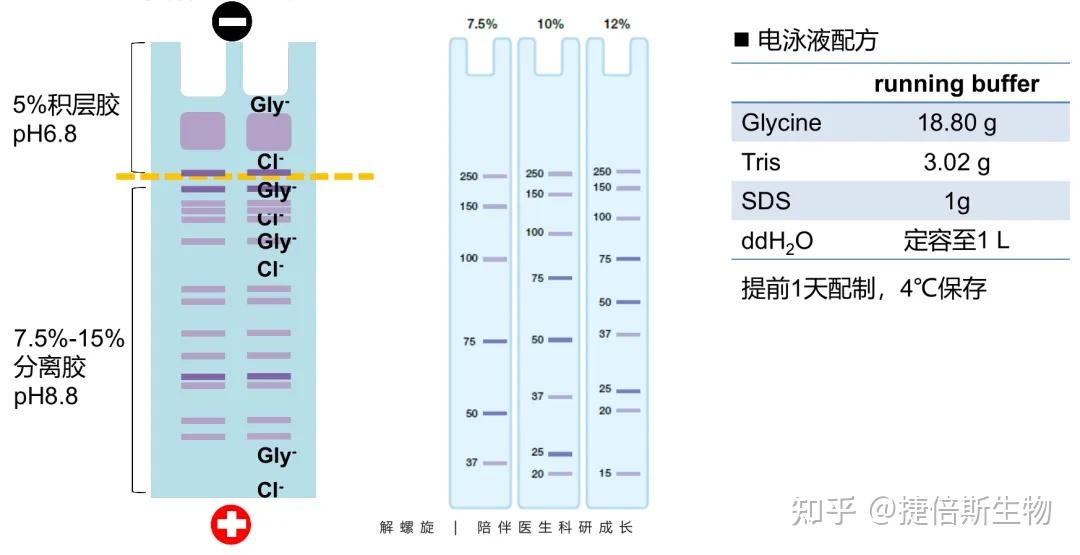
图源:解螺旋
试剂推荐:
天能,SDS-PAGE 制胶支架、制胶固定架,梳子,玻璃板
电泳液如果不想自己配可使用捷倍斯(GBCBIO)Tris-Glycine SDS Powder(G4038-1L) 的速溶粉剂粉末细腻超快溶解
预染的蛋白 Marker 可以用 捷倍斯(GBCBIO)的 Prestained Protein Ladder, 10 -180kDa(PPL4)。
3. 转膜
分湿转和半干转两种。
湿转:全部泡在大量转膜液里。三明治是垂直插在转膜槽里的,从负极到正极依次是:海绵垫、滤纸、胶、PVDF 膜、滤纸、海绵垫。
半干转:少量转膜液保持三明治湿润。半干转的仪器是水平的,负极在上,正极在下,没有海绵垫,滤纸直接贴电极板,从正极到负极依次是:正极金属板、滤纸、PVDF 膜、胶、滤纸、负极金属板、塑料盖。
湿转和半干转的三明治制作及转膜液配方:

图源:解螺旋
推荐试剂:
1.转膜液如果不想自己配可使用捷倍斯(GBCBIO)Tris-Glycine Buffer(G4037-1L) 的速溶粉剂粉末细腻超快溶解
2.或者使用捷倍斯(GBCBIO)的 Western Rapid Transfer Buffer(G7235) 安全无毒的高效转膜液,用于 Western Blot 湿转法转膜,能高效快速地将蛋白转移到印迹膜(PVDF 或硝纤膜)上。不使用甲醇,能在 15-30 分钟内完成转膜过程。
转膜注意点:
① 建议用 PVDF 膜(结合蛋白效率高),因为 NC 膜结合蛋白的效率大概是 80-100ug/cm2,而 PVDF 膜能达到 155-300 ug/cm2。
② 转膜时,准备 2 个盘子,大盘子倒上转膜液,小盘子倒上适量的甲醇。把胶从玻璃板上剥下来,切掉积层胶的部分后就浸泡在转膜液里,与胶相同大小的滤纸也浸泡在转膜液里,浸透。切好的 PVDF 膜先别急着泡到甲醇中,而是应该让它轻轻漂在甲醇液面上 10s,在这 10s 中,甲醇就足够将 PVDF 膜激活了,而且要注意在 PVDF 膜激活后不能干掉,所以我们可以先着手做三明治,等要加上 PVDF 膜时再将膜丢进甲醇去激活,一激活就立刻给装进三明治。
③ 制作三明治时需要使用玻璃滚棒,或者拿根干净光滑的玻璃试管把膜和胶之间的气泡碾掉。
④ 湿转条件一般设置在 200mA 恒流,2.5-3h,时间比较长,需要控制发热,因为发热会影响转膜效果。最好准备一个大冰盒装满碎冰,加点水,把转膜槽埋在冰水混合物里降温;还可以在转膜槽里加一颗磁力转子,把冰盒和转膜槽整个放在磁力搅拌器上,一遍搅拌一边转;或者直接把转膜槽塞到 4℃ 冰柜里降温。
伯乐的转膜槽发热厉害,需要控制发热;法玛西亚的转膜槽,热量控制比较好,可以做到一点都不发热。
⑤ 半干转的三明治要保持湿润,但是三明治周围的金属板要保持干燥。
⑥ 半干转的条件是用恒压 20V,20min-1h。如果蛋白大的可以延长转膜时间。
⑦ 湿转能转的蛋白大小范围非常宽,普通的半干转适合转 30-120KD 大小的蛋白,有些特殊设计的半干转与湿转一样,可以转任意大小的蛋白。这需要看具体机器而定。
⑧ 转膜液也需要用去离子水配制,转膜槽和容器需要用去离子水润洗,转膜液配方需要根据蛋白大小来调整,大蛋白(>100 kD):SDS 1g,甲醇 0 ml;小蛋白(<100kD):SDS 0g,甲醇 200ml。
⑨ 在转膜的过程中,SDS 和甲醇的作用刚好相反。
SDS 与蛋白质结合后,能使蛋白更容易从胶上转出来,但又能阻止蛋白与膜结合,尤其是蛋白与 NC 膜的结合。因此,大蛋白不容易转出,要额外加 SDS;小蛋白靠 PAGE 胶里的 SDS 就足够转出了。过多的 SDS 还会影响电流,增加发热,从而影响某些蛋白的抗原性。所以需要根据情况控制 SDS 的含量。
甲醇能破坏 SDS 与蛋白的结合,促使蛋白与膜结合,但会减小 PAGE 胶的孔径,使一些蛋白发生沉淀,从而影响实验结果,所以也得严格控制量。更多转膜知识点可参考:看了这篇才知道 原来WB转膜竟然有这么知识点和技巧!
4. 抗体杂交
1> 封闭:使用 5%脱脂牛奶 或 5% BSA(用 TBST 溶解)作为封闭液,封闭条件:室温 1h,或 4℃过夜。(目的蛋白转膜后,但膜上还有很多其他蛋白,因为跑胶用的是总蛋白,其他非目的蛋白也会随着转移到膜上,这样就会暴露出很多抗体结合位点,因此需要在抗体杂交前封闭膜。)
◆ BSA:一般是做蛋白磷酸化修饰检测时用,因为牛奶中含有丰富的磷酸酶,会改变蛋白磷酸化修饰的状态。
◆ 有时,封闭液配方和封闭条件也需要改变,特别是大蛋白,5%脱脂牛奶封闭一小时不够;有的蛋白可能牛奶和 BSA 都不能用,可以用明胶封闭或不封闭直接上抗体。
◆ 捷倍斯(GBCBIO)的 FastBlockTM Blocking Buffer(G7205)是一种不含蛋白的快速高效Western封闭液,主要用于Western blot (WB)实验中PVDF膜或硝酸纤维素膜(nitrocellulose membrane, NC膜)的封闭,也可以用于Western实验中一抗或二抗的稀释。Westren必备 快速封闭只需10分钟.更多封闭物质介绍请参考:封闭只用奶粉和BSA?这6种WB封闭液你学会用了么?
2> 一抗孵育:使用封闭液稀释一抗,4℃过夜,或室温或 37℃ 1-X h。
3> TBST 洗膜,室温,5min ×4 次。
4> 二抗孵育:室温 1h。
5> TBST 洗膜,室温,5min ×8-12 次。
6> ECL 显色,X 光片压片或扫膜。
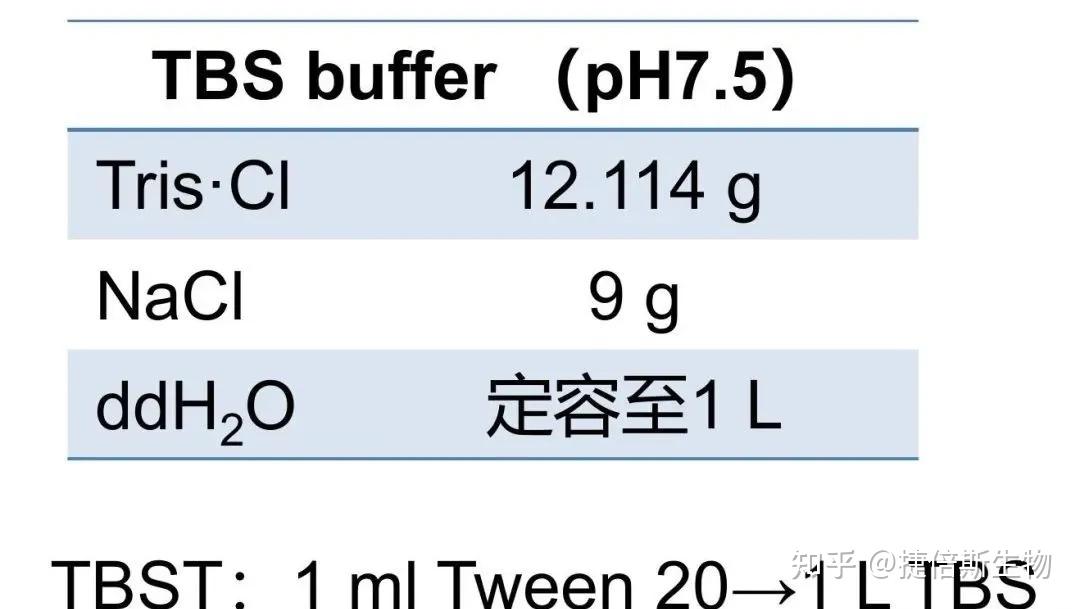
TBS 配方:
1L TBS 中加入 1ml Tween 20 就是 TBST。
Tween 20:一种非离子型去污剂,有复性抗原的作用,可以提高抗体特异性识别能力;提高封闭效果,用惰性蛋白质或非离子去污剂封闭膜上的未结合位点,可以降低抗体的非特异性结合;乳化蛋白时不会破坏蛋白结构。
试剂推荐:
捷倍斯(GBCBIO)公司生产的超敏ECL化学发光液(G3308)灵敏度极高,比DAB显色的灵敏度至少高1000倍,比Pierce公司的SuperSignal West Pico Substrate的灵敏度高10倍,对于辣根过氧化物酶的检测灵敏度可以达到飞克级。
5. 图像分析
使用 Gel-Pro Analyzer 或 ImageJ(推荐)
目前Western Blot条带进行数值化有两种方法——灰度分析和光密度分析。
灰度是计算机图像分析仪根据图像颜色深浅分为256个级别,灰度值越小物体颜色越深。光密度是指光线通过溶液或某一物质前的入射光强度IO与该光线通过溶液或物质后的透射光强度Ib比值的对数OD=log(IO/Ib);图像分析中,入射光和透射光强度分别被切片上最亮区域的平均灰度值和待测目标平均灰度值取代,则图像分析系统的光密度值=log(切片标本最亮区域的平均灰度值(g0)/待测目标的平均灰度值(g))。光密度值越大,物体颜色越深,阳性物质相对含量越大。
对于灰度值来说,标本制作以及染色时间长短,以及测量时照明光源电压的大小对其影响很大。而光密度是一个比值。是通过计算一张标本最亮区域的平均灰度值与该切片标本中待测目标的平均灰度值的比值,再根据数学公式计算而来的,所以受标本染色时间长短及照明光源电压关系很小。有研究实践显示,灰度值与光密度值二者之间存在着线性关系,都可以用来进行WB定量分析。同样,Image J软件进行WB条带定量分析时也存在两种方法,此处只列举一种方法,具体步骤如下(也可以看1-12的流程图):
1、下载安装,并打开Image J软件。
2、导入WB条带图片。File→Open→ 弹出对话框→选择文件夹→找到WB条带。
3、把图片转化成灰度图片:Image→Type→8-bit。这时WB图片将会随之改变
4、消除图片背景的影响。Process→Subtract Background。在弹出的对话框中,填上50基本就可以了,也可以稍高些,并勾上Light background,点击OK即可。此时图片背景会变白一些。
5、设置定量参数。Analyze→Set Measurements。在弹出的对话框中勾选Area、Mean gray value、Min & max gray value、Integrated density。
6、设置单位。Analyze→Set Scale。在弹出的对话框“Unit of length”后面填上“pixels”,其他的不用改动。
7、把WB图片转换成亮带。Edit → Invert
8、选择菜单栏下的一系列不规则圆圈,根据情况选择一种。然后将圆圈手动拉倒第一条带,并尽量将条带都圈起来。
9、点击菜单栏Analyze下拉出现的measurement,即可弹出你选定区域的灰度统计值。也可以点击快捷键(英文状态下的键盘m)。
10、手动移动不规则圆圈至下一条条带,重复8、9步骤,直至所有条带都被测量。
11、当测定完所有条带,选结果中的“Edit”的“Select All”,然后复制数据“IntDen”到Excel表即可进行分析。也可以直接在Results对话框中,选择File → Save as,直接导出excel表格。
12、在excel表格中将目的蛋白的灰度值除以内参蛋白(如果不明白内参蛋白选择,可以见辅助说明1)的灰度值,进行归一化处理。
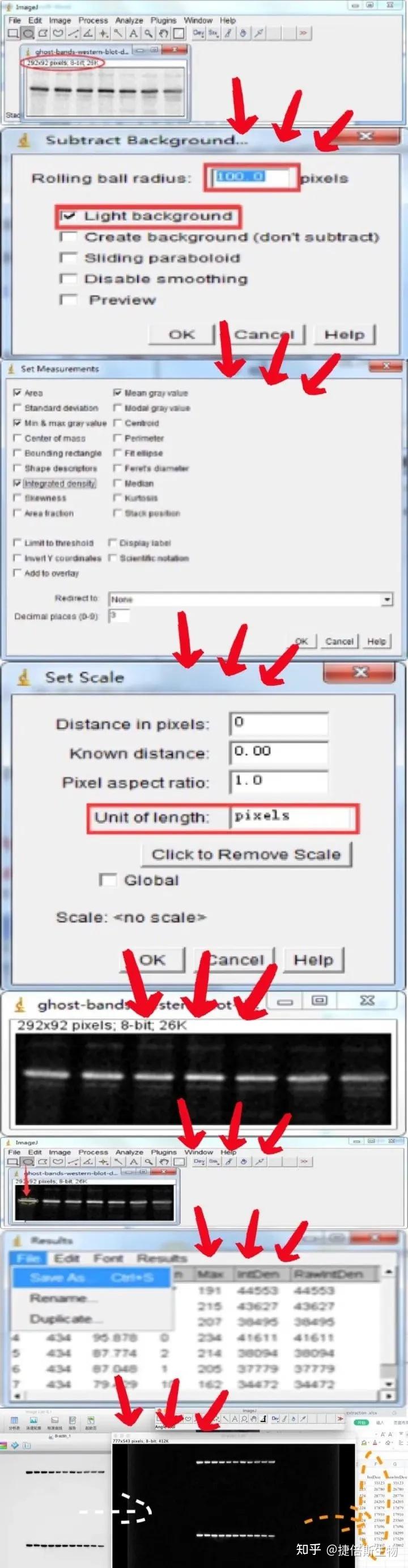
参考流程
13、下载安装,并打开Graphpad软件。
14、在对话框左侧栏目“New table & graph”下选择“Column”。然后再右侧选择所要作的图形,以及是否显示误差棒等,具体如下图。
15、在弹出的表格中,填上excel中的比值。
16、然后点击菜单栏上Insert → New Graph of Existing Data... 。也可以在工具栏Sheet中的“New”条目下找到。(其实这步可以省略)
17、在弹出的对话框“Create New Graph”中,填写新图名称,选择分析方法,图形,以及误差棒的表示方法,具体如下。(其实这步可以省略)
18、此时,可以在工具栏下左侧的状态栏“Graphs”文件夹中找到所建新图“Date 1”
19、此时可以对图形的外观进行修改,增加图片题目以及XY轴名称。直接在图上对应位置左键点击修改。
20、也可以借助工具栏“Change”中的功能键对图片的柱形图颜色、宽度、高度、间隔等进行调整。
21、然后点击工具栏“Export”将新建的柱形图导出。
22、上面只是单因素的柱状图构建方法。如果是双因素,应该在一开始选择“Column”时选择“Grouped”。
6. 常见问题分析
1) 非特异条带:
抗体浓度过高:
◆ 降低抗体浓度
封闭不足:
◆ 提高封闭液浓度,如从 5% 提高到 7%
◆ 增加封闭时间和/或温度
◆ 向封闭缓冲溶液中加入 0.05% 的 Tween 20
◆ 抗体稀释液采用相同的封闭液
SDS 使抗体和蛋白条带发生非特异性结合:
◆ 转膜后洗涤印迹膜。
◆ 在免疫检测过程中不要使用 SDS。
抗体质量:尝试使用不同的抗体
2) 条带弱或无条带
抗体问题,低活性或低浓度、低亲和力的一抗,错配的一抗和二抗:
◆ 提高抗体浓度
◆ 抗体可能已经丧失活性,进行斑点杂交以确定其活性和最佳浓度
◆ 测试不同一抗和/或一抗-二抗组合
抗原抗体反应不足:
◆ 增加凝胶中每个样品的总蛋白上样量
◆ 检查样品的完整性,确保蛋白未降解
抗原被封闭液封闭
◆ 尝试不同的封闭液 (比如,在检测磷酸化蛋白时避免使用牛奶)
◆ 优化封闭液浓度,建议使用浓度为 3–5% 的 BSA 或脱脂奶粉
化学发光底物性能不佳
◆ 增加底物孵育时间
◆ 准备少量工作液以确定底物是否已经丧失活性。暗室内,在底物工作液中加入少量 HPR 偶联物则应该会出现蓝光。如果没有的话,必定是底物或 HRP 偶联物已丧失活性。
◆ 确保底物试剂盒中的两个瓶子之间没有发生交叉污染。两种试剂之间如果发生交叉污染,则会引起试剂活性下降。
◆ 叠氮化物是 HRP 的抑制剂,不要在二抗缓冲液中使用叠氮化物
印迹膜上抗体去除和再杂交
◆ 优化抗体去除条件
◆ 仅在必要时进行再杂交检测
◆ 避免对同一印迹膜进行多次重复再杂交
转膜不足
◆ 转膜时间过短,如果使用湿转法,则需增加转膜时间
◆ 转膜电场过弱,增加转膜电压或电流
◆ 转膜液未优化,在转膜液中加入 0.01-0.05%的 SDS
◆ 将转膜液中的甲醇浓度减少至 5% 或更少。
◆ 凝胶选择不恰当,使用更低百分比的聚丙烯酰胺凝胶
◆ 在转膜后使用丽春红染液染膜,考马斯亮蓝染液染胶,确认转移效率,并在此基础上优化转膜条件。
转过了
◆ 转膜时间过长,减少时间
◆ 转膜电场过强,降低转膜电压或电流
◆ 转膜液未优化,组装“三明治”之前,在转膜液中平衡凝胶 20 分钟以降低凝胶中 SDS 浓度,从而避免小分子量蛋白的过度转移。
◆ 将转膜液中的甲醇浓度增加至 40%
◆ 凝胶选择不恰当,使用更高百分比的丙烯酰胺凝胶
◆ 当目标蛋白分子量小于 10 KD 时使用 Tris/tricine 凝胶。使用 0.2 μm 的膜解决小蛋白转印过度的情况。
◆ 小蛋白会穿过大孔径的印迹膜,在 0.45μm 的膜后叠加 0.2 μm 的膜检测小蛋白转印过度情况
3) 信号过饱和
中空条带:
◆ 上样量过高,降低每个样品的总蛋白上样量
◆ 抗体过多,降低一抗和/或二抗浓度
◆ 化学发光底物过灵敏,更换使用灵敏度较低的化学发光底物
条带过浓以至于条带粘连在一起:
◆ 样品上样量过大,降低每个样品的总蛋白上样量
◆ 抗体过多,降低一抗和/或二抗浓度
4) 条带上有气泡:
“三明治”组装不恰当
◆ 在组装 “三明治”的时候使用更多的转膜缓冲液
◆ 组装“三明治”的时候碾掉了凝胶和膜之间所有的气泡
◆ 在抗体孵育前用丽春红染液 染膜,以检查转膜质量。
5) 转膜不均匀:
印迹膜部分变干或水化不均匀
◆ 确保整张印迹膜均匀浸入转移缓冲液中并充分平衡
◆ PVDF 膜在放入缓冲液之前需要用 100% 的甲醇预先浸湿平衡
硬件问题
◆ 检查湿转装置的线路连接
◆ 确保金属平板清洁,无物理损伤,即便是金属平板发生轻微弯曲也可以极大地改变半干转印系统的电场强度
◆ 使用质量可靠的转膜仪(转膜仪的匀电场是有技术含量的,所以买转膜仪的钱不能省)
6) 背景过强:
一抗和/或二抗浓度过高:稀释一抗和/或二抗浓度
封闭不足
◆ 提高封闭液浓度, 如 3–5% 的牛血清蛋白、酪蛋白、 脱脂牛奶
◆ 降低封闭时间和/或温度
◆ 向封闭液中加入 0.05% 的 Tween-20
◆ 抗体稀释液采用相同的封闭液(加入 0.05%的 Tween-20)
使用了错误的封闭液,一抗和/或二抗与封闭缓冲液中的蛋白相结合:尝试其他封闭液(白蛋白、酪蛋白、 脱脂牛奶等)。在使用亲和素-生物素系统时不要使用牛奶来封闭印迹膜 — 牛奶含有生物素
洗涤不足
◆ 增加洗涤次数和缓冲液用量 (最少 5 × 5 分钟)
◆ 如果洗涤液中未含有 0.1%的 Tween -20,请添加
曝光时间过长:减少成像曝光时间
印迹过程中印迹膜变干
◆ 确保印迹膜保持湿润
◆ 确保印迹膜一直覆盖有足够液体以防止其变干
缓冲液重复利用导致污染:使用新制缓冲液
7) 背景有污迹
部分印迹膜变干
◆ 确保印迹膜保持湿润
◆ 确保印迹膜一直覆盖有足够液体以防止其变干
洗涤缓冲液与某些印迹区域接触不足
◆ 增加洗涤缓冲液用量
◆ 避免过多印迹堆叠在一个孵育容器内
洗涤缓冲液与某些印迹区域接触不足:使用干净的或新的转移“三明治”
印迹膜污染
◆ 请勿用手直接接触印迹膜。一直配戴清洁手套或使用医用镊子
◆ 确保电泳设备、转移设备和孵育盘清洁,远离外部污染源
8) 背景有斑点
凝胶碎片粘附于印迹膜之上:将印迹膜表面残留的丙烯酰胺凝胶碎片移除
成块的封闭剂粘附于印迹膜之上
◆ 确保封闭剂在使用前完全溶解
◆ 向封闭缓冲溶液中加入 0.1% 的 Tween-20
抗体聚合
◆ 使用 0.2 μm 的过滤器过滤抗体缓冲液
◆ 使用新鲜抗体
◆ 向抗体缓冲溶液中加入 0.1% 的 Tween-20
缓冲液污染
◆ 使用新的缓冲液
◆ 使用 0.2 μm 的过滤器过滤缓冲液
9) 不同样品间内参蛋白含量不一致
在实验过程中,选为内参的持家蛋白表达水平发生变化
◆ 在实验条件下识别并验证选用的内参蛋白的一致性,即证实目前实验条件并不会改变该内参蛋白的表达水平
◆ 用染料给膜上的总蛋白染色,并以膜上检测到的总蛋白为内参
10) 内参蛋白检测信号饱和
在实验过程中,选为内参的持家蛋白表达水平发生变化
◆ 减少上样量以消除信号饱和
◆ 稀释抗体浓度或减少孵育时间以避免检测信号饱和
◆ 选择另一个一致性表达的低丰度蛋白作为内参
◆ 用染料给膜上的总蛋白染色,并以膜上检测到的总蛋白为内参
更多条带问题可参考:微笑的条带 哑铃条带 WB各种“奇葩”条带的成因竟是这个(附解决办法)
声明:部分图源网络,侵权联删 整合了网上诸多资料,因此未能一一注明出处。如有侵权,请联系作者删除。
捷倍斯生物官网:http://www.gbcbio.cn/
原文地址:https://zhuanlan.zhihu.com/p/689931494 |
|
 /3
/3 