金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
全文字数:47,475字
目前参考文献:75篇,其中英文文献71篇,中文文献4篇,大多来自顶尖学术期刊,和权威学术机构发布的指南、立场声明与文件
本文已于2021年07月14日进行了第6次全面更新,本文会无限期、不定时地进行全面更新,建议收藏、转发、点赞保存
第4次~第6次全面更新主要涉及到的内容:
❶HIV DNA检测是否可靠,是否建议做?
❷改进后的雅培试纸的敏感性、特异性和窗口期问题,雅培试纸和第四代酶联免疫测定的p24抗原实际检测下限值以及对应的HIV RNA病毒载量值对比,雅培试纸能检测到的亚型(文末)。
ps:2020年德国最新发表的论文甚至在原文中表示:改良之后的雅培试纸的p24抗原实际检测下限值甚至比制造商宣称的25 pg/ml高20倍,即使在血清/血浆样本中也是如此。好在它的抗体检测性能十分优异,假阳性概率也极低。
❸勘误:2020年最新版本的雅培试纸在10-19天时用血浆也最多只能检测到77%的急性HIV感染者,更不必说指尖全血,之前说14天77%并不是FiebigII-III期的具体范围,特此修正。
❹暴露前预防(PrEP)对不同人群的有效性
❺完善了暴露后预防(PEP)的实用建议
❻在每次性行为中全程、正确使用安全套会感染HIV吗?为啥有研究说戴套只能降低80%~95%的风险?戴套还有必要检测吗?
❼進一步完善了HIV试纸和实验室试剂的种类及窗口期问题,加入了瑞典公共卫生局及瑞典抗病毒治疗小组对实验室四代检测和床旁快速HIV检测窗口期问题的官方立场声明。
❽排好了参考文献序号,并全部罗列在文末 长文预警,建议耐心看完。基于循证医学,国外传染病学顶尖学术期刊上的文献,以及美国CDC、NIH(美国国立卫生研究院)、WHO(世界卫生组织)、UNAIDS(联合国艾滋病规划署)等公共卫生机构的意见,讲到了HIV的方方面面,后面也有你们最关心的窗口期和症状的问题,这或许是目前知乎上最全面的有关HIV检测与预防的科普回答了,绝对值得你细细阅读。
另:本文回答中引用的文献可能超过100篇,由于本回答还没有写完,并且有许多细节还在进行补充和更新,因此需要排好序号后统一刊在文末。
目 录
—为什么你根本没有HIV感染还是脱不了恐?
—HIV试纸的窗口期究竟是多长?医院专业实验室检测的窗口期是多长?不同检测方法分别测试到多久可以彻底排除?首选什么方法筛查HIV感染?
静脉血浆或者血清比指尖血更敏感
—国家标准中的「抗体、抗原和核酸检测的窗口期分别为3周、2周、1周左右」可以踩点作为排除时间吗?满21天抗体检测阴性就可以彻底排除了吗?
—用试纸自测的结果真的可靠吗?
—试纸有哪些种类,区别是什么?
- 不建议采用口腔黏膜渗出液试纸(OMT),因为它的敏感性和特异性更差,容易出现假阴性和假阳性,来找我咨询的人中已经有过多例OMT假阳性的情况。且文献已经表明OMT敏感性不如血液试纸,特别是在操作不规范的情况下。
— 别再叫三代试纸、四代试纸了!
- 准信、万孚等国内品牌的抗体检测试纸,只检测IgG抗体,原理上类似于第二代技术,根本算不上真正的三代检测!!国际上统一将HIV试纸称为快速检测(rapid test),不分代数,这也是学术界和学术文献的统一称呼,只有HIV实验室检测才有一代、二代、三代和四代之分。
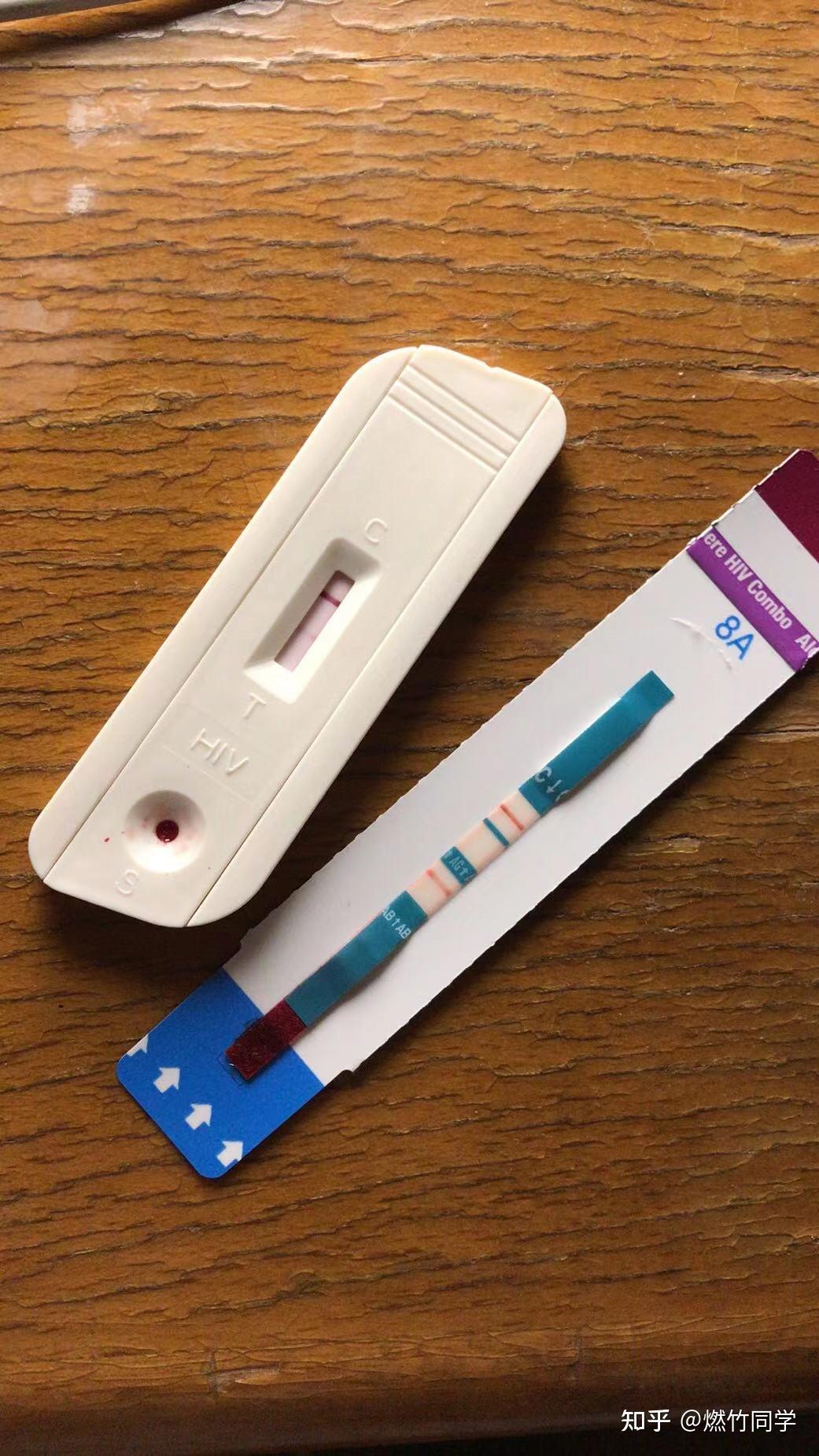
由万孚试纸和雅培试纸筛查到的急性HIV感染一例,患者于检测前31-32天前发生过高危性行为(无套肛交)。雅培试纸多数在暴露后15-25天筛查到感染,万孚、准信等国内品牌的试纸多数在暴露后25-35天(文献认为是26-37天)筛查到感染。但排除时间建议分别延长到45-50天和56天。
— HIV 前病毒DNA检测用于HIV初筛靠谱吗?HIV DNA检测真的比HIV RNA检测更灵敏吗?其他国家也在用HIV DNA检测来进行HIV筛查吗?
- 别被洗脑,美国及其他发达国家在许多年前就已经逐步淘汰了HIV DNA检测,它从前作为核酸检测的一种类型是用来对18月龄以下的婴幼儿进行早期诊断的。国际上的指南和多数国家的官方机构发布的文件,都没有将HIV DNA检测作为一种HIV筛查方式。目前对HIV DNA检测研究得最广泛的是将它用来估算已经感染了HIV的感染者体内的病毒储藏库水平,而不是HIV初筛。
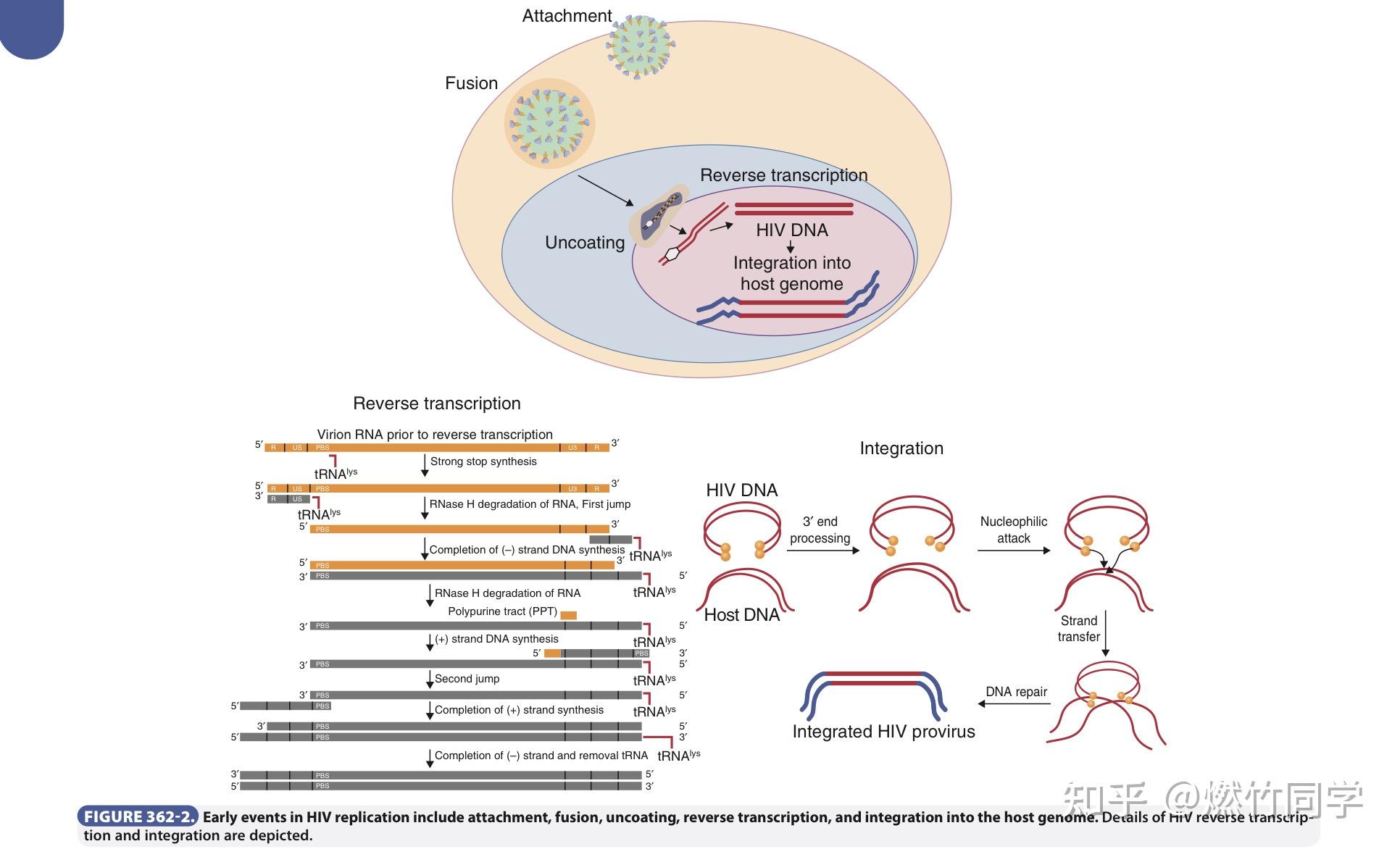
HIV病毒感染的早期事件:附着、融合、脱壳、逆转录和整合,其中HIV DNA会整合到宿主细胞的细胞核内的DNA上。图片来源:GOLDMAN-CECIL MEDICINE(第26版)
- 国内商家宣称的针对HIV DNA检测的最新PAP技术,我目前在公开数据库中并没有检索到相关学术论文。即使进行了改进,HIV DNA检测也绝对不会比高精度HIV RNA检测快很多天检测到感染,并且之前的研究表明HIV RNA检测反倒比HIV DNA检测更灵敏。关键的是,不值得花那个大价钱。

目前FDA批准的HIV检测类型中并未包含HIV DNA检测
- 前病毒DNA检测更有可能遭遇假阳性。因为前病毒DNA检测本质上和RNA检测一样属于一种分子实验,通过PCR的手段进行检测,步骤更加复杂,且操作人员需要接受严格的培训才能确保最终结果正确。如果某些商业公司的实验室质控不严格,那么就可能导致污染,进而导致假阳性,特别是在人工核酸提取、一轮扩增、二轮扩增和引物设计等方面出现问题。
—试纸的正确操作方法是什么?
—试纸出现反应性结果该如何进一步检测?
—急性期HIV感染会出现哪些症状?依据症状来判断是否感染HIV可靠吗?
—为什么建议近期存在高危暴露的人群采用医院/专业实验室的第四代抗原-抗体联合检测而不是雅培试纸来筛查急性期HIV感染?
—那些行为能感染HIV:HIV的传播方式 以及 不同的暴露行为感染HIV的风险/几率
—哪些行为不能感染HIV?

美国CDC官网明确表示:HIV无法在人体外部长时间存活。恐体外的人都要认真考虑精神心理问题,不论你出现了多少症状
—哪些因素会放大HIV感染的几率?
—哪些因素会缩小HIV感染的几率?
—预防HIV感染的策略
(1)你真的会正确使用安全套吗?
(2)暴露前预防(PrEP)的两种服药方案
(3)暴露后预防(PEP)的关键点知识
(4)包皮环切术可以降低HIV感染的几率吗?
(5)治疗即预防:检测不到=不能传播(U=U)
(6)拒绝吸毒与不洁的侵入性医疗操作
(7)筛查并治疗其他性传播感染
(8)生活中的注意事项
—高危群体的常规筛查策略是什么?
前 言
不同HIV检测方法的窗口期、不同行为感染HIV的风险和具体解释,感染HIV风险的放大因素、缩小因素,哪些行为能感染HIV哪些行为不能,HIV和性传播疾病预防等知识,都在文章后面,文章开头我主要把恐艾者最应该关注的“精神心理健康”进行了讲解。所以请仔细看完文章再留言询问,你想知道的我在文中基本都讲解了。
我一直反对没有吃阻断药的人采用3个月甚至6个月的窗口期,但是我也没有那么激进。另外,不要因为我的观点听上去稍显“保守”,或者因为我给出的排除概率和某些“专家”的说法不一样就觉得我没有水平。我在本篇回答中给出的排除概率和窗口期全部都有坚实可靠的循证医学证据的支持。
至少我给出的数据全部都来自设计严谨的实验,并且这些数据全部都发表到了国际顶尖学术期刊或者传染病学领域的顶尖期刊上,而不是像某些“专家”随口就来、人云亦云,毫无证据可言,那种没有根据的言论拿到国际上去讲只会贻笑大方。
内容仍在持续更新中,还没有写完,看到最后的小伙伴们请稍安勿躁。
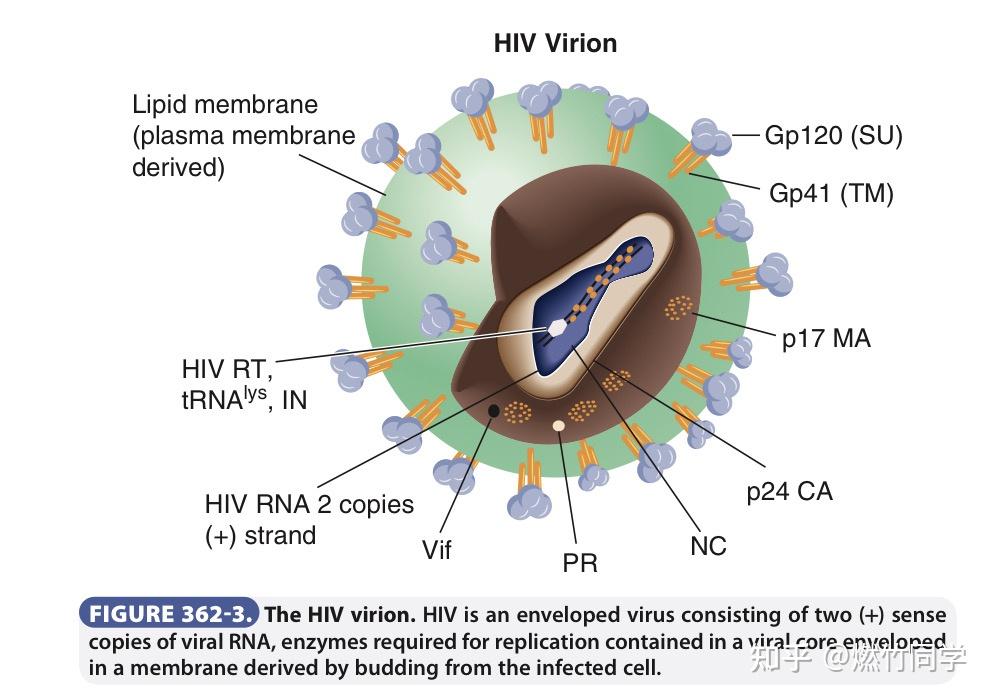
HIV的结构,其中确证实验就检测病毒裂解物中的特异性蛋白,如上图所示的一些蛋白,比如p24、Gp120、Gp41、p17等。图片来源:GOLDMAN-CECIL MEDICINE(第26版)
————————————————————
2021年04月07日更新:绝大多数的恐艾者都没有HIV感染!精神心理健康,才是恐艾者最应该关注的问题!
忠告:所有严重、反复恐艾和过了窗口期后测试阴性仍然脱离不了恐惧的小伙伴,都要认真地考虑:
●疾病焦虑障碍(illness anxiety disorder):已纳入国际著名的DSM-5诊断目录中,从前被归类为「疑病症」,主要是情绪上对HIV感染的焦虑与恐惧,躯体症状很轻微或者不存在躯体症状。

图片来源:uptodate
所以真正有水平的临床医生绝对不会在窗口期后测试阴性仍然为你反复安排HIV筛查,更不会随意、主观地将窗口期延长到3个月、6个月。

图片来源:uptodate
●躯体症状障碍(somatic symptom disorder):已纳入国际著名的DSM-5诊断目录中,从前也被归类为「疑病症」。躯体症状障碍患者和疾病焦虑障碍患者一样会特别担心躯体状况和疾病(如HIV感染),并且伴有痛苦和功能受损。
但躯体症状障碍患者与疾病焦虑障碍的患者相比,他们的躯体表现很突出,通常同时存在多种躯体症状,而这些症状并不是由HIV感染或者性传播疾病引起的,而是精神心理障碍的一种映射。
但躯体症状障碍的患者的确能具体又清晰地感受到这些症状,比如:浑身发烫、胃肠道不适、腹胀腹痛、头晕头痛、腹泻、淋巴结肿大等。

图片来源:uptodate
●强迫症(obsessive-compulsive disorder, OCD):一直都在DSM诊断标准中,除了担心患病,大多数强迫症患者还有涉及其他方面的强迫思维或行为,如检查门窗等是否锁好、计数和/或保持严格的顺序。当主要的关注点局限于健康和疾病时,则诊断疾病焦虑障碍。

图片来源:uptodate
个别恐艾很严重的小伙伴可能还合并有抑郁障碍或者强迫型人格障碍(心理治疗对于人格障碍的效果比较差,需要延长治疗时间)。
对于这类小伙伴,我想告诉你们,这可能才是你们一直脱不了恐的根源所在,而一般患有强迫症的患者往往不自知,不会正视它,也不愿意承认。
有的人担忧戴套性交会感染HIV,幻想安全套已经破裂了,但自己没有发现;即使反复检查了安全套没有破裂,还是会幻想体液会接触到自己的生殖器从而导致HIV感染。这是对安全套发明者最大的亵渎,更属于精神病性症状。
有的人纠结一些根本不可能感染HIV的离奇途径,比如打飞机、共用性玩具等不可能传播HIV的体外途径,比如唾液、泪液、汗液和尿液等完全不可能传播HIV的体液。
有的人会把自己都没亲眼看见的潜在危险极限放大,比如会认为对方唾液里带有血液,对方口腔里有开放性伤口,而自己没有发现,或者自己不能确定而感到恐惧……而实际上这些情况大都没有真实发生,而是自己心里联想出来的。
比如有的人会担心医院的针头、门把手、护士的手套、地铁的扶手上可能有HIV病毒,所以每次抽完血拿到阴单后,还没到家,马上开始接着恐。
比如有的人在窗口期后多次测试均呈阴性,解释了很多次没有感染HIV,仍然反复纠结于自己的症状,觉得是HIV感染导致了这一切的症状……
有的人恐惧了一两年、两三年,走遍了大江南北的医院,测试了无数次,得到的均是阴性的结果,但因为自己存在的那些症状,就坚信自己是那个「天选之子」,是那个「七十亿分之一」,所有的医生、学者、科研人员和科学家都没有他厉害,是医院误诊,没有把他检测出来……

这些表现已经不是正常的应对传染病的反应方式,也不是正常的逻辑和思考方式,而是真真切切、毋庸置疑的疾病焦虑障碍、躯体症状障碍、强迫症或者强迫型人格障碍。
痛苦是真实存在的,症状也是真实存在的,我明白。你的确可能生病了,但一定不是HIV,而可能是焦虑障碍或者强迫症,患上这些精神心理方面的疾病一点都不可耻,这些精神心理疾病也并不少见。给所有反复恐艾的人一个大大的拥抱。
那些焦虑,过度担心,和反复检测,都是当我们面对一个自己并不了解、并且潜意识认为是“极端恐怖”的病毒时(实际上并不是)做出的正常反应。
然而认知会影响行为,行为也会反过来改变认知,只有当我们全面了解了HIV的正确知识之后,了解了HIV感染者是如何感染、如何生活、如何不传染给阴性伴侣、如何活到接近正常寿命的时候,我们才能更全面、更深刻地了解真正的HIV,而不是被那个你幻想的HIV折磨得寝食难安,更不是被网上那些骇人听闻和错误的HIV知识,以及某些网友别有用心的虚假感染经历的分享所恫吓住。
只有我们试着走近它,揭开它神秘的面纱,暴露在你最害怕的病毒面前,减轻“我会感染HIV”、“我出现了症状,肯定是中了”、“感染了HIV就活不了多久了”、“感染HIV其他人肯定不会再接近我”这些强迫思维,反复检测的强迫行为也会自然而然地减轻,并将这些行为和思维正常化。
通过图表分析诱发疾病焦虑障碍/躯体症状障碍/强迫症的因素占比、减轻这些症状的因素占比、维持稳定心境的因素占比,通过制定有序的计划反复训练,最终一定会回到正轨。
请相信科学,接受正规的、足疗程的心理治疗,或者(和)药物治疗能够很快使这种强迫思维、偏执思维减轻,也极有可能获得长期缓解。
专业的心理治疗师有一套系统而科学的方法,比如认知行为治疗(CBT)、反应暴露预防、森田疗法等,再加上有技巧的苏格拉底式提问,帮助你逐渐实现认知的重建,并正确认知内心中的恐惧,从而渐渐摆脱这种思维困境,请相信他们。
症状严重的情况下,或者不能承担心理治疗的费用、没有时间连续去做专业的心理治疗,那么建议一定要考虑在三甲公立医院专科医生的指导下连续口服至少6-10周的药物,才会逐渐看到效果。

只是我们中国人向来不愿谈及,不愿重视心理问题,所以每当出现症状,都觉得是身体确实出现了问题,是实打实的器质性疾病,而不愿承认可能是心理疾病正在主导这一切。
一定不要忽视这些真实存在的心理问题,如果一直逃避和不愿意面对它,那么咨询再多的传染病和公共卫生领域的专家和医生,也很难完全脱离恐惧。及时寻求正规公立医院对焦虑障碍和强迫症有丰富治疗经验的心理治疗师或者精神科医生的帮助,才是解决这个问题的最好办法。
PS:在寻求心理治疗时,尽量选择每个省份排名靠前的大型三甲医院的心理治疗师进行治疗,看看他/她的擅长,选择擅长治疗疾病焦虑障碍、躯体症状障碍、强迫症和强迫型人格障碍的心理治疗师。

<hr/>本文已于2020年10月进行了第二次全面更新

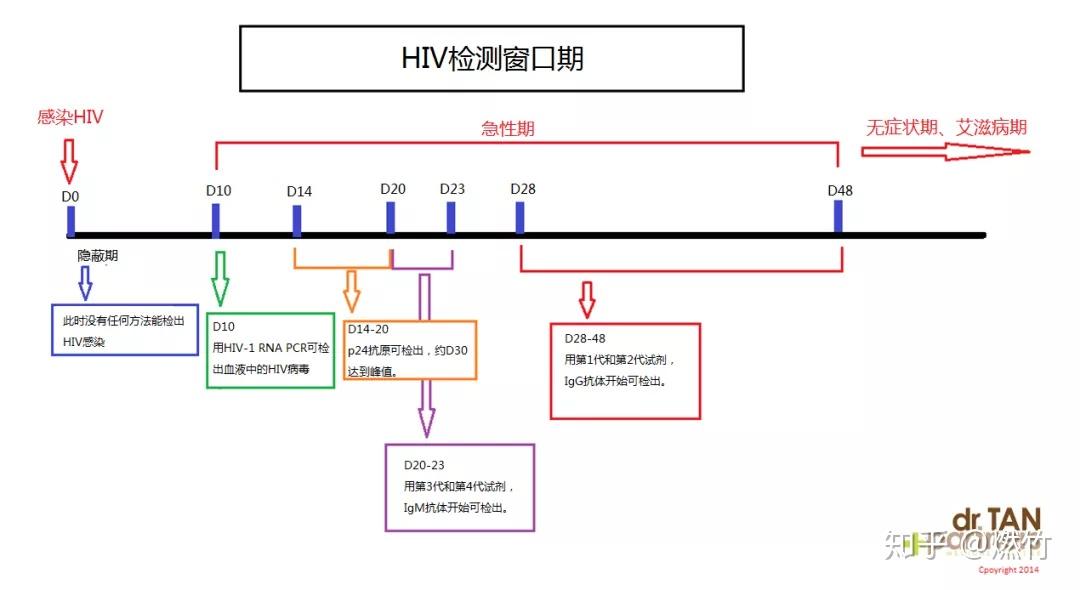
最关心:各类检测技术的窗口期
感染HIV后,按照从早到晚的顺序,依次被检测到的生物标记物是:RNA → P24抗原 → IgM抗体 → IgG抗体。
HIV RNA检测也称为病毒载量检测,是在专业实验室中利用RT-PCR(逆转录酶聚合酶链式反应)的方法进行的HIV核酸检测(NAT)。国内目前仅有收治HIV感染者的传染病专科医院以及少数大型三甲医院拥有这种检测类型。
第三代检测是指专业实验室(而不是试纸)通过化学发光法(CLIA)或者酶联免疫吸附测定(ELISA)同时检测IgM抗体和IgG抗体的技术,现在国内实验室试剂检测HIV抗体均为第三代。
第四代检测是指专业实验室(而不是试纸)通过化学发光法(CLIA)或者酶联免疫吸附测定(ELISA)同时检测P24抗原,IgM抗体和IgG抗体的技术,又称「HIV抗原抗体联合检测」。
HIV试纸都属于快速检测,不分第几代。不论它们是检测IgG抗体,还是同时检测IgM抗体和IgG抗体,还是同时检测IgM抗体、IgG抗体和P24抗原。
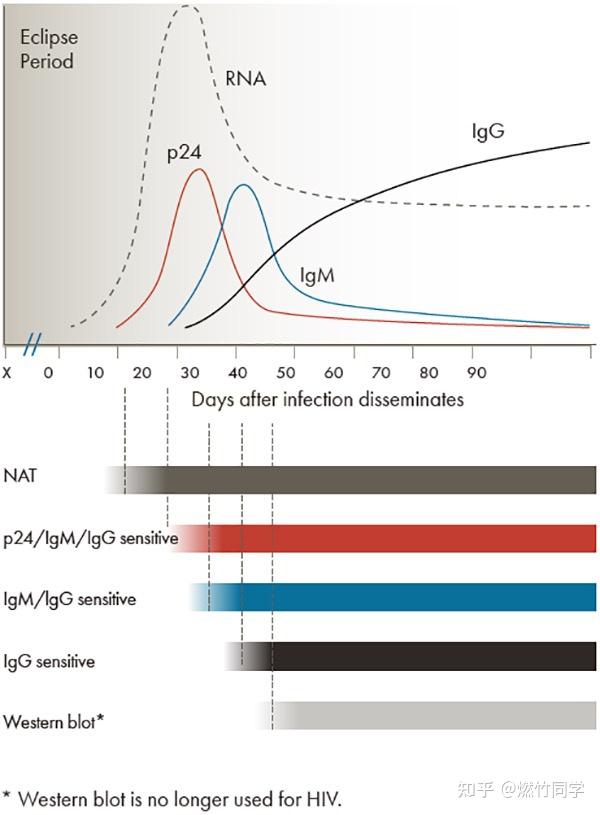
图片来源:美国疾控中心(链接:https://www.cdc.gov/hiv/clinicians/screening/diagnostic-tests.html)
请勿相信电商平台客服宣称的「三代试纸」、「准四代试纸」、「真正的四代试纸」的说法。
比如,万孚、准信等品牌的试纸只能检测IgG抗体,根本算不上第三代检测,第三代检测是同时测IgM抗体和IgG抗体的专业实验室技术,所以这些试纸不能称为“三代试纸”。
韩国SD的单纯抗体检测试纸,以及INSTI单纯抗体检测试纸,的确能检测IgM抗体和IgG抗体,似乎能算「第三代」,然而请记住,只有实验室的检测方法才能称为第几代检测。

美国疾控中心的官网文件也明确表示,这种IgM/IgG抗体联合检测的试纸,敏感性不如真正的第三代实验室检测
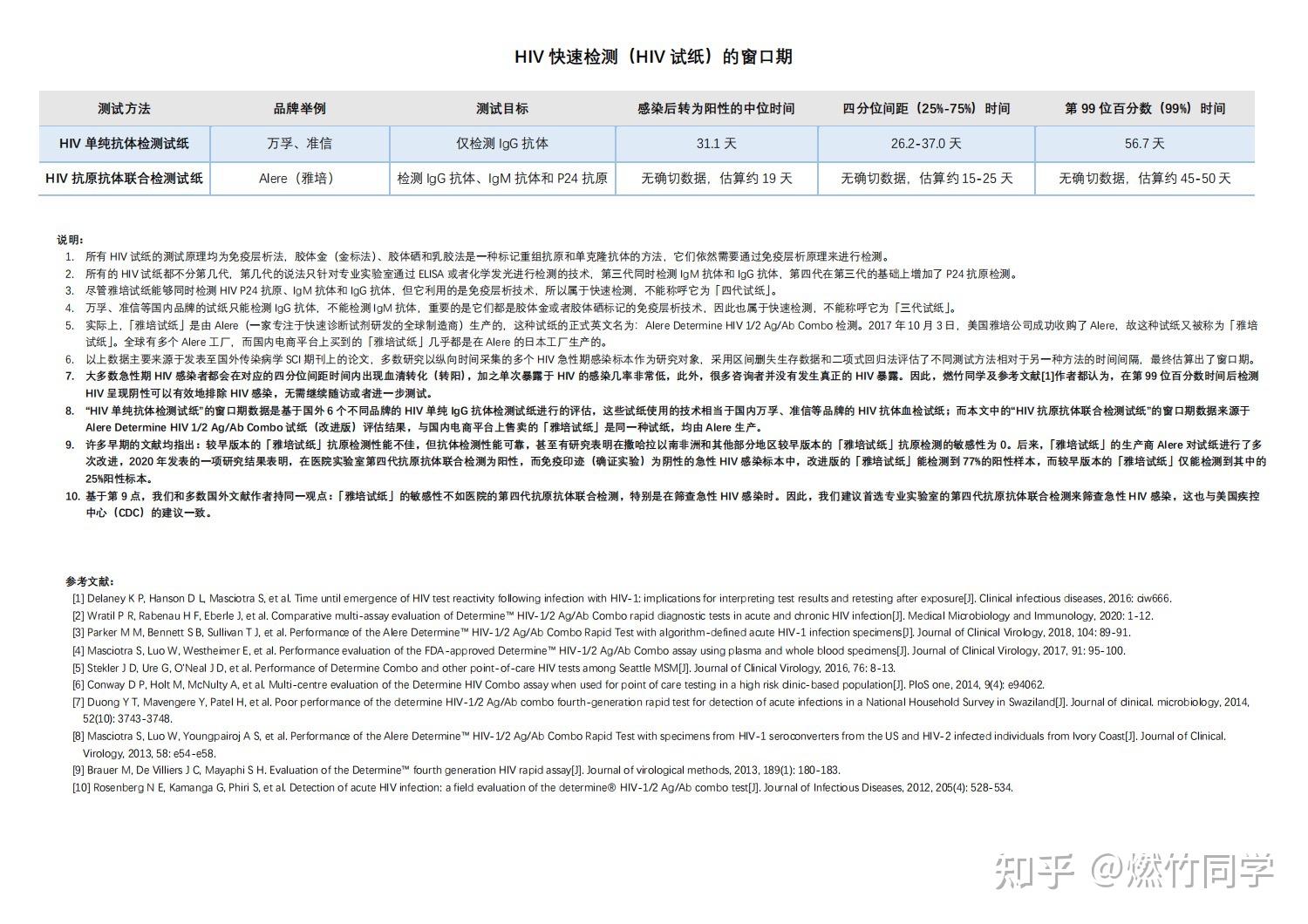
基于发表在国外高影响力SCI期刊上的数篇评估HIV窗口期的论文,我把不同检测方法的窗口期制作成了表格,放在这里,供小伙伴们快速阅览。
里面包含窗口期的中位数、25%-75%范围、第99位百分位数(99%),建议采用各自方法的第99位百分数作为最后排除时间。(由于HIV RNA在急性期可能会出现较大波动,因此国家标准规定核酸检测只能作为辅助参考,不能用于排除)
由于单次接触感染HIV的风险极低,因此如果没有吃阻断药,检测途中也没有再次发生暴露,并且第99位百分数后检测结果阴性,那么就可以完全排除,无需进一步检测或者随访。
99%其实就代表彻底排除,统计学上不存在绝对或者100%的事情,学术论文是严谨的,不会写100%,99%其实就是最后的转阳时间,因此第99位百分数后测试阴性其实就可以排除了。
窗口期3个月的说法仅针对使用了暴露后预防(PEP),或者暴露前预防(PrEP)的人群(目前并没有确切证据表明阻断药能延长窗口期,延长窗口期的说法主要基于理论和少部分Case report),普通人群无需随访到3个月。
⚠️重点:HIV实验室检测的窗口期
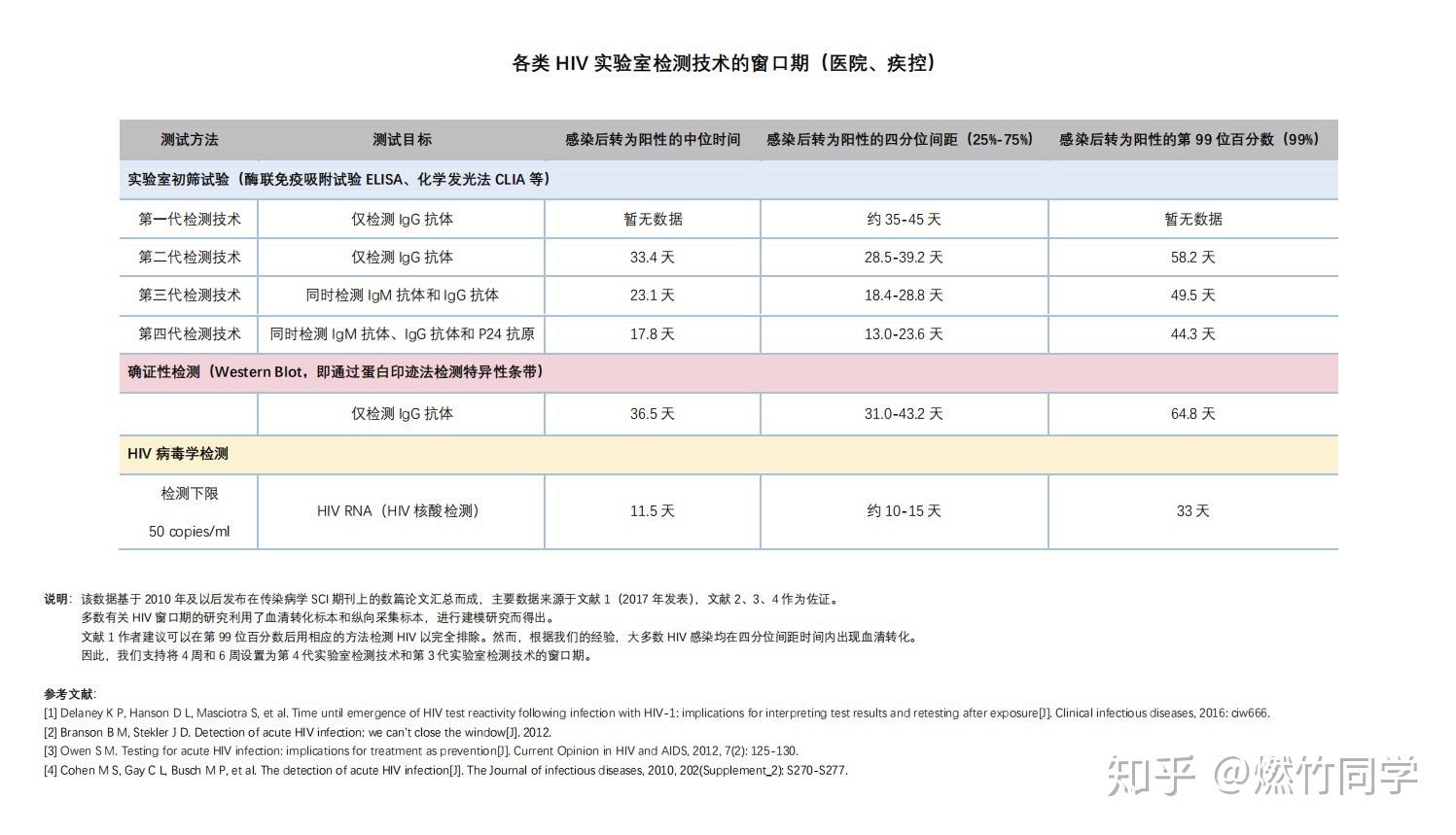
HIV实验室检测技术的窗口期
(点击“查看原图”,图片更清晰)
简单来说,目前在医院用化学发光法(CLIA)、电化学发光法(ECLIA)、酶联免疫吸附试验(ELISA)进行的检测全部为第三代检测和第四代检测。但要注意少部分医院和大多数县级疾控中心也在用HIV试纸在帮咨询者做筛查,这种情况报告一般会注明「金标法」或者「快速法」,并且一般不会有S/CO或者COI的数值。
实验室第三代检测在报告上的名称是「人类免疫缺陷病毒(HIV)抗体检测」,绝大部分感染者都会在暴露后18-28天被筛查出来(中位数23天)。没有吃阻断药的情况下,在暴露后50天实验室第三代检测阴性就可以彻底排除HIV感染的可能性。
第四代检测在报告上的名称是「HIV抗原抗体联合检测」或者「HIV-1/2 Ag/Ab联合检测」,绝大部分感染者都会在暴露后13-24天内(中位数18天)被筛查出来。没有吃阻断药的情况下,在暴露后45天实验室第四代检测阴性就可以彻底排除HIV感染的可能性。
请仔细阅读每张图片的【说明】部分,其中详细解释了小伙伴们的常见疑问。
参考文献均在图片底部,如有疑问,请访问参考文献的全文。两张图片的参考文献1是同一篇论文,作为本回答窗口期数据的主要来源。
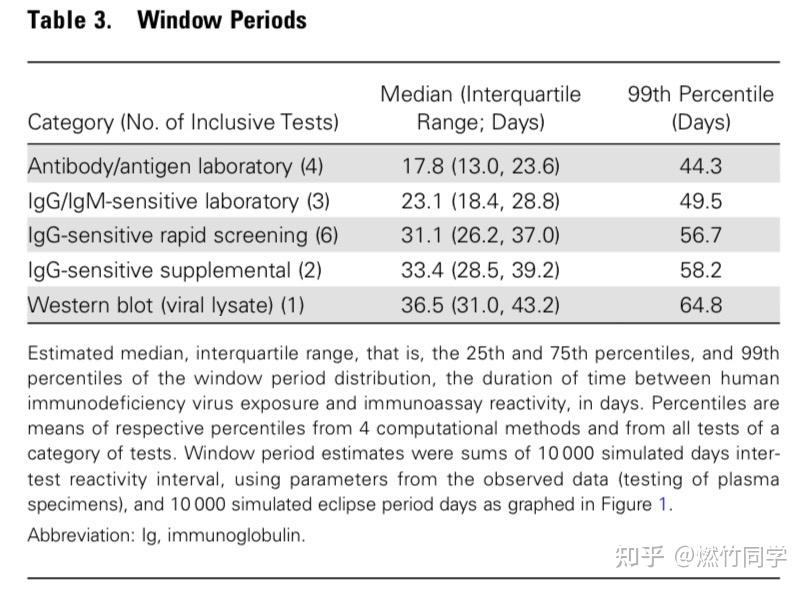
传染病学顶尖学术期刊Clinical Infectious Diseases上发表的论文中窗口期结论,其中第一行代表专业实验室里进行的HIV抗原抗体联合检测(第四代检测);第二行代表在专业实验室里进行的HIV抗体检测(第三代检测)
⚠️重点:HIV试纸(快速检测)的窗口期
第一排是万孚、准信等国内品牌的抗体检测试纸,第二排专门对应雅培试纸。
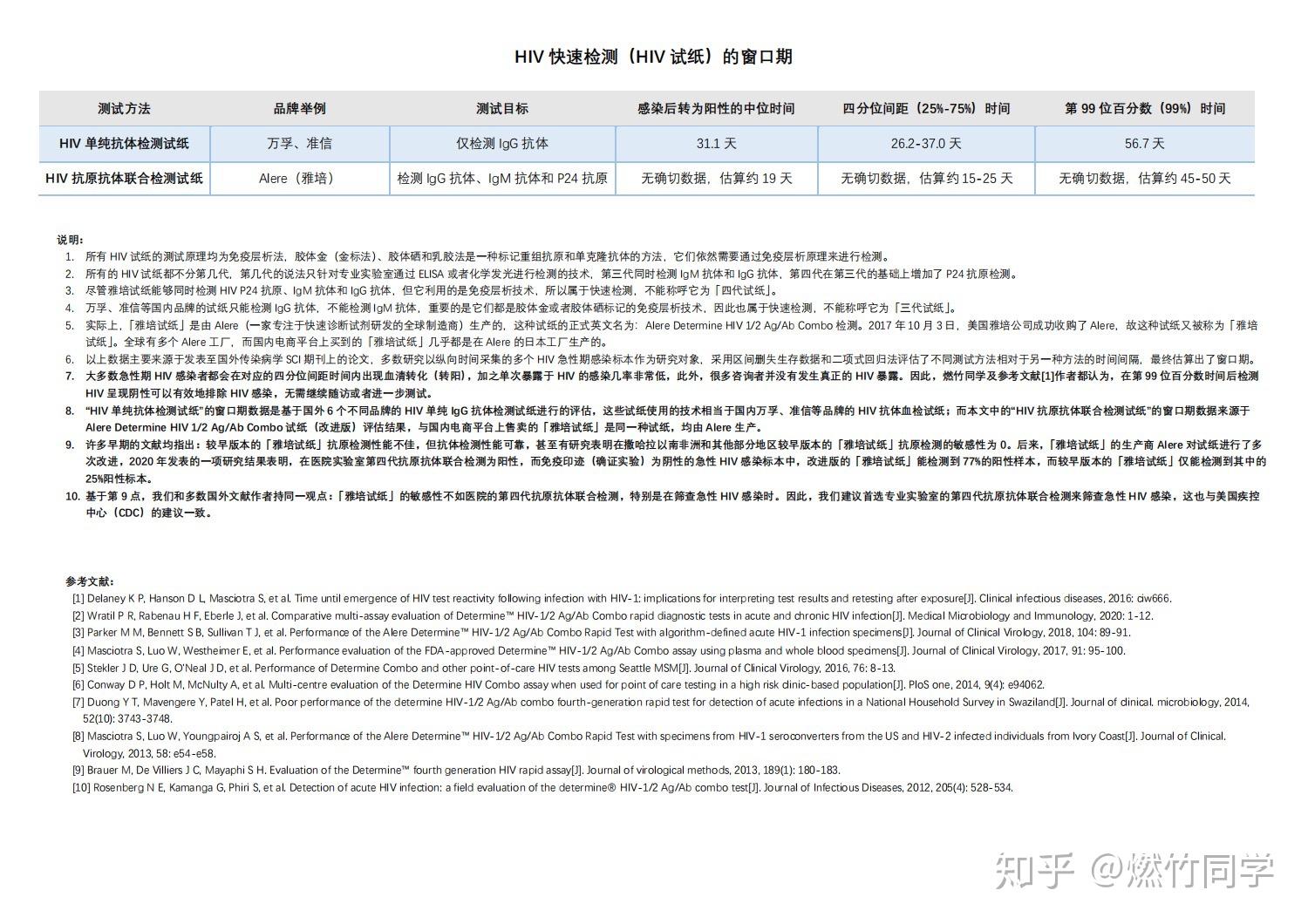
HIV试纸的窗口期
简单来说,万孚、准信、艾博、万泰等国内品牌的只检测HIV抗体的HIV试纸仅仅只能检测IgG抗体,不能同时检测IgM抗体,并且使用的是指尖全血而不是静脉血清,因此窗口期会比在医院专业实验室进行的真正的第三代检测更长。
国内品牌只能检测HIV抗体的HIV试纸,绝大部分感染者用这种方法在暴露后26-37天内转阳(中位数31天)。没有吃阻断药的情况下,暴露后56天,严格按照说明书操作并确保观察满15分钟结果阴性,可以彻底排除HIV感染的可能性。
而雅培试纸是个例外,它虽然属于快速检测,不讲代数,但能同时检测IgM抗体、IgG抗体和P24抗原,因此窗口期要比万孚、准信等品牌试纸短。
绝大部分感染者用雅培试纸进行指尖血检测,在暴露后15-25天内转阳(中位数19天),如果是使用静脉血清/血浆则大多数在暴露后10-19天内转阳。在没有吃阻断药的情况下,暴露后45-50天,严格按照说明书操作并确保观察满20分钟结果阴性,可以彻底排除HIV感染的可能性。
我的上述观点与2017年发表在传染病学领域顶尖学术期刊Clinical Infectious Diseases上的一篇评估HIV窗口期的论文[1]结论一致,上文所列出的窗口期数据基本来源于这篇文献,图片底部引用的其他论文作为辅助验证。
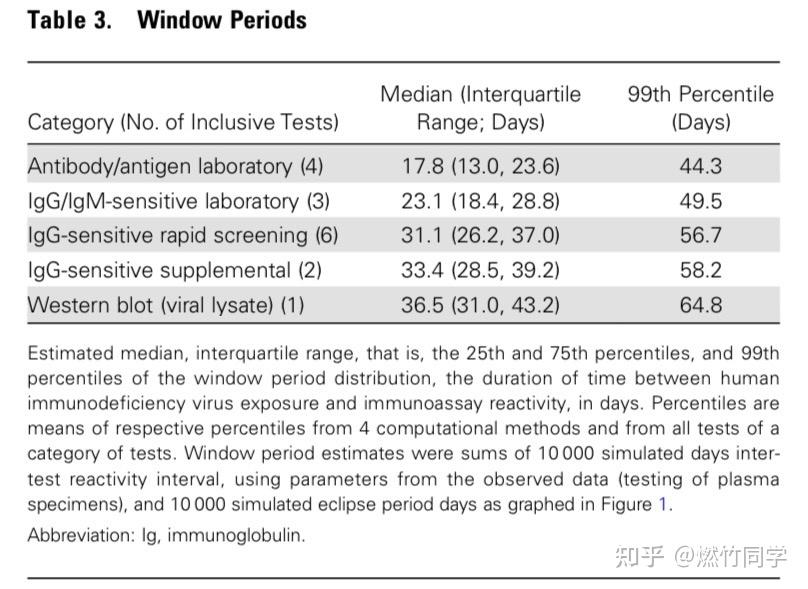
传染病学顶尖学术期刊Clinical Infectious Diseases上发表的论文中窗口期结论,其中第三行代表的是只检测IgG抗体的HIV试纸(rapid screening),比如国内的准信、万孚、大卫、艾博等品牌的血液试纸都是用的这种技术
美国疾控中心官网[2]有关实验室第四代HIV抗原抗体检测的排除时间表述与这篇论文的结论一致,均为45天。
美国疾控中心官网在「何时可以检测到HIV」这个问题上的表述,除了实验室抗体检测和雅培试纸的排除时间不一致以外,其他检测方法的窗口期与这篇论文计算出的时间保持了一致:
1.HIV核酸检测(HIV RNA)在感染后10-33天
2.实验室HIV抗原抗体联合检测在感染后18-45天
3.雅培抗原抗体联合检测试纸在感染后18-90天
(原文的「指尖血」就是专指雅培试纸,美国目前只有一种经FDA批准的用指尖血进行测试的抗原抗体联合检测试纸,那就是雅培试纸,英文全称:Alere Determine HIV-1/2 Ag/Ab Combo)
4.实验室HIV抗体检测在感染后23-90天 (也与我制作的表格基本一致,其中HIV核酸检测的时间,实验室第四代检测的时间,实验室第三代检测的起始时间,与上文表格里的数据完全对应)
美国疾控中心官网有关HIV检测窗口期问题的表述

图片来源:美国疾控中心官网(中文翻译网页)
此外,瑞典国家公共卫生当局和瑞典抗病毒治疗参考小组(RAV)在2015年4月发表了一份立场声明[3],也支持实验室4代检测(基于化学发光或者酶联免疫技术)只需要随访到6周即可结束检测。而床旁快速HIV检测(HIV试纸)则需要随访到8周。
这也与上述发表至顶尖学术期刊 Clinical Infectious Diseases 论文的结论和美国CDC官网的意见一致。
图片来源:Gaines H, Albert J, Axelsson M, et al. Six-week follow-up after HIV-1 exposure: a position statement from the Public Health Agency of Sweden and the Swedish Reference Group for Antiviral Therapy[J]. Infectious Diseases, 2016, 48(2): 93-98.
而Clinical Infectious Diseases 的这篇论文指出,实验室第三代HIV抗体检测窗口期的第99位百分数已经提前到暴露后50天,而不是从前的90天[1]。这也是我并不建议普通人随访到90天的理据之一。如有更多疑问,建议直接阅读这篇论文的原文:
Time Until Emergence of HIV Test Reactivity Following Infection With HIV-1: Implications for Interpreting Test Results and Retesting After Exposure如果您觉得您比这篇论文的作者更懂HIV窗口期,觉得这个数据不可靠,这边建议您直接给论文的通讯作者发Email,或者您也可以发一篇paper去反驳他们。欢迎一切理性的讨论,拒绝所有无脑的质疑,对于服用该文后出现的愤懑,恼怒以及想要骂街等情绪大起大落的表现,本答主概不负责。
HIV试纸不如实验室检测敏感,筛查急性HIV感染建议首选实验室第四代检测,「试纸只有假阳性没有假阴性的说法」只针对窗口期外的标本
有关HIV试纸窗口期的表格里,底部有许多参考文献是评估「雅培试纸」的检测性能的,请仔细阅读上文第二张图片的说明部分,其中第3、5、8、9、10点详细解释了为什么不建议使用「雅培试纸」来筛查急性期HIV感染。
此外,第二张图片的参考文献2-10有力地反驳了「雅培试纸」满2周即可排除的说法。
例如,一篇2015年的Case Report(病例报告)报道了一例急性期HIV感染者在暴露后17-18天时使用专业实验室的第四代-抗原抗体联合检测为阳性,而「雅培试纸」检测呈现阴性的案例,「雅培试纸」直至暴露后第31天才出现抗体阳性[4],如下表。
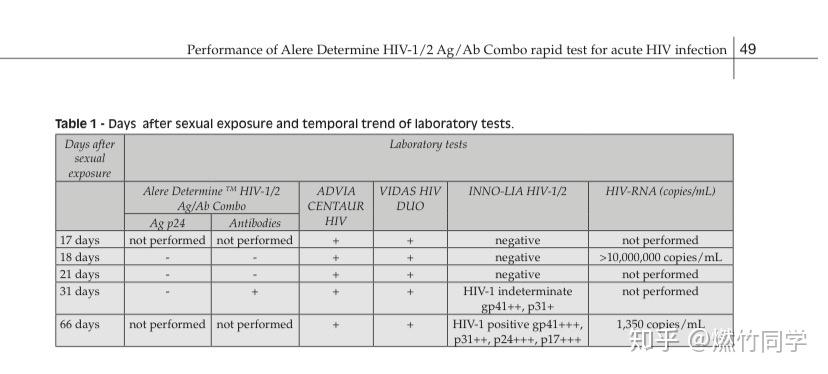
https://www.infezmed.it/media/journal/Vol_23_1_2015_8.pdf上面表格中的 Alere Determine HIV-1/2 Ag/Ab Combo即为小伙伴们口中的「雅培试纸」,实际上,这才是它的正确称呼。雅培于2017年10月3日才成功收购了制造商Alere,因此又被称为「雅培试纸」。

图源:电商宣传图,试纸简称是Alere HIV Combo
不过,「雅培试纸」的制造商Alere对「雅培试纸」抗原检测性能不佳的缺陷进行了多次改进。
例如,2020年最新发表的一篇论文显示,改进版本的「雅培试纸」检测到了77%的Fiebig II-III期(感染后10-19天,此时HIV RNA为阳性,实验室P24抗原检测为阳性,但最晚检出抗体的方法:WB确证实验为阴性)的急性期HIV感染者,而较早版本的「雅培试纸」仅检测到了这些急性期HIV感染标本中的25%[5]。
原文链接不过,这项研究使用的是血浆标本,而不是全血标本,普通人很难自己在家中分离血浆或者血清,只能使用指尖全血,而指尖全血的敏感性明显低于血浆或者血清。

2020年发表的一篇评估最新版本雅培试纸检测急性HIV感染能力的研究论文
并且重要的是,即使是上面这篇针对雅培试纸最新版本的评估论文,也明确表示:雅培试纸在19天时用血浆也最多只能筛查到77%的HIV感染者。
所以,“14天雅培试纸阴性即可100%彻底排除”的说法不可靠!没有任何一篇严谨的学术论文,没有任何一位思维清晰的传染病学者会说出这样的话!
目前尚不清楚国内电商平台上购买到的「雅培试纸」是否针对此缺陷进行了改进,不过根据药监局审批的时间来看,国内电商平台上购买到的「雅培试纸」应该是改进版本,因此,「雅培试纸」的确要比其他试纸更快地筛查出急性HIV感染。
但诚如上文所言,不要对「雅培试纸」的敏感性抱有太大期待,它一定不如专业实验室的第四代抗原-抗体联合检测灵敏。美国疾控中心官网文件也指出了这一点,如下图:

图片来源:美国疾控中心官网文件 Advantages and Disadvantages of FDA-Approved HIV Assays Used for Screening, by test category
国家标准中的“3周、2周、1周左右”可以踩点作为排除时间吗?满21天检测抗体阴性就可以彻底排除了吗?

图片来源:中华人民共和国卫生行业标准WS 293-2019《艾滋病和艾滋病病毒感染诊断》(2019年修订版)
首先,我并不赞同将7天、14天、21天一天不差地作为核酸、抗原和抗体检测的排除时间,诚如Clinical infectious Diseases 那篇论文的作者在文末讨论区中写到的一样:
Depending on how soon after a suspected exposure a person presents for HIV testing, some patients may be retested multiple times during the window period, for example, after the estimated median of a test window period. Regardless, to confirm negative HIV results, individuals should be retested after the elapsed window period. Though the array of approved HIV tests may differ in the United States, our window period estimates and their implications for retesting are consistent with those for other countries that recommend retesting with an Ag/Ab laboratory test 3–6 weeks after possible HIV-1 exposure.[1] 翻译过来的大致意思就是:
根据一个人可疑暴露到距离进行HIV检测时间的长短,某些患者可能会在窗口期(例如,在估计的测试窗口期中位数之后)进行多次重新测试。 无论如何,要确认HIV阴性结果,应在经过一段时间后对个体进行重新测试。 尽管在美国,批准的艾滋病毒检测方法可能有所不同,但我们的窗口期估计值及其对重新检测的影响 与建议在可能暴露于HIV-1后3-6周进行实验室抗原/抗体检测的其他国家/地区的估计值一致。 这里说的测试窗口期的中位数就是我在上文表格里引用这篇论文里的数据:
实验室第三代检测的中位数为暴露后23.1天
实验室第四代检测的中位数为暴露后17.8天
IgG抗体的快速测试(例如万孚、准信)的中位数为暴露后31.1天
WB确证实验的中位数为暴露后36.5天 上述数据正好对应了国家标准中「3周、2周、1周左右」的说法,但请记住,这个数字可以理解为集中转阳的大致时间,或者科学意义上的中位数或者众数时间,但并不能严格作为排除时间。
国家标准中针对“核酸、抗原、抗体的窗口期分别是1周、2周、3周左右”的表述只是针对大多数人采用实验室检测技术集中出现转阳的时间,可以理解为HIV感染后利用实验室检测转阳的中位数或者众数时间,过了这个时间用对应实验室的方法测试阴性可以很大概率排除感染HIV的可能性。
PS:中位数和众数完全可能非常接近,具体请参考文献中针对急性期HIV感染者利用HIV RNA检测出现转阳的时间分布图。
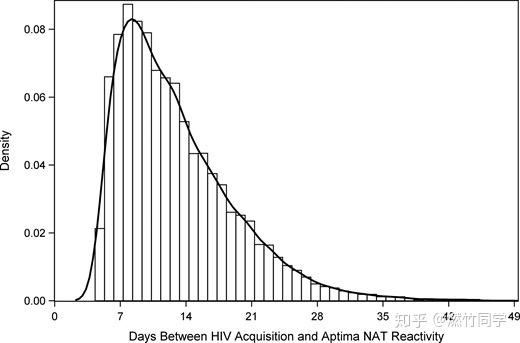
论文作者计算得出的HIV RNA检测的中位转阳时间为暴露后11.5天,从图中也可以看到这也是集中出现转阳的时间,即众数也在这附近[1]
但不能把7天、14天、21天踩点、一天不差地作为对应方法的排除时间,否则可能漏诊一小部分急性期HIV感染者。试纸的敏感性不如实验室检测,则更加不适用于上述窗口期。
HIV DNA检测的特点是什么?可靠吗?可以用于HIV筛查吗?比HIV RNA检测更灵敏吗?其他国家也在用这种技术吗?
HIV DNA检测其实并不是什么新鲜的技术。
早在2000年前后,美国等发达国家就将HIV DNA检测用作了18月龄以下婴儿HIV感染的诊断性检测方法之一[6]。主要是因为他们的阳性母亲会将母源性抗体经胎盘传递给他们,因此对于婴幼儿而言HIV抗体检测或者HIV抗原/抗体联合检测并不可靠。
和 HIV RNA检测一样,HIV DNA检测是使用PCR(聚合酶链式反应)方法进行的核酸检测,它可以检测出外周血单个核细胞(PBMC)中的HIV前病毒DNA。
HIV DNA检测的特点:
- 既可以使用全血样本,也可以使用干血斑样本。
- 只要感染了HIV,即使正在接受暴露后预防用药或者ART治疗,该方法的检测结果仍然会呈现阳性。也就是说,它不受到阻断药或者抗病毒药物的影响。

干血斑
那么,HIV DNA检测的敏感性和特异性如何呢?
目前并不清楚在市面上销售的HIV DNA检测是否进行了优化和改进,但我并没有检索到最新版本的HIV DNA检测用于初筛试验时的敏感性和特异性数据。
不过,2008-2012年间,数篇评估18月龄以下婴幼儿HIV DNA检测能效的论文[7-9]表明:在出生时立即进行HIV-1 DNA PCR试验的敏感性为55%,在出生后2-4周时敏感性增加到>90%,而在3个月和6个月时HIV DNA检测的敏感性才为100%。
目前尚不清楚国内商家宣称的“改进之后的PAP技术”是否能大幅提升HIV DNA早期诊断的敏感性,因为并没有看到相关的学术论文和翔实的数据。但是此前针对出生后婴儿HIV RNA和HIV DNA的数项对照研究表明:HIV RNA检测在感染后早期的敏感性与HIV DNA检测基本一致,甚至高于HIV DNA检测[10-12]。
即便真如国内商家所宣传的那样,那HIV DNA检测也并不会比更广泛使用、价格更低廉的高精度HIV RNA检测快很多天检测到感染。
因此,我个人认为绝大多数普通人群没有必要进行HIV DNA检测,它并不会给你更多的心理安慰,反而很烧钱。此外,值得关注的是:目前FDA批准的HIV测试方法中,并没有HIV DNA检测,美国及其他发达国家也早已将高精度HIV RNA检测纳入了早期感染的首选诊断方法,并取代了HIV DNA检测。

目前FDA批准的HIV检测方法列表,只有RNA检测,没有DNA检测
我该选择何种检测方法?
诚如上文所讲到的那样,HIV试纸并不属于第三代检测,而属于快速检测(rapid tests,RT),HIV试纸没有第几代的说法。
第几代的说法是针对医院或者部分疾控中心的专业实验室开展的检测技术而言,专业实验室通常会使用酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)或者化学发光法(chemiluminescence enzyme immunoassay, CLIA)进行检测。
虽然目前市面上已经出现抗原+抗体联合检测的试纸,比如雅培的试纸(很多恐友叫它雅培四代试纸),但它仍旧是快速检测,并不属于第四代检测,它的敏感性仍然不如专业实验室的第四代检测。第四代检测专指实验室的抗原抗体联合检测。
因此,我们会更青睐于采用实验室的第四代抗原抗体联合检测来筛查近期具有真正的高危暴露行为的急性期HIV感染者,这也与美国CDC的推荐一致。
有些时候,当临床上高度怀疑是急性期HIV感染,或者初筛试验的结果不确定时,我们会采用HIV RNA来筛查和验证这一类病人。
也就是说,如果你的确是在近期发生了真正的高危行为,我们会更推荐你去医院检测,特别推荐采用实验室的第四代抗原抗体联合检测或者HIV RNA检测,能够更好地筛查出急性HIV感染,缩短窗口期。
但如果真的因为种种原因不愿意去医院,也可以采用快速检测的方式,但建议使用血液试纸,而不是口腔黏膜渗出液试纸,因为口腔黏膜渗出液试纸的敏感性明显比血液试纸低,不适合用于急性HIV感染的筛查,下文会具体说明原因。
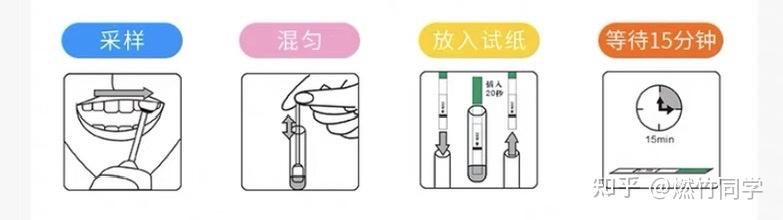
口腔黏膜渗出液试纸的操作步骤,请详细阅读说明书,不是直接用口水!!!
因为对下文进行了全面的更新,为了避免大家没有耐心读下去,所以先在开头交代这个问题的答案:
4周后的试纸检测结果可以开始作为参考,因为多数HIV感染者都会在暴露后26-37天内被HIV试纸筛查出来。但为了保险起见,建议继续随访到暴露后8周,如果8周后试纸结果呈现阴性,并且没有使用暴露前预防(PrEP)、暴露后预防(PEP),中途也没有再次发生高危行为,那么就完全可以排除了,不需要进一步随访检测。
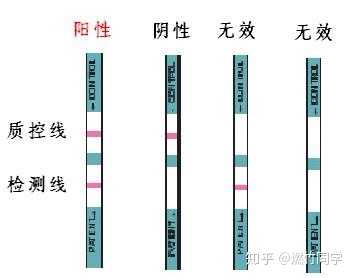
HIV快速检测的结果判定
下文会具体介绍每一代实验室检测技术的特点和窗口期,不过现在包括中国在内的许多国家已经完全淘汰了窗口期较长的第一代和第二代检测技术,它们主要服务于上世纪80-90年代的HIV实验室初筛检测。或许这也是很多人觉得HIV窗口期很长的原因之一:对HIV的认识仍旧停留在上个世纪。
对了,顺带插一嘴,艾滋病的潜伏期和HIV感染的窗口期是两个完全不同的概念。
潜伏期是指感染后的无症状期,这段时间内感染者可能没有任何症状或者症状轻微,不具有特异性,无症状期后才是艾滋病期,会出现典型的晚期症状。
窗口期是指感染HIV后到能通过现有检测手段检出可靠结果的时间间隔。前者可以长达数年甚至数十年,但后者往往在6周或者8周内。
感染后2-4周可能出现持续的高热、肌肉痛、关节痛、咽痛、淋巴结肿大、腹泻和头痛等急性HIV感染的症状,也可能不出现,下文会依据国内外文献的报道对急性期症状作一个详细的分析和说明。
很多人都在问自己出现的症状是不是HIV急性期感染的表现,我想在这里强调一遍:你出现的所有症状都不一定是HIV感染引起的,也没有哪位专家光凭症状就能诊断你有HIV急性期感染的。
你们中间绝大多数人出现的所谓症状,更可能是其他疾病引起的,包括但不限于普通感冒、急性肠胃炎、肠易激综合征、细菌性毛囊炎、焦虑或睡眠障碍引起的复发性阿弗他口炎、焦虑引起的躯体形式表现等等。

恐艾期间的很多症状完全可能是由于严重的焦虑引起
因此一切请以检测为准!一切请以检测为准!一切请以检测为准!依靠症状,既不准确,还会让自己陷入更加焦虑的状态,进而可能出现更多非特异性的症状,陷入「焦虑-恐惧-症状-怀疑-症状增多或加重-更加焦虑-更加怀疑」的死循环。
<hr/>
2020年7月8日更新
因为看到有很多人在评论区留言自己的情况,然后问是否可以排除,所以我将大家最关心的问题放在了本回答的开头,供大家快速浏览重要信息。
如果你有更多的疑问,建议直接通过私信留言提问,联系我付费咨询,将你的具体暴露行为、测试方法、测试结果、测试距离暴露的时间间隔、是否进行暴露前预防或暴露后预防、之前的基础疾病(如肝炎病毒感染、先天性免疫缺陷、其他性传播疾病等),以及你想要获得的帮助通过私信发给我。
付费咨询会获得更高效的帮助,特别是对于恐艾情绪比较严重的小伙伴,以及有很多问题都想要了解的小伙伴。同时,理直气壮的白嫖是不好的,答主的精力也是有限的,如有可能,请为知识付费。我将基于循证医学证据和观点,耐心地解答你的所有疑惑,尽力帮你解除恐艾情绪。
以下内容涉及HIV感染的危险因素、不同行为的感染概率、预防策略、筛查策略、基于试纸的快速检测是否可靠以及解决恐艾情绪等多个干货知识。
这些内容多数基于传染病领域的高影响力期刊上发表的论文、基础理论知识以及临床上所遇到的情况,其中可能有一些知识过于专业,但我会尽量转化成大家能听懂的语言。
同时,下文可能有一些知识你并不十分了解甚至十分陌生,因此如果你有时间,建议耐心地阅读下去,或者收藏起来分多次阅读。
请记住,恐艾的人可能都具有一个共同的特点:没有获取足够可靠的、基于循证医学的艾滋病知识,甚至偏听了许多主观的、极度恐怖的、经不起推敲和考证的虚假言论,比如贴吧网友的现身说法,再比如百度上医生们的众说纷纭(可能没有接受最新的知识),因此对HIV的很多认识是错误的。

Q1:哪些行为可能会感染HIV?哪些行为又属于所谓的「高危行为」?每一种行为感染HIV的几率分别是多大?每种行为背后相对应的预防措施是什么?
「高危行为」是指以下三种行为模式:
1.无保护措施的性行为
没有采取保护措施的性行为,比如没有正确使用安全套和水溶性润滑剂,或者没有进行规范的暴露前预防用药。
这里的性行为包括肛交、阴茎-阴道性交,无论是插入方还是接受方,在不清楚对方的HIV感染状况下而发生没有保护措施的性行为,都会存在着一定的感染风险。
理论上来说,包括无套口交在内的无保护性行为都具有感染HIV的风险,因此也会被算入获得HIV的一种暴露方式。然而,通过无套口交而感染HIV的风险远低于血源性暴露、注射吸毒、无套肛交、无套阴茎-阴道性交等高风险暴露方式,并且在真实世界中,几乎遇不到被证实仅通过无套口交就感染HIV的案例,因此我在这里并不会将无套口交纳入「高危行为」的范畴。
但我仍然建议大家在口交时也要使用安全套,以预防包括生殖器疱疹病毒(HSV)、梅毒(TP)、淋病、衣原体、毛滴虫和引起尖锐湿疣的人乳头瘤病毒(HPV)在内的性传播感染(STIs),这些STIs的病原体在体外存活的时间更长,理论上具有比HIV更高的传播能力。

坚持、正确使用安全套是预防STI的重要措施
▲预防性接触感染HIV的策略
1.全程正确使用安全套和水溶性润滑剂
❶ 在性行为前准备好合适型号的安全套和水溶性润滑剂。建议多准备几个安全套,以应对你旺盛的性欲,在安全套出现破裂之后也好及时更换。
❷ 检查安全套的有效期、生产厂家与合格证
❸ 小心地用撕开安全套的包装袋,不要用嘴和牙齿去撕开,更不要用剪刀等尖锐物品剪开,同时也要注意不要用过长过者过于尖锐的指甲撕开安全套包装袋,以免不小心划破安全套。
❹ 分清安全套的正反面,确认安全套底部卷曲的形状在外面,即是正面。如果不是,就表明戴反了,如果此前已经戴上安全套,建议重新换一个安全套,以免可能出现的体液接触(虽然这种情况下感染HIV的可能性可以忽略不计,但或许有助于预防尖锐湿疣等其他性传播疾病)。
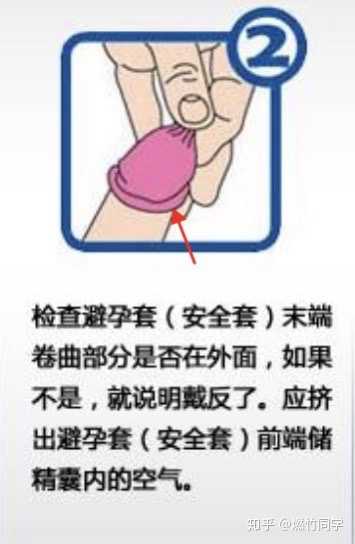
❺ 用一只手将安全套顶端的小球(储精囊)捏扁,另一只手将安全套向阴茎根部逐渐展开至阴茎末端,直到覆盖整个阴茎。
❻ 在阴茎勃起、且没有接触对方性器官之前就套上安全套,这样能有效避免体液接触。一定不能先接触性器官甚至先插入一段时间之后再戴套。

错误示范!!!
❼ 对安全套外部、阴道或直肠内进行充分的水溶性润滑,并在做爱过程中多次补涂润滑剂,防止安全套在性交过程中因为干燥摩擦而破裂。
❽ 性交过程中,要全程佩戴安全套,任何中途取下安全套的行为都有可能传播HIV。性交过程中,安全套如果部分脱落,要立即套回原位。如果完全滑落掉出,或者发现安全套破裂,要立即更换一个全新的安全套。
❾ 射精后,为了防止滑落,应在阴茎勃起时撤出阴茎,撤出时应从阴茎根部紧握住避孕套。在阴茎未软时,取下安全套,将安全套口打结或者用纸巾包住,避免精液溢出。
2.拒绝在性行为前使用助性药物或者毒品
这一类助性药物包括Rush、0号胶囊等(属于毒品),也不建议在性行为前饮酒。因为使用了这些消遣性的药物和酒精之后,更有可能冲动行事,增加了发生不安全性行为的概率。
3.频繁发生高危性行为者,建议考虑暴露前预防(pre-exposure prophylaxis, PrEP)用药
对于频繁发生没有保护措施的性行为的个体,尤其是MSM、跨性别女性、性工作者、未达到持续病毒学抑制的HIV感染者的阴性配偶,我们会评估行为模式,并根据风险的高低来考虑是否给予PrEP。
如果一贯进行低危性行为,例如肛交或阴道性交时坚持使用避孕套、黏膜未接触生殖器分泌物,则一般无需采取PrEP,医生也不会给你开PrEP处方。即使性伴侣是HIV阳性,但能提供过去6个月内病毒载量(HIV RNA)小于200copies/ml的记录,那么也不属于高风险行为,一般无需进行PrEP。
PrEP前需要评估有无HIV和HBV感染,有无骨质疏松,以及抽血化验肝肾功能。
如果已经存在HIV感染,而没有被及时发现,却开始使用PrEP,可能导致耐药毒株的产生,以后再开始接受治疗,就很可能不能使用TDF、TAF、3TC、FTC这几种副作用较小的骨干药物。因此,在开始PrEP前,务必先咨询具有PrEP经验的传染科医生。
图片来源:《中国HIV暴露前预防用药专家共识》[12]
在国外,通常在性传播感染诊所中获取PrEP药物。虽然中国国家药品监督管理局在2020年8月正式批准了舒发泰作为PrEP的方案,但因为刚被批准不久,因此目前可能只有在各个城市的公卫中心/传染病专科医院才能获得PrEP服务。
❶ 方案一:每日给药
PrEP最常用的的方案是TDF-FTC(含富马酸替诺福韦二吡呋酯300mg/恩曲他滨200mg),国内批准的舒发泰就包含这两种成分,每日一次,一次一片。当然还有国内药企生产的仿制药,成分和舒发泰是一样的,也是每天只需要服用一片。
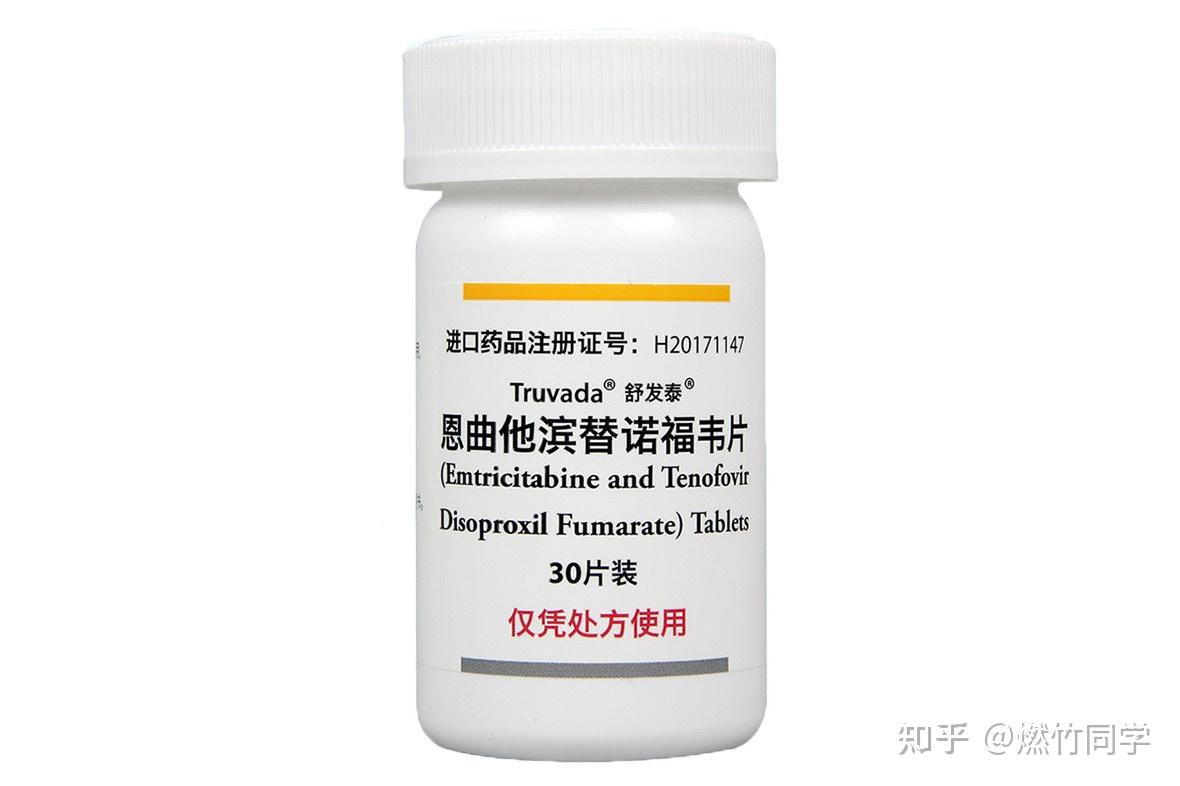
暴露前预防用药:舒发泰(原研进口药)
国内其他可替代的PrEP方案包括:TDF(富马酸替诺福韦二吡呋酯)300mg+3TC(拉米夫定)300mg,每日一次,一次两片(TDF、3TC各一片)[13]。
这种方案适用于任何具有PrEP使用指征的感染HIV的高风险人群。然而,慢性乙肝病毒感染者如果需要PrEP,只能采用每日给药方案。因为采用下面的方案二可能会导致乙肝病毒反弹,导致肝损伤甚至肝硬化。
❷ 方案二:事件驱动型给药(2–1–1方案)

来源:《中国HIV暴露前预防用药专家共识》[12]
这种方案也叫做「按需服药」,仅适合于发生性行为不太频繁(<2次/周)的男男性行为者(MSM),异性恋、跨性别者、注射吸毒者和慢性乙肝病毒感染者都不能采用这种方案。
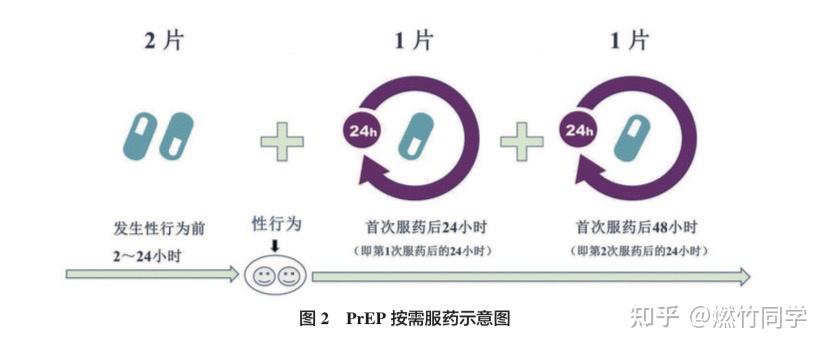
图片来源:《中国HIV暴露前预防用药专家共识》[12]
「2-1-1方案」使用方法:在性行为前2-24小时服用2片TDF-FTC(也就是舒发泰),在有性行为期间每天服用1片TDF- FTC,并在最后一次性行为之后的24小时服用1片TDF-FTC,最后一次性行为之后的48小时再服用1片TDF-FTC。
使用PrEP后仍然需要佩戴安全套预防其他性传播疾病,但是有些高危人群可能不太愿意戴套,那么基于药物的代谢动力学数据[14-16],以及美国CDC的指南[17],我们一般建议每日服药方案的人群:
- 肛交接受方持续使用避孕套至启动PrEP后7日
- 阴道性交接受方持续使用避孕套至启动PrEP后21日
- 目前尚无数据表明单纯的插入方男性需要在使用PrEP后持续使用多久的安全套,但根据我们的经验以及数部指导PrEP的指南,可能至少需要在开始PrEP后持续使用避孕套7日,阴茎组织中才能达到有效的药物浓度。
然而,世界卫生组织以及国际抗病毒学会-美国专家小组发布的指南则表示:对于肛交和阴道性交,开始PrEP用药7天后就可以达到充分的组织药物浓度[18,19]。
对于何时停药,是个较为复杂的问题。只要持续存在感染风险,无论来自主要伴侣还是非主要伴侣,我们认为都应该继续进行PrEP。
如果持续暴露的风险解除,按照PEP的经验,我们一般建议采用每日服药方案的人群,在最后一次暴露行为后继续服用PrEP 28天[14],但在最后一次暴露行为后继续服用PrEP 7天也可能有效[19,20]。

PrEP期间所需要进行的检测与随访内容[12]
▲PrEP的有效性
一项meta分析[21]纳入了14个随机对照试验,8个观察性研究和7个诊断准确性研究,于2019年发表至世界顶尖医学期刊JAMA,其中涉及PrEP有效性的研究样本数为18,244人。该meta分析发现:与安慰剂组或者没有使用PrEP组的人相比,使用PrEP可降低HIV感染风险(2.37% vs 4.18%,RR 0.46,95%CI 0.33-0.66)。在其中6个研究中,服药依从性≥70%的人群(就是能遵从医嘱按时服药,尽量不漏服或者忘记服用),PrEP的有效性更加显著(1.0% vs 4.1%,RR 0.27,95%CI 0.19-0.39)。
1.男男性行为者(MSM)
iPrEx试验[22]在多个国家纳入了2470例HIV血清学阴性的男性和29例自我认同的跨性别女性,并将这些人随机分配到基于TDF-FTC(也就是舒发泰)的PrEP组或者安慰剂组,采用每日给药1次的方案。受试者随访中位时间为1.2年,100例患者在随访期间感染了HIV(PrEP组36例,安慰剂组64例),使用TDF-FTC将HIV感染率降低了44%(95%CI 15-63)。而进一步的研究显示,药物浓度(和服药依从性密切相关)和PrEP的保护效果密切相关,在药物浓度检测提示每周至少使用了4剂药物的患者中,TDF-FTC的保护效果会增加到≥96%。
iPrEx的开放性延长试验[23]进行了为期72周的研究,显示:
(1)如果药物浓度检测显示患者完全没有服药,那么每100人年会有4.7例感染;
(2)如果药物浓度检测显示患者每周服药少于2片, 那么每100人年会有2.3例感染;
(3)如果药物浓度检测显示患者每周服药2-3片,那么每100人年会有0.6例感染;
(4)如果药物浓度检测显示患者每周服药4片及以上,那么没有人发生感染。
所以,药物的依从性(不要漏服、晚服)是确保预防成功的最重要因素。
PROUD试验[24]是一项开放性随机试验,于2016年发表至世界顶尖医学期刊Lancet,它纳入了544例男男性行为者,随机将他们分配到立即开始PrEP组和在1年后给予PrEP组,所有组都是每日服用1次TDF-FTC。立即治疗组只发生了3例HIV感染,而延迟治疗组则发生了20例HIV感染,由此计算出每日PrEP方案可以将HIV感染的相对危险降低(relative risk reduction, RRR)86%(90%CI 64-96)。
那么如果按照「2-1-1」方案服用PrEP,保护效果是否会降低呢?
对此,IPERGAY试验[25]阐明了这一点,它是一项纳入了针对无保护肛交的男男性行为者的随机试验。患者接受的PrEP方案就是上文提到的事件驱动型服药,也就是「2-1-1」服药方案:在性行为前2-24小时服用2片TDF-FTC(也就是舒发泰),在有性行为期间每天服用1片TDF- FTC,并在最后一次性行为之后在继续服用2天的TDF-FTC,每天1片。
IPERGAY的结果显示,入组的400名男男性行为者中有16例新发HIV感染,其中14例用的是安慰剂,2例按需服用TDF-FTC,由此计算出:「2-1-1」方案将男男性行为者的HIV传播率降低了86%(95%CI 40-98)。
针对IPERGAY的一项开放性扩大试验[26]纳入了361例MSM,中位随访时间18个月,结果只有1例没有按照处方进行PrEP的MSM出现了新发HIV感染。
在IPERGAY试验中的参与者中,每个月平均服用15片药,而我们上文提到的iPrEX试验的开放性扩大试验中的参与者每周至少服用4剂药物,而它们获得的保护效果都是将HIV感染风险降低了86%。因此按需服用PrEP只要遵从医嘱服药,也是很有效的。
那么对肾功能更友好的丙酚替诺福韦(TAF)是否也具有相同的保护效果呢?
DISCOVER研究是一项在北美和欧洲针对无保护肛交的MSM的随机双盲试验,发现每日服用TAF-FTC的效果并不亚于TDF-FTC[27]。
2.异性恋男性
伴侣PrEP试验[28]是一项纳入4758对来自肯尼亚和乌干达HIV血清单阳夫妇的随机试验,结果显示与安慰剂相比,TDF和TDF-FTC分别将男性的HIV感染风险降低了63%(984人中有9例感染)和84%(1010人中有4例感染)。
与伴侣PrEP试验相似,TDF2试验[29]纳入了1200例有性行为的博茨瓦纳异性恋男性和女性,在男性中,与安慰剂组相比(331人中有10例感染),TDF-FTC组的HIV感染风险降低了80%(331人中有2例感染)。
3.异性恋女性
针对异性恋女性的PrEP试验得出了不同的有效性数据,有些试验显示TDF-FTC对降低异性恋女性感染HIV的风险无效[30-32],而另一些试验则显示它可以将传播风险降低50%-70%[28,29]。造成这种差异的主要原因是:这些试验的参与者在「好好服药」这件事上的依从性差异悬殊[33,34]。此外,替诺福韦在女性宫颈阴道组织中的浓度相对低于在结直肠组织中的浓度[35,36],因此可能导致保护效果下降。
▲坚持使用安全套预防HIV感染的效果
坚持、正确使用安全套可以有效降低HIV经性传播和获得的风险,这是毋庸置疑的。但安全套到底能起到多大的保护作用可能大多数人并不清楚,我为大家找到了以下数据:
出于医学伦理的考量,这些数据大部分来自于回顾性或者观察性研究。
一项meta分析纳入了12项关于异性恋单阳配偶的研究[37],将安全套的使用频率分为3个等级:总是使用、有时使用以及从不使用。结果显示:从不使用安全套的人群中,HIV的感染率远高于一直坚持使用安全套的人群(6.7/100人年 vs 0.9/100人年)。随后对这些研究的系统分析显示,坚持使用避孕套可以保证90%~95%的有效率。
另一项类似的Cochrane系统评价基于几项针对男-女单阳配偶以及女-男单阳配偶的纵向研究估计,坚持在插入性阴道性交中使用乳胶避孕套使HIV传播的发生率降低了80%[38]。
很多人会问:
燃竹,你不是说在每次性行为中全程、正确佩戴安全套不会感染HIV吗?那为啥这里又说使用安全套只能将HIV的传播风险降低80%~95%?所以戴套是不是还是会感染HIV、还是有必要检测? ⚠️注意了:
首先,这些研究对参与者随访了长达一年甚至更久,并不是单次性行为的数据。一个很简单的道理,随访时间越长,就越有可能在某次性行为中不佩戴安全套或者不正确佩戴安全套。
此外,这些研究得出的安全套降低HIV感染风险的数据是基于试验参与者的自我报告。也就是说——即使参与者坚称在每次性行为过程中都全程、正确地佩戴了安全套,但并不代表事实就是如此。因为参与者可能存在回忆偏差以及技能掌握不到位等情况,从而高估了戴套次数,或者对“正确佩戴”的含义理解有误。
此外,这些研究得出的数据无法保证参与者在每次使用安全套的过程中都没有出现安全套破裂和滑落的情况。因此,这个数据不能外推到正确、全程佩戴安全套的单次性行为中。
对于男男性行为人群(MSM),尽管由于肛交本身更可能导致直肠的伤口和出血,进而增加感染HIV的几率,但在做好充分水溶性润滑,并正确、全程和坚持使用质量合格的安全套的情况下,仍然可以大幅度降低感染HIV的概率。但MSM人群更要注意在长时间性交过程中及时更换安全套,以免破裂。

另外,我想在这个地方驳斥一个「安全套不能预防HIV」的阴谋论。
橡胶安全套的孔隙为 5000~70000 nm, HIV 病毒颗粒的直径只有120 nm ,安全套孔隙既然大于 HIV 的直径,所以HIV可以轻松穿过安全套,进而传播HIV。 针对这个阴谋论,我本身不想作解释,因为稍微有点常识的人都知道正是因为安全套的推广、普及和使用,HIV感染的流行才不至于波及大部分有性行为的人群。并且,世界卫生组织、联合国艾滋病规划署、国家卫生健康委、美国疾控中心和中国疾控中心等权威机构大力倡导使用安全套来预防HIV是为了求个寂寞吗?
那么我们从理论上再来分析一下,HIV病毒颗粒可以穿过乳胶避孕套吗?
HIV广泛存在于人体的体液中,比如血液、精液和阴道分泌物,但它的传播也必须依靠体液的交换才能进行。也就是说,只要乳胶避孕套不漏水,那么HIV病毒颗粒就不能自己穿过安全套。
到底容不容易漏水,小时候把安全套当作气球来玩,往里面灌水的同学最清楚。此外,早在1987年,在体外试验中也已证实HIV病毒颗粒不能穿透乳胶避孕套和聚氨酯避孕套[39]。
另外,安全套和避孕套也是一个东西,没有区别,并不存在「安全套才能预防HIV,而避孕套不能预防HIV」的说法。
综上所述,坚持在每次性行为时正确使用质量合格、在保质期内的安全套和水溶性润滑剂,并且在长时间性交过程中及时更换了安全套,可以使HIV感染的风险无限趋近于0。
在正确使用了质量合格的安全套和水溶性润滑剂的情况下,真的无需担忧感染HIV。除非安全套确实已经破裂,这种情况通常见于没有充分进行水溶性润滑、安全套已过期、长时间性交不更换安全套。
如果你正确使用了安全套和水溶性润滑剂,也没有发现安全套有肉眼可见的明显破裂,那么请别告诉我你的行为是「高危行为」,也无需因为这次行为而刻意进行检测,我也不会鼓励你因为这次行为而去做检测。
但高危人群(如MSM、性活跃人群、吸毒者、性从业人员等)有必要保持一定频率的常规筛查。
有关不同人群筛查HIV的频率推荐会在下文提及。
此外,在使用安全套的同时,搭配水溶性润滑剂也至关重要,因为油基润滑剂(凡士林、婴儿油、按摩油、矿物油)会削弱乳胶材质的安全套,进而增加安全套破损的风险。但在使用聚氨酯材质的避孕套时,油基和水溶性的润滑剂都可以一起使用。
▲不同的性行为感染HIV的几率
以下是基于多项队列研究通过建模估算出的HIV血清单阳配偶中不同类型的性行为引起HIV传播的风险[40],该研究于2014年发表至艾滋病领域的SCI期刊AIDS上,并同时被美国疾控中心(CDC)所采纳。不过,这种感染几率是建立在对方已经感染HIV并且没有接受抗逆转录病毒治疗,没有采取安全措施(安全套、PrEP),但也没有感染的放大因素的情况下(如伤口、出血、溃疡、同时合并有其他性传播疾病感染)。
需要强调的是,这些数据是基于一夫一妻制得出的结论,如果多次与不同的性伴侣发生高危性行为,或者存在放大因素,预计感染HIV的风险将大幅增加。例如,一项模型提示,当有晚期疾病的男性传染源和有生殖器溃疡性疾病的女性发生性行为时,HIV的传播率可能高达每3次插入性肛交就会发生1例传播事件[41]。
● 肛交接受方—每72次性行为中发生1例传播(138/10000)
● 肛交插入方—每900次性行为中发生1例传播(11/10000)
● 阴茎-阴道性交接受方—每1250次性行为中发生1例传播(8/10000)
● 阴茎-阴道性交插入方—每2500次性行为中发生1例传播(4/10000)
● 阴茎口交接受方或插入方—每10000次性行为中发生0-4例传播(0-4/10000)
● 咬伤、吐痰、体液飞溅(包括精液和唾液)、共用性玩具—风险可忽略不计

▲包皮环切术能降低感染HIV的风险吗?
此外,值得注意的是,和已经接受了包皮环切的异性恋男性相比,未接受包皮环切术的男性感染HIV的可能性更高。可能的原因是:HIV由异性恋女性传播给异性恋男性并不一定需要生殖器或龟头的破损和伤口,因为男性包皮中天然存在HIV的靶细胞,并且密度较高,这些靶细胞主要是朗格汉斯细胞和巨噬细胞[42]。
在非洲进行的多项随机对照试验控制了暴露行为、安全套的使用和求医行为等变量,最后仍然得出结论:包皮环切术将HIV由女性传给男性的风险降低了50%~60%[43-46],并且这种获益可能是持续的[46]。
虽然从理论上来说包皮环切术也能降低MSM人群中的插入方感染HIV的风险,但目前仍然没有在MSM人群中开展相关的随机对照研究,因此包皮环切对于MSM人群预防HIV感染的具体获益仍不清楚。一项meta分析纳入了15项观察性研究,样本由53,567名MSM组成,其中52%接受了包皮环切术,发现接受了包皮环切术的男性中感染HIV的风险要低14%,但这种差异并没有统计学上的意义[47]。
可能的原因是:MSM人群(男男性行为者)可能并不是固定的做插入方,也有可能既做插入方,也做接受方,或者只做接受方。而包皮环切术从原理上来讲,似乎只能降低插入方的HIV感染率。

2.血源性传播
已有多项研究[48-50]评价了不同类型的血源性暴露行为感染HIV的风险,这些风险的评估仍然是基于已知感染了HIV的暴露源而计算得出:
● 输血—每10次暴露发生9次感染(9000/10000)
● 共用针头或注射器—每150次暴露发生1次感染(67/10000)
● 经皮针刺—每435次暴露发生1次感染(23/10000)
● 黏膜暴露于感染者的血液(例如,血液溅至眼中)—每1000次暴露发生1次感染(10/10000)
● 其他暴露(例如,被感染者咬伤)—每25000次暴露发生1次感染(可忽略不计)
HIV感染风险增加有密切关联的血源性暴露因素还包括:深度损伤;被肉眼可见污染的器械伤及,并且污染物为HIV感染者的血液;被已经穿刺过静脉或者动脉的针头扎伤;传染源目前处于HIV感染晚期[51]。
3.母婴传播
我国的母婴传播得到了有效的控制。
HIV阳性妇女在备孕前进行产前咨询,如果尚未启动ART,应该遵医嘱尽快启动有效的抗逆转录病毒治疗(ART),并且终生维持ART。在病毒载量得到有效抑制之后再考虑妊娠。
产前开展多轮HIV筛查,如果在妊娠期被筛查出HIV阳性,建议尽快启动ART,以尽量在产前达到病毒学抑制,减少母婴传播风险。如果在妊娠期难以达到病毒学抑制,要考虑剖宫产娩出婴儿。
HIV阳性母亲娩出的婴儿在出生后都应该立即进行HIV的暴露后预防。
Q2:除了上面的因素以外,还有没有其他重要的因素会影响感染HIV的风险?
有。
1.传染源的病毒载量是多少?是否在吃药?
如果对方是HIV感染者,并且正在进行抗逆转录病毒治疗(antiretroviral therapy, ART),保持了较高的依从性,那么6个月后他血浆中的HIV病毒载量(HIV RNA)极可能已经低于检测下限(<200 copies/ml),将这个状态继续保持6个月后,此时他不再具有经性行为传播HIV的能力[52-58]。
也就是联合国艾滋病规划署(UNAIDS)、美国疾控中心(CDC)和美国国家过敏症和传染病研究所(NIAID)所宣传的Undetectable = Untransmittable,即U=U。

图片来源:联合国艾滋病规划署(UNAIDS)

图片来源:U=U中国抗艾网络
图片来源:美国国家过敏症与传染病研究所(NIAID)
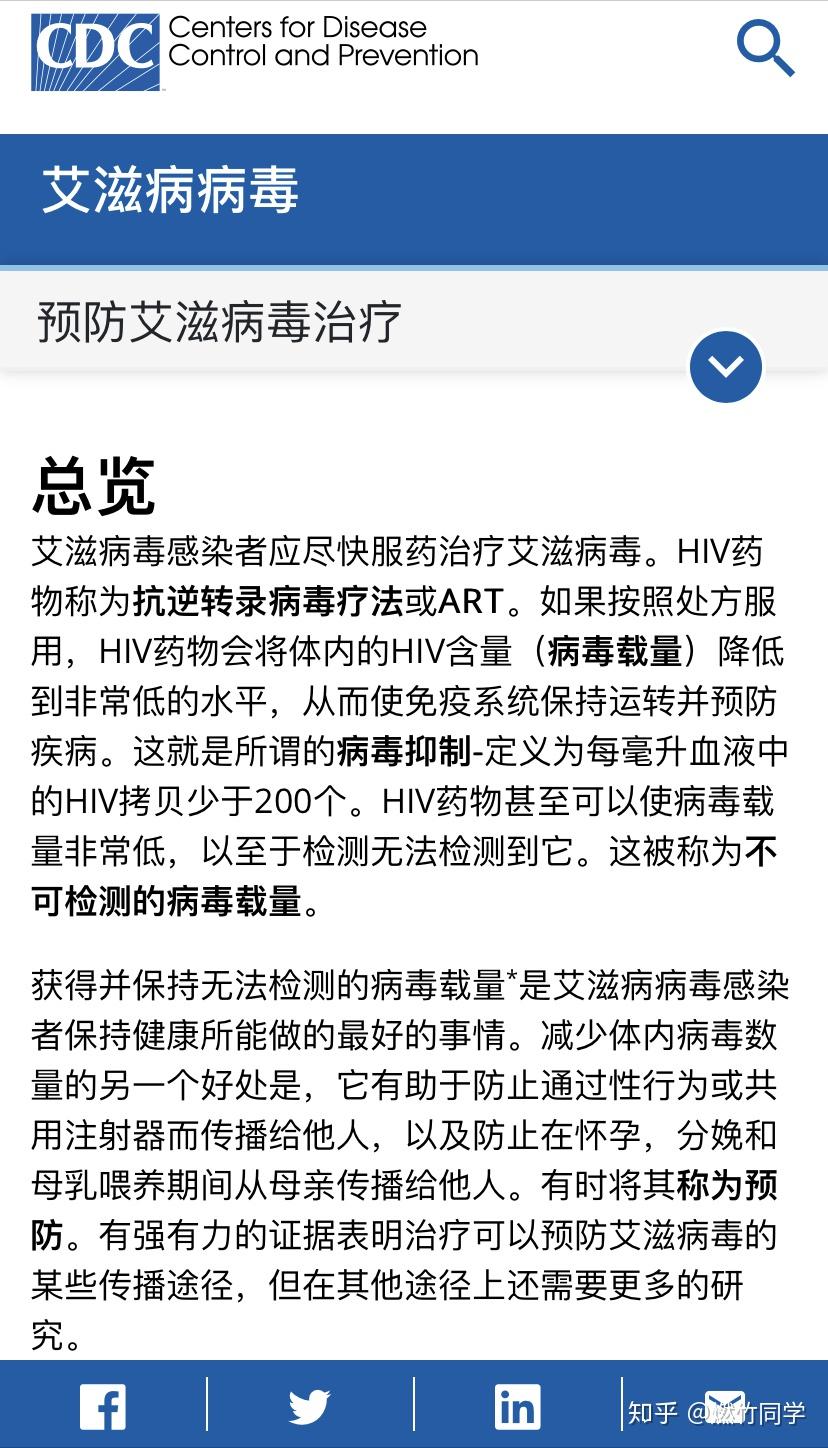
图片来源:美国疾控中心(CDC)官网中文翻译
当然,这一结论也在2018年11月份首次得到中国国家卫生健康委员会和中国疾控中心流行病学首席专家吴尊友研究员的公开支持。
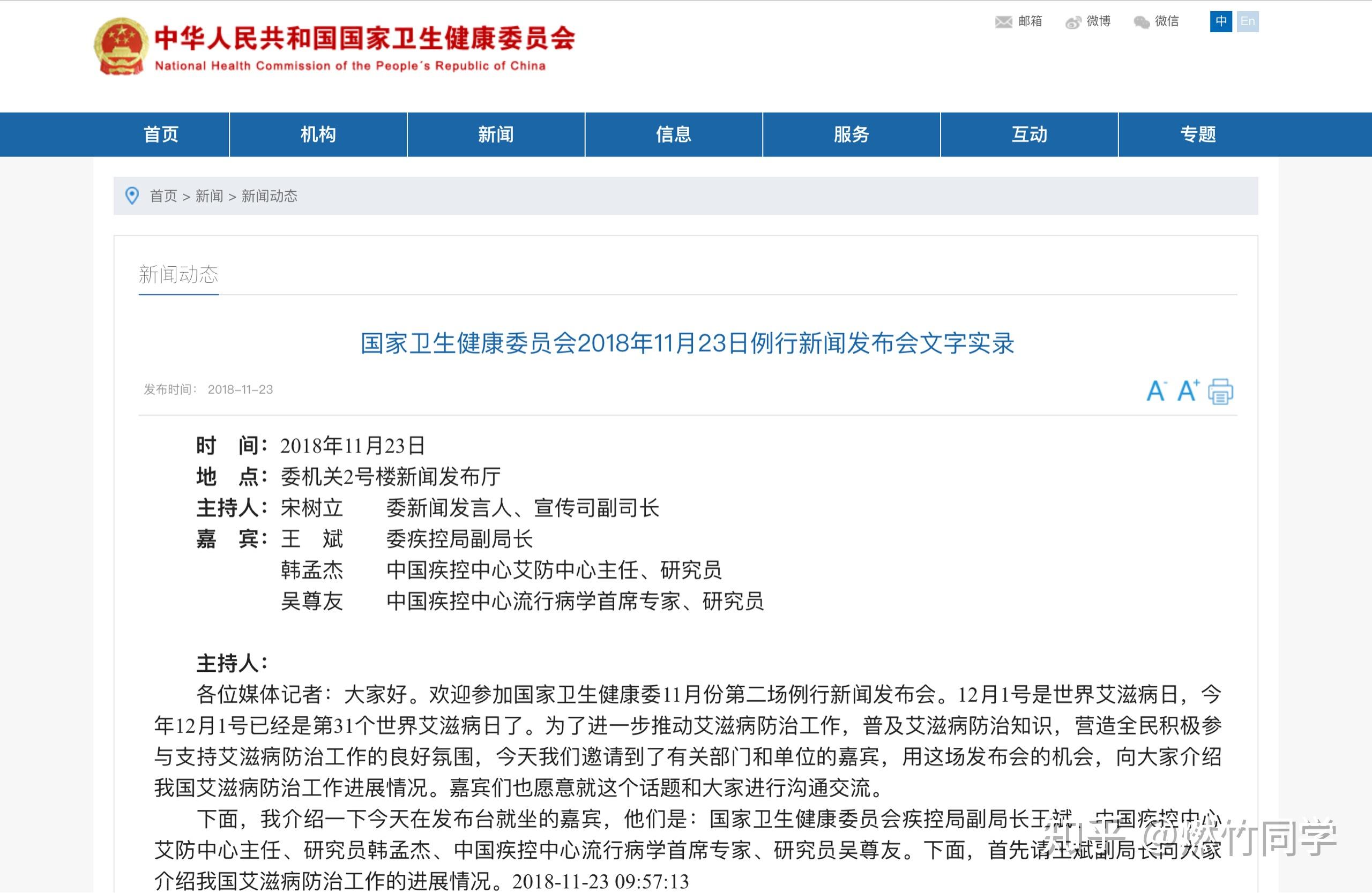

图片来源:中国国家卫生健康委员会官网
这一结论是基于上千对HIV单阳配偶(包括MSM人群)随访数年得出的结论,并有多项队列研究相互印证这一结论,相关研究已多次刊登在柳叶刀(Lancet)、新英格兰医学杂志(NEJM)和美国医学会杂志(JAMA)等国际顶尖医学期刊上。
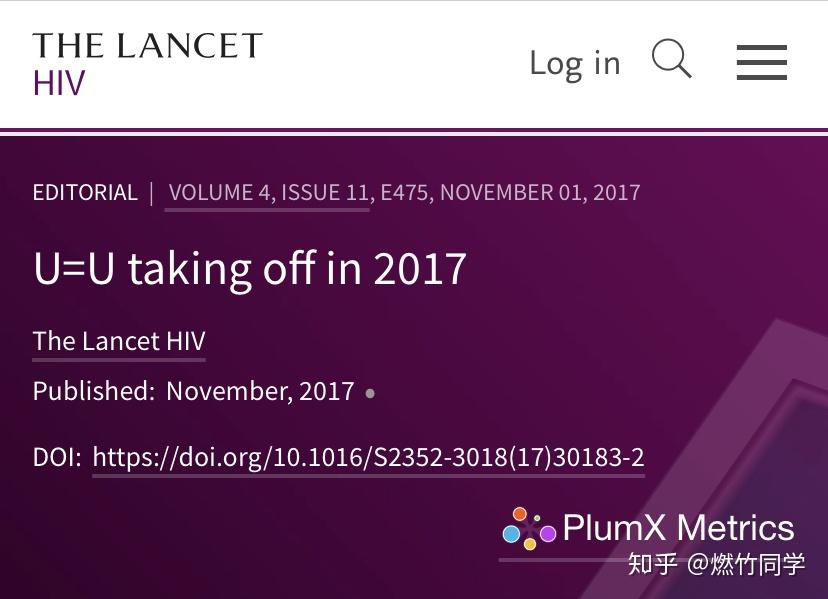
图片来源:The Lancet HIV官网
ART的组成方案一般是3种不同的药物,需要每天定时服用。
相反,如果传染源目前正处于HIV感染的急性期或者晚期阶段,病毒载量可能非常高,传播HIV的风险极高[59]。因此,有许多HIV传播事件都来自于HIV急性期感染者,和不知晓自己的感染状况或者没有服药的传染源,而不是已经在连续服药,病毒载量也已稳定低于检测下限的HIV感染者。
比如,一项来自马拉维的模型研究估计,在马拉维的所有HIV传播事件中,有38%的传播可被归咎于与急性HIV感染者的性接触[60]。
2.存在其他性传播感染(sexually transmitted infection, STI)
其实在上文已经说过,只要其中一方有合并其他STIs,比如生殖器疱疹、梅毒、尖锐湿疣、淋病等,那么感染HIV和传播HIV的风险都会成倍增加。
例如,一项研究纳入了174对乌干达单一性伴侣且血清单阳配偶,发现生殖器溃疡患者的HIV传播几率大约是无溃疡者的4倍[59]。
所以再次凸显了安全套在预防HIV感染和其他STIs时的重要作用,记得每次都要正确佩戴安全套,中途不要拔掉安全套继续性交。
Q3:如果我不清楚对方的HIV感染状况,我感染HIV的几率有多大?
是的,很多人都不知道对方的HIV感染状况。因此,从HIV感染状况不明的传染源患者获得HIV的可能性 = 传染源是HIV感染者的可能性 × 具体性行为传播的可能性。
如果对方是普通人群,就利用他所处地区人群的HIV感染率× 具体性行为传播的可能性;如果对方是高危人群,就要利用这个群体的HIV感染率× 具体性行为传播的可能性。
例如,NHANES(2003年-2006年)研究发现,18-39岁美国男性中HIV感染的患病率为0.43%[61],因此在2003年-2006年期间,在美国发生单次阴道性交随机事件的接收方,传播风险估计约为0.0043 × 0.001,约为每233,000次性行为会发生1次感染。
Q4:发生高危行为后72小时内,我可以进行阻断(PEP)吗?阻断后我应该在什么时间点进行筛查以排除感染HIV的可能性?
如果在高危行为发生后的72小时内,建议前往自己城市的传染病专科医院(具体名单如下图)咨询阻断事宜。阻断的最佳时机是暴露后24小时内,但72小时内仍然有效,越早服用阻断药,阻断成功的可能性越高。
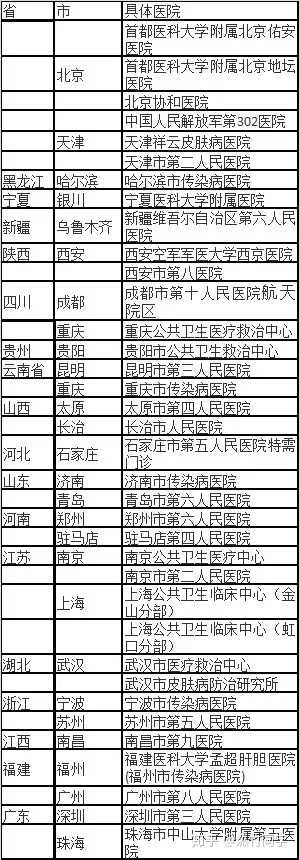
全国主要城市可以提供阻断的医院
进行PEP之前,可能需要进行的检测项目包括:
● 如果可以找到传染源,应该立即对TA进行HIV检测(最好采用第四代检测或者HIV RNA检测)、乙肝两对半检测、丙肝病毒抗体检测、梅毒血清学检测、淋病核酸检测、衣原体核酸检测。
● HIV抗原抗体检测或者HIV抗体检测
- 然而,为了尽快服用第一次PEP药物,以提高阻断成功率,我通常会建议在获得HIV检测结果之前就立即服下第一次PEP药物。等到后续HIV检测结果出来之后再决定是继续服用PEP,还是因为HIV阳性血清学结果而转去ART治疗。
- 我不建议为了等待基线HIV检测结果而延迟第一次PEP服药时间,在美国对医务人员一般也会采用我给到的上述建议,在基线HIV血清学检测结果出来之前就立即使用1日量的PEP“启动包”。
● 梅毒血清学检测(首选TPPA/ELISA/CLIA,或者可以选择RPR/TRUST,前者灵敏性特异性更高)
● 丙肝病毒抗体检测
● 乙肝病毒表面抗原(HBsAg)、乙肝病毒核心抗体(anti-HBc)和乙肝病毒表面抗体(anti-HBs)
● 全血细胞计数和分类计数(血常规)
● 肝功能检测(ALT、AST、胆红素等)
● 肾功能检测(血清肌酐水平、血尿素氮水平)
● 空腹血糖、血脂检测(选做,使用克力芝或者普泽力方案时为必做)
暴露后预防(post-exposure prophylaxis,PEP)服药一般要连续服用28天,一定不能漏服、少服、晚服,更不要擅自停药,最好定一个闹钟提醒自己按时服药。因为服药的依从性是阻断是否能成功的关键因素之一,只有保持较高的依从性才能最大程度发挥阻断药的作用,否则就可能阻断失败。
阻断过程中可能需要定期监测血常规、肝功、肾功、血糖、血脂。遇到药物的不良反应是正常的,比如恶心、呕吐、腹胀、头痛、疲劳、乏力等,请勿自己停药,一般1-2周后这些药物副作用都会消失或减轻,遇到严重的不良反应请及时复诊。
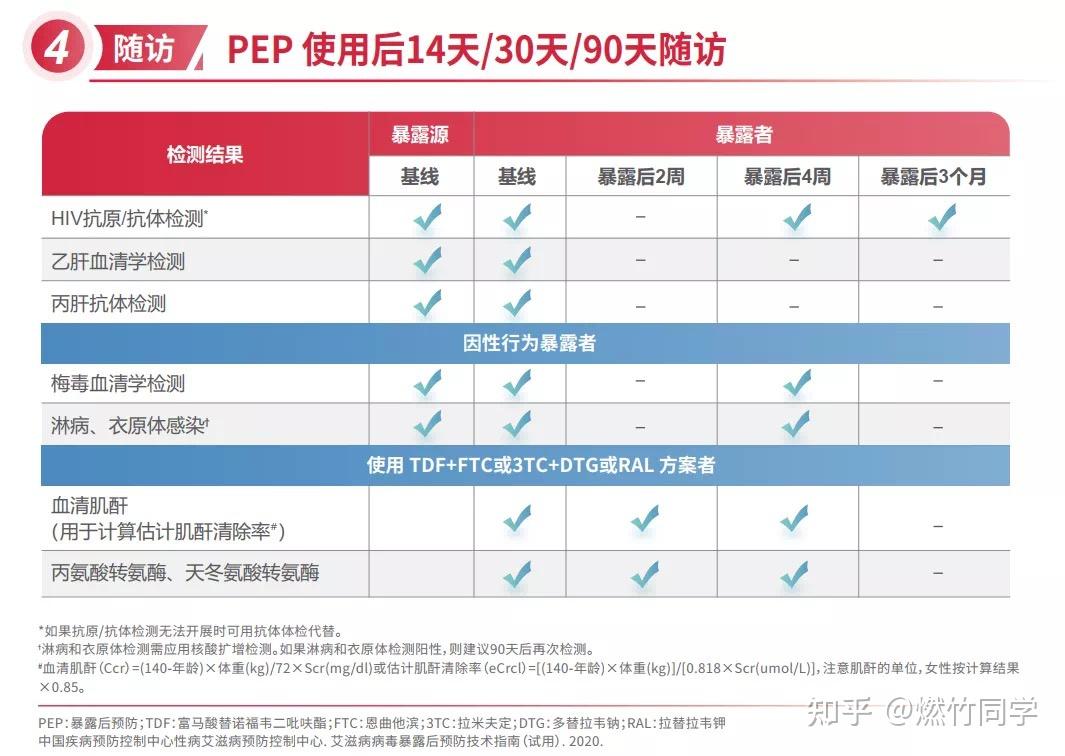
进行PEP之前需要进行HIV+梅毒+乙肝+丙肝的基线检测,结束PEP后会继续进行HIV的随访,以确定是否阻断成功。与美国CDC的推荐[62-64]一致,我们推荐首选基于专业实验室的第四代HIV抗原抗体联合检测,并且在以下时间进行随访:
- 暴露后4-6周和3个月时应进行HIV检测[65],如果出现HIV感染的急性期症状,无论何时,都应该进行HIV检测。暴露后3个月HIV检测阴性可以排除HIV感染的可能。
- 对于HIV暴露后4-6周出现急性丙肝病毒(HCV)感染的患者,美国CDC推荐在暴露后6个月追加1次HIV检测[65]。
此外,在为期28日的暴露后预防期间,我们不建议任何人进行HIV检测,不论是抗原-抗体联合检测、抗体检测还是HIV RNA检测。因为HIV存在窗口期,并且在暴露后预防期间,HIV可能会被抗病毒药物抑制。此外,美国2016年发布的HIV非职业性暴露后预防指南[65]指出:
Transient, low-grade viremia has been observed among persons exposed to HIV who were administered antiretroviral nPEP and did not become infected. 翻译过来就是:
在接受抗逆转录病毒nPEP治疗而未被感染的艾滋病毒暴露者中,观察到短暂的低病毒血症。 也就是说:假如你的确接触到HIV,并且HIV也顺利进入了你的体内,你及时服用了阻断药,没有被感染,但在服用阻断药的28天期间如果你检测HIV RNA,可能出现病毒载量较低(通常不超过3000拷贝/ml)的假阳性情况,但这并不代表你感染了HIV。因此不建议在服药期间检测HIV,不论是什么类型的检测。
具体的暴露后随访要求请参考美国疾控中心2016年发布的非职业性HIV暴露后预防指南:
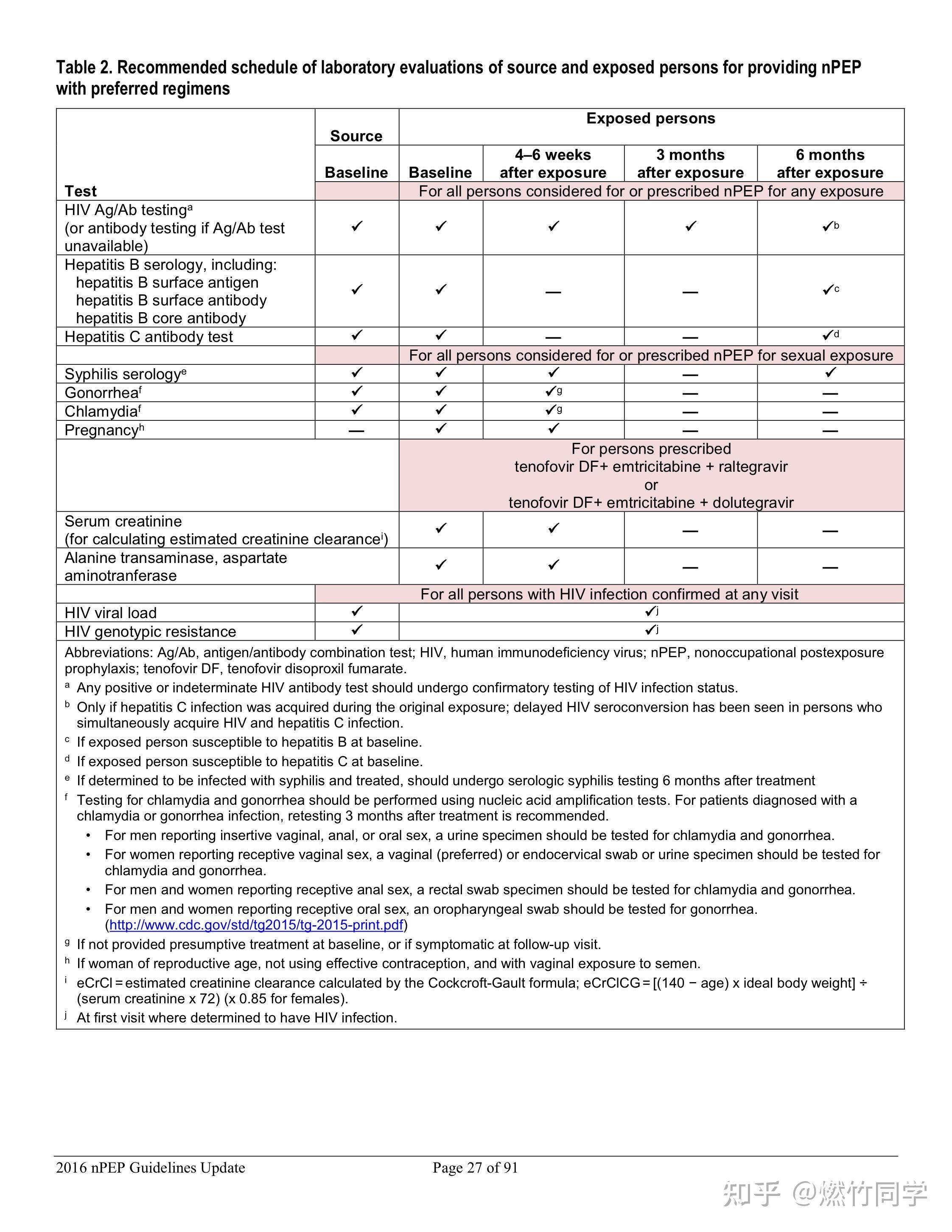
图片来源:Updated Guidelines for Antiretroviral Postexposure Prophylaxis After Sexual, Injection Drug Use, or Other Nonoccupational Exposure to HIV— United States, 2016[65]
中国疾控中心在参考美国疾控中心的这份指南的基础上,也在2020年10月发布了《艾滋病病毒暴露后预防技术指南(试用)》[66],原文件如下:
艾滋病毒暴露后预防技术指南(试用).pdf其关键点信息如下:

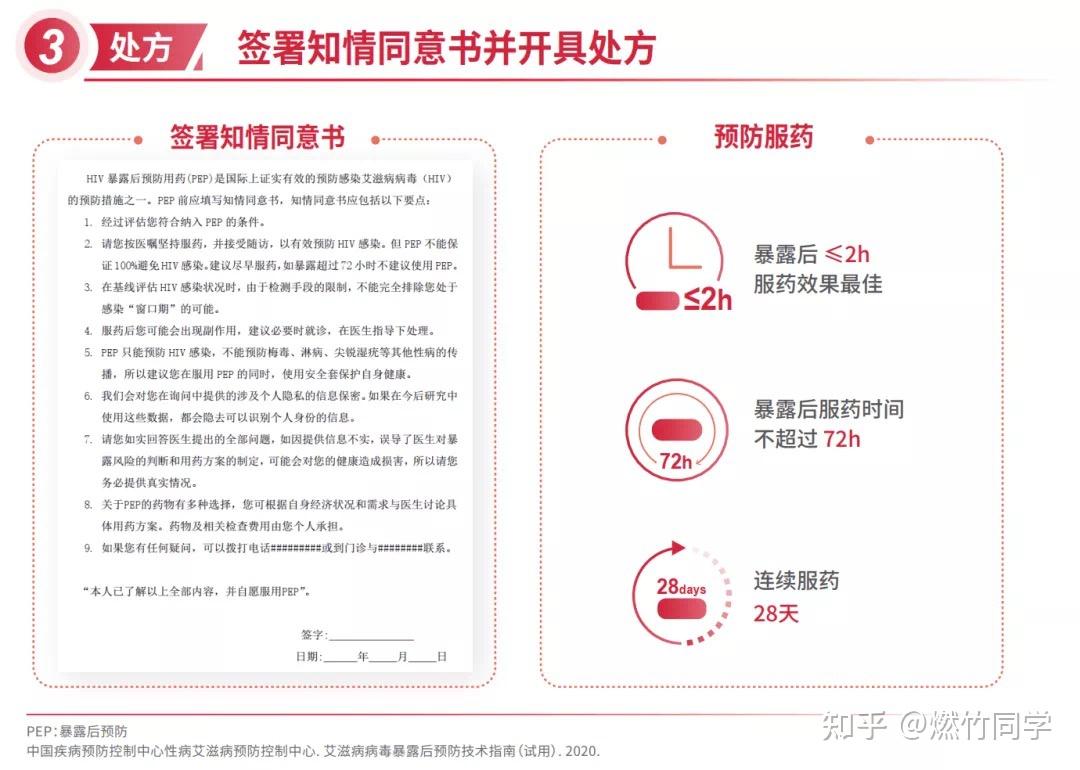
有关HIV的非职业性暴露后预防(nonoccupational post-exposure prophylaxis, nPEP)的更多详细知识我会在我的后续更新中详细介绍,仍然在这篇回答中进行更新,感兴趣的同学可以关注。
Q5:我没有进行阻断,请问在接下来我该选择什么方法进行筛查?
我们推荐首选专业实验室的第4代HIV抗原-抗体联合筛查技术,第4代联合检测可以检出HIV的IgM抗体+IgG抗体,并且相比第3代单纯抗体检测,第4代技术还能同时检测HIV P24抗原,进一步缩短了窗口期,对于恐艾人群来说是一个优选项。
其次,可以选择专业实验室的第3代基于ELISA或者化学发光法的单纯抗体检测。

实验室检测尤其是专业实验室的第四代抗原-抗体联合检测,相比于试纸具有更高的敏感性,更适合筛查急性HIV感染
如果因为种种原因不愿意去医院进行第4代抗原-抗体联合检测和第3代单纯抗体检测,那么也可以选择快速免疫层析试验,也就是大家口中所说的HIV试纸。
但大家务必要了解:实验室的检测技术会比试纸的敏感性更高,能更好地检测出急性感染,试纸诊断急性HIV感染的敏感性不如实验室检测。例如,一项研究表明:基于试纸的快速抗体检测会漏诊大约12%的急性HIV感染者[67]。
这项研究是一项前瞻性研究,它纳入了美国12家性传播感染诊所和社区诊所的86,836例患者,对于HIV快速抗体检测(试纸检测)呈现阴性的人,随后使用了实验室的第4代抗原-抗体联合检测和HIV RNA混合检测进行HIV感染的筛查[67],在快速抗体检测阴性的85,690例患者中,发现168例存在急性HIV感染;在通过HIV RNA检出的患者中,使用实验室第4代抗原-抗体联合检测技术发现了其中的134例(82%)。
也就是说,对于那些使用HIV试纸检测呈现阴性的急性HIV感染者,实验室第4代抗原-抗体联合检测技术可以发现其中82%是阳性[67]。
所以对于那些在窗口期内想要获得准确结果的同学而言,实验室的第4代抗原-抗体联合检测最合适,虽然它没有HIV RNA那样高度敏感,但也比你所使用的试纸敏感得多,能够在急性期内筛查出80%左右的感染者,并且价格也比最敏感的HIV RNA检测便宜得多。
不过,这是在HIV窗口期内的情况,一旦过了4-6周的窗口期后,试纸也能陆续筛查出这些急性期感染者。
如果已经决定好用试纸进行筛查,那么建议使用基于血液的HIV试纸而不是基于口腔黏膜渗出液或者尿液的试纸,这一点对于近期有HIV暴露的人群来说至关重要。因为口腔黏膜渗出液检测的敏感性明显低于指尖采血检测[68]。
例如,一项回顾性观察研究探讨了使用口腔液体检测HIV的血清转化,发现287例受检者中的80例出现了233次假阴性结果[69]。同时,美国CDC表示,使用家用口腔液体检测HIV时,高达8%的感染者可出现假阴性结果[70]。
Q6:医院实验室的检测技术,窗口期是多久?多久能排除?
根据此前发布在国外传染病学SCI期刊上的论文,我为大家整理了这份基于实验室不同检测技术的HIV窗口期,供大家参考:

HIV实验室检测技术的窗口期
我国已经完全淘汰了第一代检测技术和第二代检测技术,目前在医院能见到的检测主要是第三代单纯抗体检测和第四代抗原抗体联合检测,因此窗口期大约在15-30天,其中第三代的窗口期为20-30天(3~4周左右),第四代为15-20天(2~3周左右)。
但为了保险起见,我们通常会根据检测经验建议大家:如果使用的是实验室的第四代抗原-抗体联合检测,满4周阴性基本排除;如果使用的是实验室的第三代单纯抗体检测技术,满6周阴性基本排除。
这个时间点后检测阴性,可以安心。
如果为了追求完美,可以根据论文的研究结论,在第99位百分数后检测HIV,那么则可以完全排除,因为已经考虑到了极端个体差异等情况。
意味着99%以上的HIV感染者在使用实验室的第四代抗原-抗体联合检测时会在暴露后45天内转化为阳性,99%以上的HIV感染者在使用实验室的第三代单纯抗体检测时会在暴露后50天内转化为阳性。
如果没有严重的先天性免疫缺陷,也没有进行暴露后预防(PEP)、暴露前预防(PrEP),或者中途再次发生高危行为,那么无论先前的行为如何高危,症状有多么像HIV感染,在满足上面的时间点之后,都可以彻底排除HIV感染的可能性了。
Q7:电商平台(京东、天猫)上广泛流通的单纯抗体检测试纸(你们口中的「三代试纸」)靠谱吗?这种单纯抗体检测的试纸窗口期是多久?多久能排除?
只要能在药监局官网上查到备案信息的试纸,并且也经常出现在中国疾控中心的HIV试纸年检名单上的品牌,基本都是可靠的,但要注意查看试纸的保质期以及包装是否完好,避免失效。
诚如上面所言,试纸的窗口期可能的确不如实验室的专业检测,但美国CDC和世界卫生组织(WHO)也建议在家庭中或者在资源有限地区采用快速检测的方法[70,71],WHO在2016年时还专门发布了立场声明支持个人进行自我检测[71]。
此外,我们国家大部分地区的县级疾控中心、基层医疗单位以及自愿咨询门诊(VCT)都在使用HIV试纸来给咨询者进行免费的筛查,而不是化学发光、ELISA等实验室检测方法,因为HIV试纸更加快速,也更节省成本。不难看出,其实不只是美国CDC、世界卫生组织和大部分国家,我们国家也是认可了HIV试纸的检测能效的。
中国疾控中心每1-2年就会对市面上正在流通和销售的HIV试纸的灵敏性、特异性和功效率进行评价,结果表明:用已经通过确证实验的HIV阳性血样,来检测试纸的敏感性,大多数试纸敏感性都是100%或接近100%。
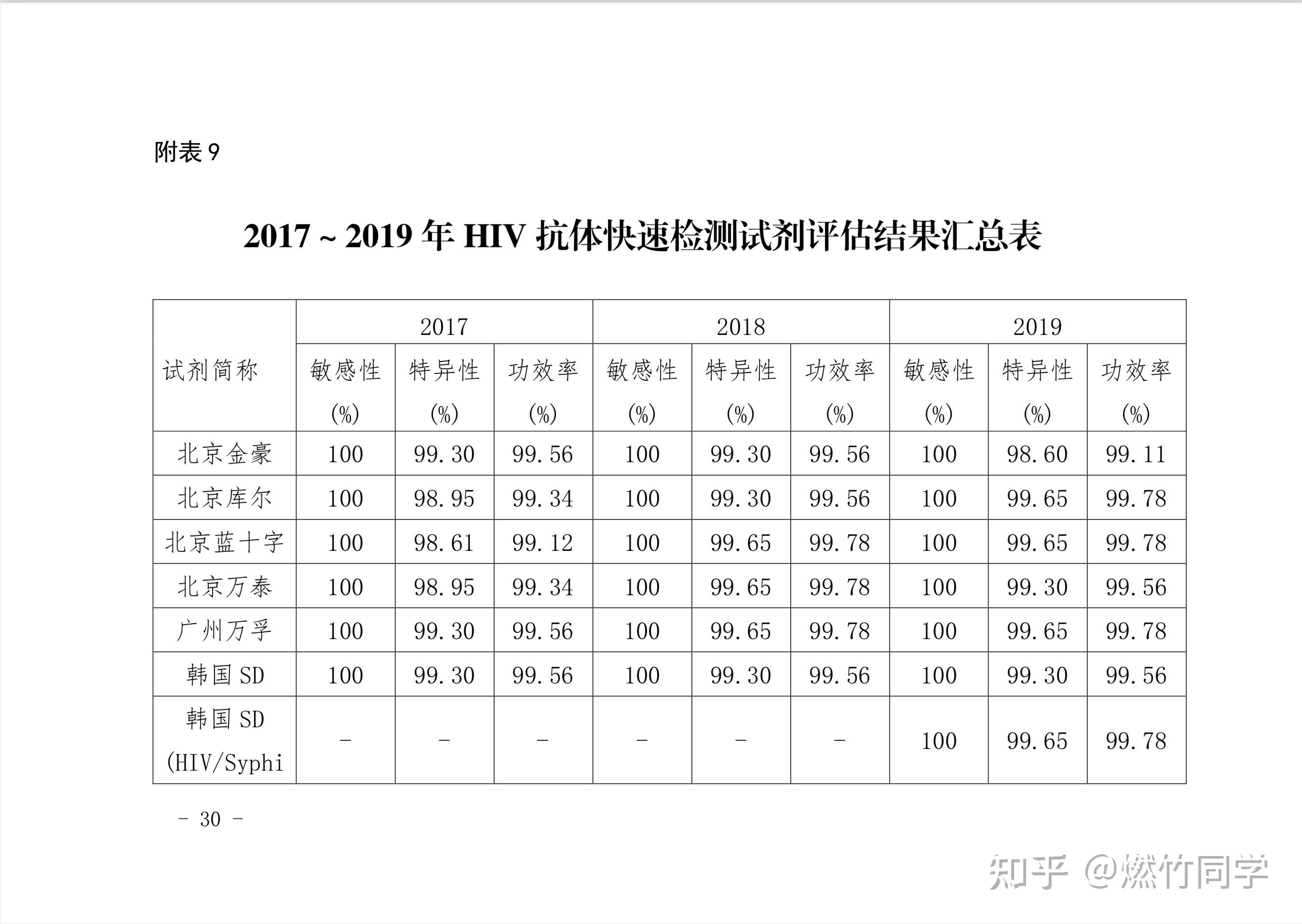
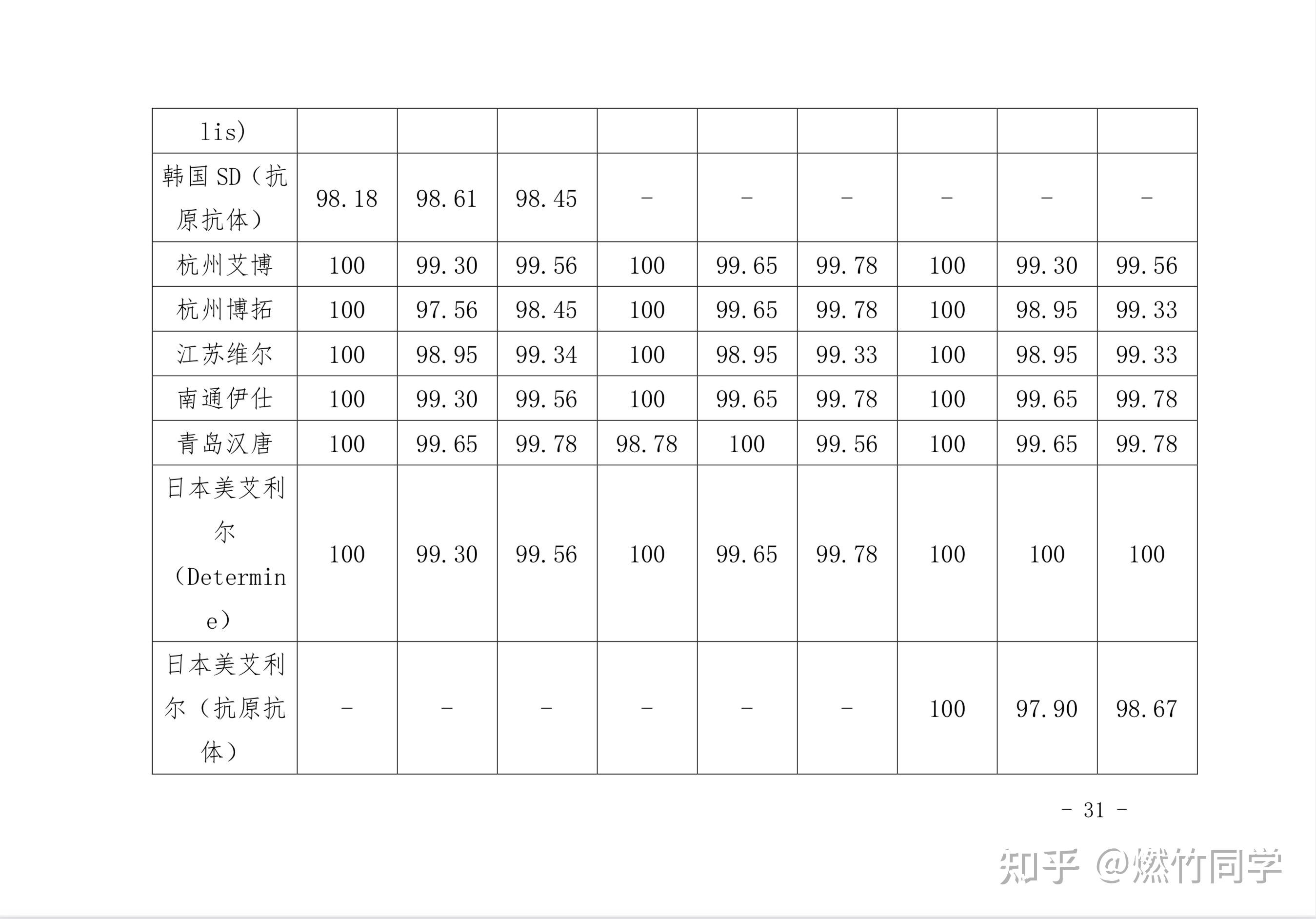
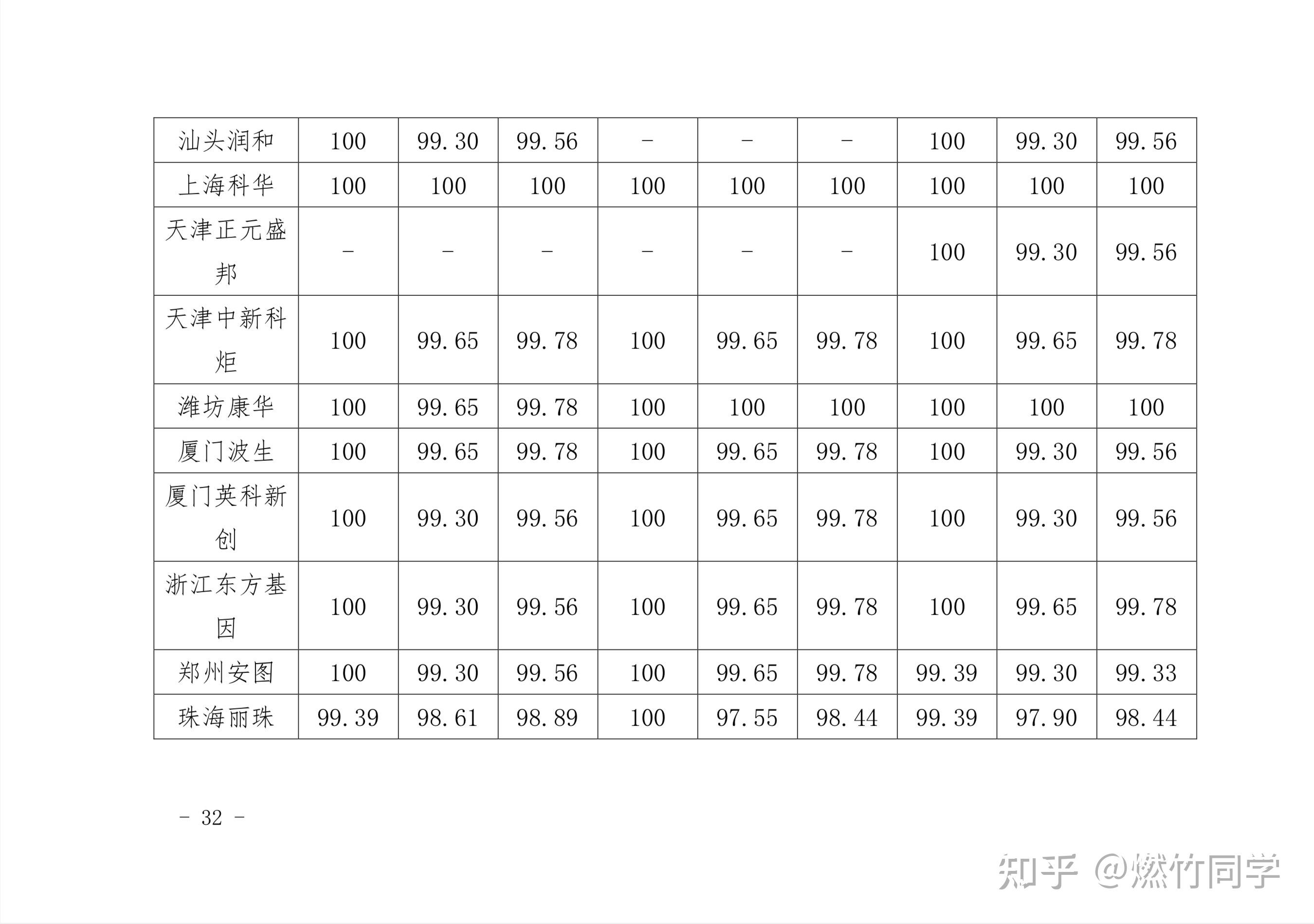
图片来源:中国疾病预防控制中心艾滋病预防控制中心《2019年全国艾滋病病毒抗体诊断试剂 临床质量评估报告》[72]
所以,过了HIV试纸的窗口期后,用正规渠道购买的HIV试纸按照说明书进行操作,其15-20分钟后的测试结果是可信的。
图片来源:美国疾控中心(中文翻译网页)

文件来源:世界卫生组织[73]

文件来源:世界卫生组织[73]

图片来源:《艾滋病自我检测和伴侣告知指南》 2016年世界卫生组织率先将本指南的英文版出版,2018年3月世界卫生组织授予江苏省疾病预防控制中心将英文版翻译成了中文版
如上所示,如果HIV试纸符合质量、安全性和性能标准,普通人用HIV试纸进行操作得到的测试结果,也能够达到与专业人员相同的准确性[74]。
万孚、准信等国内品牌的试纸,因为只检测IgG抗体,而不检测IgM抗体,所以并不属于「双抗原夹心法」,并且因为大家在家自测使用的指尖血,而不是静脉血浆或者静脉血清,因此敏感性并不如真正的实验室第三代检测(化学发光、酶联免疫测抗体)。
使用这类试纸进行筛查,大约25%的人在感染后的26天被筛查到,大约75%的人在感染后37天被筛查到,大部分感染者也是在暴露后25~35天这个范围被万孚、准信、维德、艾博等国内品牌的HIV试纸筛查到,而这类试纸彻底排除则需要56天。
图片来源:自己做的
Q8:雅培抗原抗体联合检测试纸(Alere Determine Combo)可靠吗?它可以比国产的试纸更快的筛查到急性HIV感染吗?它的窗口期是多久?用雅培试纸自测,14天可以彻底排除吗?特异性如何?
可靠。不只是在我们国家,还有许多国家都在使用雅培试纸来进行HIV筛查,比如美国、欧盟和非洲部分国家。此外,雅培试纸也获得了美国FDA的批准,可以用于HIV筛查。
由于能够同时检测p24抗原、IgM抗体和IgG抗体,因此雅培的抗原抗体联合检测试纸的确能比国产试纸更快地检测到急性HIV感染。然而,暴露后14天用雅培抗原抗体联合检测试纸检测阴性并不能100%彻底排除,没有任何文献支持这种100%的说法。
美国CDC官网及它发布的文件明确表示:雅培试纸的缺点是在急性期或者极早期感染阶段,使用指尖全血进行检测时,不如实验室的抗原抗体联合检测灵敏(使用血清或者血浆)。

图片来源:美国CDC
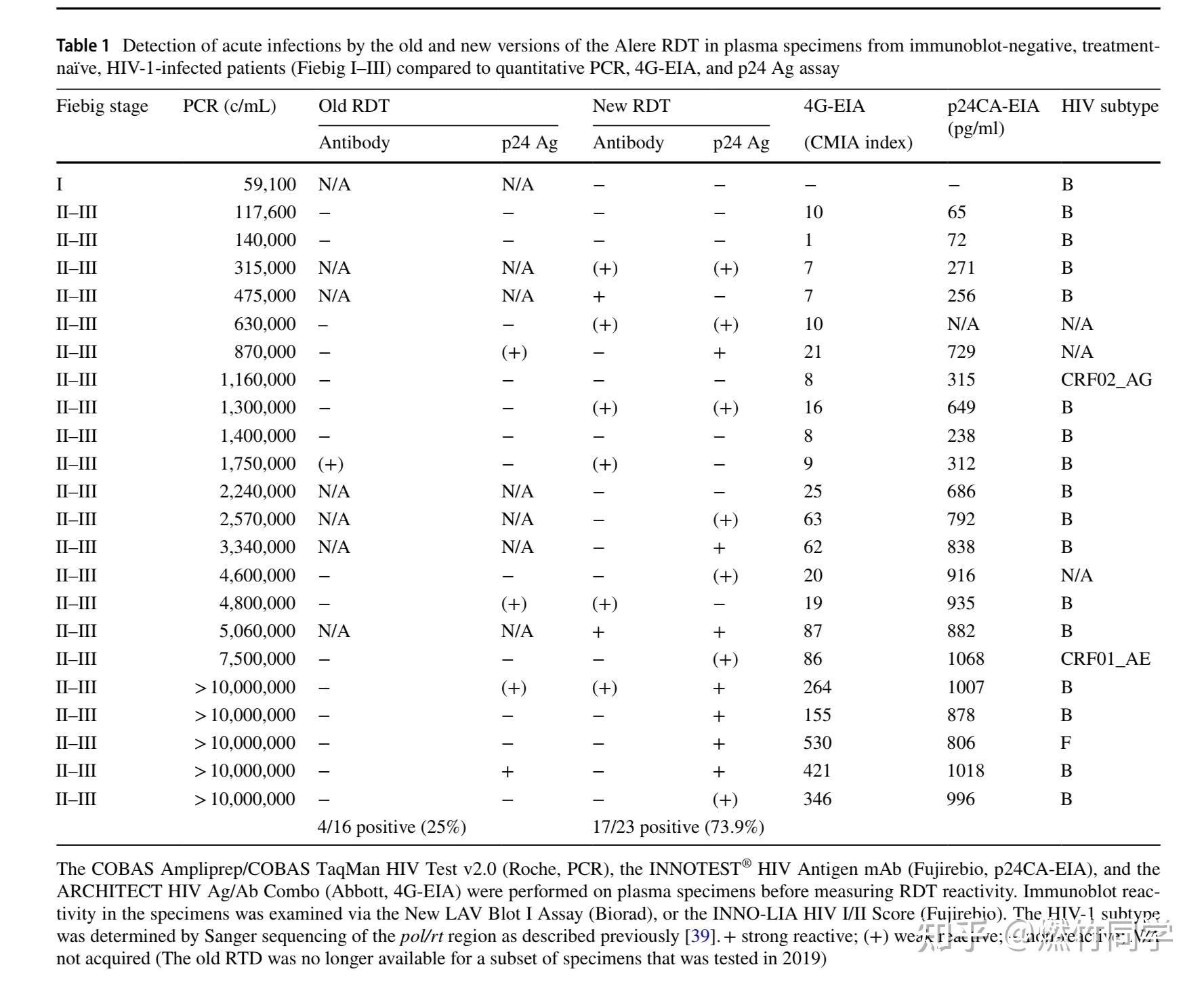
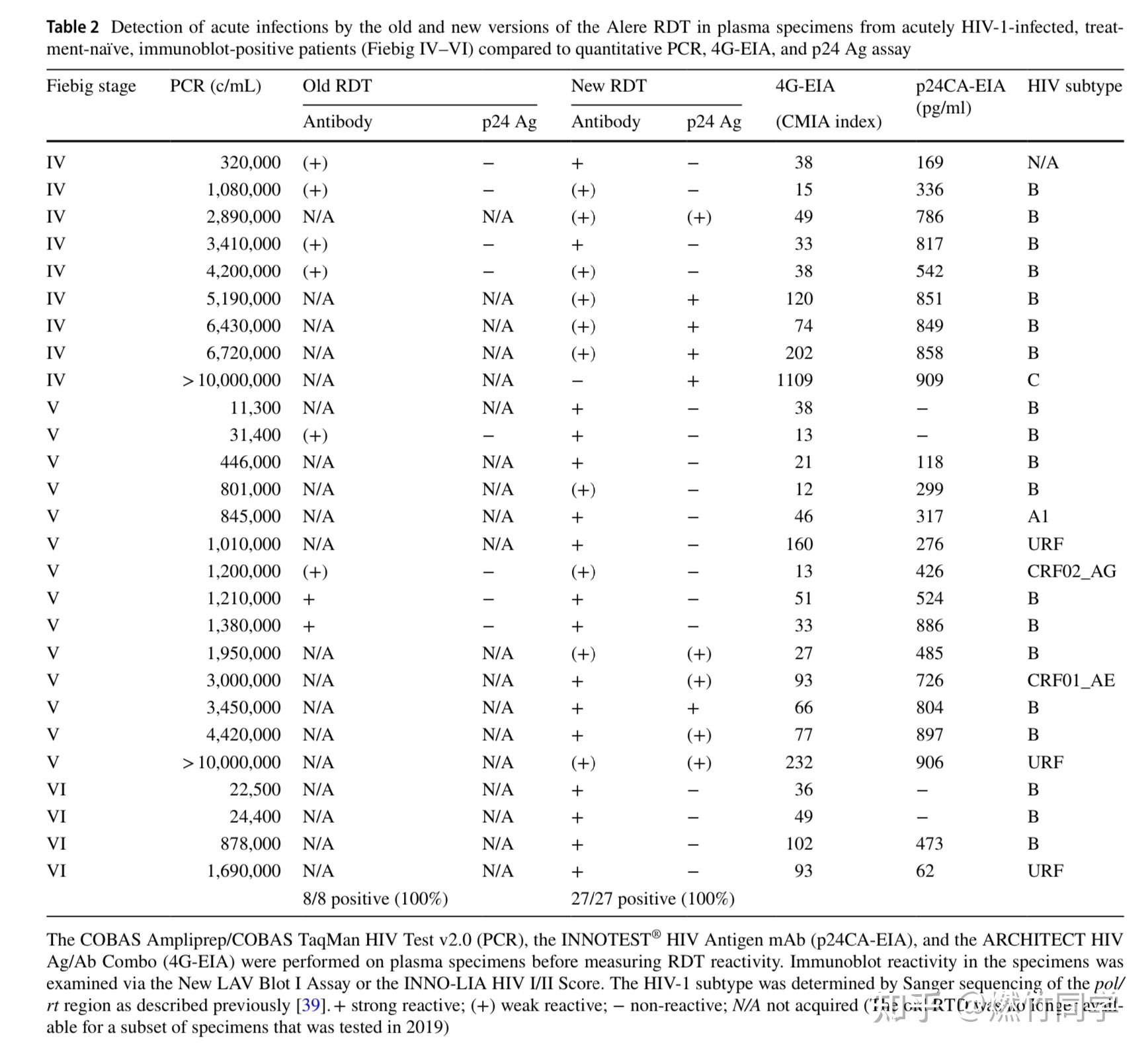
2020年最新发表的论文[5]显示:如果使用的是静脉血浆,那么最新版本的雅培抗原抗体联合检测试纸能够筛查到77%的处于Fiebig II-III期的急性HIV感染者,此时WB确证试验是阴性的。
处于Fiebig II-III期阶段的急性期HIV感染者,此时HIV RNA(+),p24抗原(+),实验室第三代抗体酶联免疫检测(+),但western blot确证试验无任何条带,这个阶段大约是在感染后的10-19天(95%CI 7.1-22.9)[75]。

图片来源:参考文献[74]
换言之,即使是2020年最新版本的雅培试纸,在感染后大约19天,用血清或者血浆(而不是指尖全血)进行检测,也最多只能检测到77%的急性HIV感染者。

图片来源:参考文献[4]
该项研究共纳入了22个Fiebig II-III期的急性HIV感染血浆标本,最新版本的雅培试纸鉴定出了其中的17个(17/22, 77.3%),剩余的5个样本没有被鉴别到。被雅培试纸鉴别出来的17个样本中,有8个呈现强阳性(8/22),有14个样本被检测出p24抗原(14/22),有5个样本同时出现抗原和抗体的T线(5/22),但有3个样本只出现了抗体的T线而没有出现抗原的T线(3/22)。
而较旧版本的雅培试纸,由于抗原区检测能力不佳,因此仅检测到25%的处于Fiebig II- III期的急性HIV感染者。论文作者还发现:对来自急性和慢性HIV-1感染且WB确证试验阳性的患者的所有标本,无论是新版本的雅培试纸,还是旧版本的雅培试纸,均识别出了这些阳性标本。
在处于Fiebig II-III期的急性HIV感染标本中:旧版本的雅培试纸只检测到了B亚型,新版本的雅培试纸检测到了包含B亚型、C亚型、F亚型以及CRF01AE亚型在内的HIV-1 M组亚型,但新版本漏检了国内较为罕见的CRF02_AG亚型的患者(抗体及抗原均无反应)。
新版本的雅培试纸在p24抗原浓度为271 pg/ml、RNA病毒载量为315,000 拷贝/ml时,抗原区开始检测到,但使用的是血浆,而不是指尖全血。指尖全血可能会降低抗原区的检出能力。
新版雅培试纸、旧版雅培试纸,相较于第四代酶联免疫测定和单纯p24抗原测定,检测处于Fiebig II-III期的急性期感染标本的能力对比(图片来源:参考文献[4])
在处于Fiebig IV-VI阶段的急性HIV感染标本中:新旧版本的雅培试纸均检测到了包含A1亚型、B亚型、C亚型、CRF01AE亚型、CRF02_AG亚型和具有独特的重组亚型(URF)在内的亚型。然而这个阶段本应该有抗体产生并被检测到,但新版本的雅培试纸漏检了C亚型样本中的抗体(仅对抗原有反应,且是在该C亚型的标本p24抗原浓度极高的情况下,对应病毒载量>1,000,000拷贝/ml,普通人很难达到这样的病毒载量和p24抗原浓度)。
新版本的雅培试纸还在10份(10/27, 37%)Fiebig IV-VI阶段的样本中检测到了p24抗原,但这10份样本的RNA病毒载量均高于1,900,000 拷贝/ml。
在处于Fiebig IV-VI期的急性HIV感染者,此时HIV RNA(+),p24抗原(+/-),实验室第三代抗体酶联免疫检测(+),western blot确证试验结果不确定或者阳性(有或者没有p31条带)。这个阶段通常是在感染后的19-88天以上(95%Cl 15.3-129.8)[74]。
新版雅培试纸、旧版雅培试纸,相较于第四代酶联免疫测定和单纯p24抗原测定,检测处于Fiebig IV-VI期的急性期感染标本的能力对比(图片来源:参考文献[4])

新版本的雅培试纸在HIV-2检测方面的能力(图片来源:参考文献[4])
HIV-2型检测能力方面:新版本的雅培试纸识别出了所有的HIV-2感染标本(11/11),但均显示抗体,没有检测出HIV-2所具有的p27抗原。因此雅培试纸没有办法检测到急性HIV-2感染。
在HIV-1 原始毒株方面的p24抗原检测能力:进化枝B HIV-1 T/F毒株,是通过那些近期才感染的HIV感染者体内的病毒共同序列建立的,这些毒株比实验室中的经典HIV毒株更接近HIV-1感染最早阶段毒株的基因型特征和表型特征,因为感染一段时间的毒株可能具有和原始毒株不一样的衣壳蛋白稳定性和功能。新版本的雅培试纸虽然识别到了所有T/F毒株样本中的抗原(8/8),然而它识别到的p24抗原浓度仍然比制造商声明的p24抗原最低检出值浓度高10-20倍,这次再次引发了对新版雅培试纸灵敏性的担忧(论文原文就是这么说的)。
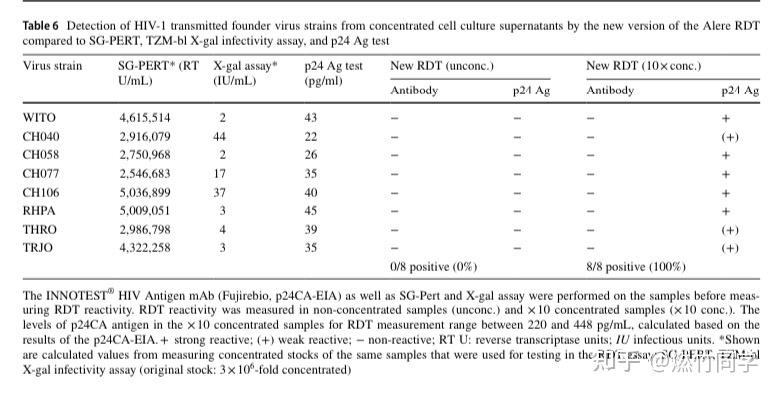
新版本雅培试纸对HIV-1 早期感染的原始毒株的检测能力(图片来源:参考文献[4])
此外,论文作者在摘要的最后一句话明确表示:
The sensitivity of 4G-EIA and p24CA-EIA to detect the major structural HIV antigen, and thus to diagnose acute infections prior to seroconversion, is still superior. 翻译过来就是:
第四代酶联免疫测定和单独的p24抗原酶联免疫测定检测的是HIV的主要结构抗原,因此在血清转化前诊断急性HIV感染的敏感性仍然更高。 该项研究还比较了新旧版本雅培试纸,和标准的实验室第四代酶联免疫检测或者p24抗原酶联免疫检测的p24抗原浓度检测下限:在p24抗原浓度为25 pg/ml时,新旧版本的雅培试纸均未显示出阳性反应,而第四代酶联免疫检测或者p24抗原酶联免疫检测方法的p24抗原灵敏度为≥6.25 pg/ml,远远低于新、旧版本雅培试纸的50~200 pg/ml的p24抗原浓度检测下限。
原文中甚至有这样一段话:
The old version of the RDT did not show reactivity to p24CA in this study group, even though 4/8 samples tested with this assay had estimated p24CA concentrations of ≥ 529 pg/mL. The new RDT detected the HIV-1 capsid antigen in 10/27 (37%) of all specimens, but all antigen-reactive specimens had estimated p24CA concentrations of ≥ 485 pg/mL. Taken together, these results strongly suggest that the sensitivity of the Deter- mineTM HIV-1/2 Combo to detect HIV-1 p24CA antigen is considerably lower, in some cases more than 20-fold, than specified by the manufacturer. 翻译过来就是:
旧版本的雅培试纸在该研究组中未显示出对 p24抗原的反应性,使用该测定测试的 4/8 样本估计 p24抗原浓度≥ 529 pg/mL。新的雅培试纸在所有样本的 10/27 (37%) 中检测到 HIV-1 p24抗原,但有抗原反应的样本估计的p24抗原浓度均≥ 485 pg/mL。
总之,这些结果强烈表明,DetermineTM HIV-1/2 Combo 检测(也就是雅培试纸) HIV-1 p24抗原的灵敏度比制造商声称的灵敏度要低得多,在某些情况下甚至超过 20 倍。 因此,这篇最新评估雅培试纸的论文仍然表明了与美国CDC官网上相同的结论:改良版的雅培试纸虽然敏感性得到较大提升,但标准的实验室第四代检测仍然更加敏感,能更早、更好地识别到急性HIV感染。
目前并没有专门评估使用指尖全血进行检测时,雅培试纸的敏感性及窗口期数据,但依据2017年发表在顶尖传染病学期刊Clinical Infectious Diseases上的一篇评估不同检测方法的窗口期的论文,大约25%的人使用雅培试纸在感染后15天左右被检测到,大约75%的人使用雅培试纸在感染后25天左右被检测到,大约99%的人使用雅培试纸在感染后47天左右被检测到。
这一篇文献研究使用的血清或者血浆,而不是指间全血,评估的是稍早版本的雅培试纸,虽然大家使用的是新版本的雅培试纸,但多数使用的是指尖全血而不是静脉血浆和血清,因此估计使用新版本的雅培试纸进行指尖全血检测时,窗口期范围和旧版本雅培试纸使用血清/血浆的窗口期基本一致。
综上所述:使用指尖全血进行检测时,雅培试纸25天阴性可以大概率排除,彻底排除需要45-50天。
特异性方面,新版本和旧版本的雅培试纸都不会对未感染HIV的血清/血浆样本产生反应性的结果,因此雅培试纸的假阳性概率极低。
稍安勿躁,还没有写完,持续更新中……
图片来源:中国疾控艾防中心公众号
参 考 文 献
[1] Delaney K P, Hanson D L, Masciotra S, et al. Time until emergence of HIV test reactivity following infection with HIV-1: implications for interpreting test results and retesting after exposure[J]. Clinical infectious diseases, 2016: ciw666.
[2] Centers for Disease and Prevention.What kinds of tests are available, and how do they work?[EB/OL].https://www.cdc.gov/hiv/basics/hiv-testing/test-types.html.
[3]Gaines H, Albert J, Axelsson M, et al. Six-week follow-up after HIV-1 exposure: a position statement from the Public Health Agency of Sweden and the Swedish Reference Group for Antiviral Therapy[J]. Infectious Diseases, 2016, 48(2): 93-98.
[4] Lanzafame M, Zorzi A, Rigo F, et al. Performance of Alere Determine HIV-1/2 Ag/Ab Combo rapid test for acute HIV infection: a case report[J]. Infez. Med, 2015, 23(1): 48-50.
[5] Wratil P R, Rabenau H F, Eberle J, et al. Comparative multi-assay evaluation of Determine™ HIV-1/2 Ag/Ab Combo rapid diagnostic tests in acute and chronic HIV infection[J]. Medical Microbiology and Immunology, 2020: 1-12.
[6] Read J S. Diagnosis of HIV-1 infection in children younger than 18 months in the United States[J]. Pediatrics, 2007, 120(6): e1547-e1562.
[7] Havens P L, Mofenson L M. Evaluation and management of the infant exposed to HIV-1 in the United States[J]. Pediatrics, 2009, 123(1): 175-187.
[8] American Academy of Pediatrics Committee on Pediatric AIDS. HIV testing and prophylaxis to prevent mother-to-child transmission in the United States[J]. Pediatrics, 2008, 122(5): 1127-1134.
[9] World Burgard M, Blanche S, Jasseron C, et al. Performance of HIV-1 DNA or HIV-1 RNA tests for early diagnosis of perinatal HIV-1 infection during anti-retroviral prophylaxis[J]. The Journal of pediatrics, 2012, 160(1): 60-66. e1.
[10] Young N L, Shaffer N, Chaowanachan T, et al. Early diagnosis of HIV-1-infected infants in Thailand using RNA and DNA PCR assays sensitive to non-B subtypes[J]. Journal of acquired immune deficiency syndromes (1999), 2000, 24(5): 401-407.
[11] Nesheim S, Palumbo P, Sullivan K, et al. Quantitative RNA testing for diagnosis of HIV-infected infants[J]. JAIDS Journal of Acquired Immune Deficiency Syndromes, 2003, 32(2): 192-195.
[12] Lambert J S, Harris D R, Stiehm E R, et al. Performance characteristics of HIV-1 culture and HIV-1 DNA and RNA amplification assays for early diagnosis of perinatal HIV-1 infection[J]. JAIDS Journal of Acquired Immune Deficiency Syndromes, 2003, 34(5): 512-519.
[13] 徐俊杰,黄晓婕,刘昕超,王黎明,陈耀凯,王辉,张福杰,吴昊,李太生,韩孟杰,赵方,丁海波,段君义,盛根深,尚红.中国HIV暴露前预防用药专家共识[J].中国艾滋病性病,2020,26(11):1265-1271.
[14] Seifert S M, Glidden D V, Meditz A L, et al. Dose response for starting and stopping HIV preexposure prophylaxis for men who have sex with men[J]. Clinical Infectious Diseases, 2015, 60(5): 804-810.
[15] Anderson P, Meditz A, Zheng J H, et al. Cellular pharmacology of tenofovir and emtricitabine in blood, rectal, and cervical cells from HIV–volunteers[C]//19th Conference on Retroviruses and Opportunistic Infections. 2012: 5-8.
[16] Patterson K B, Prince H A, Kraft E, et al. Penetration of tenofovir and emtricitabine in mucosal tissues: implications for prevention of HIV-1 transmission[J]. Science translational medicine, 2011, 3(112): 112re4-112re4.
[17] Centers for Disease Control and Prevention.Prexposure prophylaxis for the prevention of HIV infection in the United States[EB/OL].https://www.cdc.gov/hiv/pdf/risk/prep/cdc-hiv-prep-guidelines-2017.pdf.
[18] World Health Organization.Implementation tool for pre-exposure prophylaxis (PrEP) of HIV infection[EB/OL].http://apps.who.int/iris/bitstream/handle/10665/255889/WHO-HIV-2017.17-eng.pdf?sequence=1,2018-05-09.
[19] Saag M S, Benson C A, Gandhi R T, et al. Antiretroviral drugs for treatment and prevention of HIV infection in adults: 2018 recommendations of the International Antiviral Society–USA Panel[J]. Jama, 2018, 320(4): 379-396.
[20] Brady M, Rodger A, Asboe D, et al. BHIVA/BASHH guidelines on the use of HIV pre-exposure prophylaxis (PrEP) 2018[J]. HIV medicine, 2019, 20(S2): S2-S80.
[21] Chou R, Evans C, Hoverman A, et al. Preexposure prophylaxis for the prevention of HIV infection: evidence report and systematic review for the US Preventive Services Task Force[J]. Jama, 2019, 321(22): 2214-2230.
[22] Grant R M, Lama J R, Anderson P L, et al. Preexposure chemoprophylaxis for HIV prevention in men who have sex with men[J]. New England Journal of Medicine, 2010, 363(27): 2587-2599.
[23] Grant R M, Anderson P L, McMahan V, et al. Uptake of pre-exposure prophylaxis, sexual practices, and HIV incidence in men and transgender women who have sex with men: a cohort study[J]. The Lancet infectious diseases, 2014, 14(9): 820-829.
[24] McCormack S, Dunn D T, Desai M, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised trial[J]. The Lancet, 2016, 387(10013): 53-60.
[25] Molina J M, Capitant C, Spire B, et al. On-demand preexposure prophylaxis in men at high risk for HIV-1 infection[J]. N Engl J Med, 2015, 373: 2237-2246.
[26] Molina J M, Charreau I, Spire B, et al. Efficacy, safety, and effect on sexual behaviour of on-demand pre-exposure prophylaxis for HIV in men who have sex with men: an observational cohort study[J]. The lancet HIV, 2017, 4(9): e402-e410.
[27] Hare C B, Coll J, Ruane P, et al. The phase 3 DISCOVER study: daily F/TAF or F/TDF for HIV preexposure prophylaxis[C]//Conference on retroviruses and opportunistic infections. Seattle, Washington: International Antiviral Society, 2019: 4-7.
[28] Baeten J M, Donnell D, Ndase P, et al. Antiretroviral prophylaxis for HIV prevention in heterosexual men and women[J]. New England Journal of Medicine, 2012, 367(5): 399-410.
[29] Thigpen M C, Kebaabetswe P M, Paxton L A, et al. Antiretroviral preexposure prophylaxis for heterosexual HIV transmission in Botswana[J]. New England Journal of Medicine, 2012, 367(5): 423-434.
[30] Van Damme L, Corneli A, Ahmed K, et al. Preexposure prophylaxis for HIV infection among African women[J]. New England Journal of Medicine, 2012, 367(5): 411-422.
[31] Stephenson J. Study halted: no benefit seen from antiretroviral pill in preventing HIV in women[J]. JAMA, 2011, 305(19): 1952-1952.
[32] Marrazzo J M, Ramjee G, Richardson B A, et al. Tenofovir-based preexposure prophylaxis for HIV infection among African women[J]. New England Journal of Medicine, 2015, 372(6): 509-518.
[33] Van Damme L, Corneli A, Ahmed K, et al. The FEM-PrEP trial of emtricitabine/tenofovir disoproxil fumarate (Truvada) among African women[C]//19th Conference on retroviruses and opportunistic infections. 2012: 5-8.
[34] Dai J Y, Hendrix C W, Richardson B A, et al. Pharmacological measures of treatment adherence and risk of HIV infection in the VOICE study[J]. The Journal of infectious diseases, 2016, 213(3): 335-342.
[35] Patterson K B, Prince H A, Kraft E, et al. Penetration of tenofovir and emtricitabine in mucosal tissues: implications for prevention of HIV-1 transmission[J]. Science translational medicine, 2011, 3(112): 112re4-112re4.
[36] Mayer K H, Krakower D. Antiretroviral medication and HIV prevention: new steps forward and new questions[J]. 2012.
[37] Davis K R, Weller S C. The effectiveness of condoms in reducing heterosexual transmission of HIV[J]. Family planning perspectives, 1999: 272-279.
[38] Weller S C, Davis‐Beaty K. Condom effectiveness in reducing heterosexual HIV transmission[J]. Cochrane database of systematic reviews, 2002 (1).
[39] Van de Perre P, Jacobs D, Sprecher-Goldberger S. The latex condom, an efficient barrier against sexual transmission of AIDS-related viruses[J]. AIDS (London, England), 1987, 1(1): 49.
[40] Patel P, Borkowf C B, Brooks J T, et al. Estimating per-act HIV transmission risk: a systematic review[J]. AIDS (London, England), 2014, 28(10): 1509.
[41] Leynaert B, Downs A M, de Vincenzi I, et al. Heterosexual transmission of human immunodeficiency virus: variability of infectivity throughout the course of infection[J]. American journal of epidemiology, 1998, 148(1): 88-96.
[42] Donoval B A, Landay A L, Moses S, et al. HIV-1 target cells in foreskins of African men with varying histories of sexually transmitted infections[J]. American journal of clinical pathology, 2006, 125(3): 386-391.
[43] Auvert B, Taljaard D, Lagarde E, et al. Randomized, controlled intervention trial of male circumcision for reduction of HIV infection risk: the ANRS 1265 Trial[J]. PLos med, 2005, 2(11): e298.
[44] Bailey R C, Moses S, Parker C B, et al. Male circumcision for HIV prevention in young men in Kisumu, Kenya: a randomised controlled trial[J]. The lancet, 2007, 369(9562): 643-656.
[45] Gray R H, Kigozi G, Serwadda D, et al. Male circumcision for HIV prevention in men in Rakai, Uganda: a randomised trial[J]. The Lancet, 2007, 369(9562): 657-666.
[46] Gray R H, Kigozi G, Kong X, et al. The effectiveness of male circumcision for HIV prevention and effects on risk behaviors in a post-trial follow up study in Rakai, Uganda[J]. AIDS (London, England), 2012, 26(5): 609.
[47] Millett G A, Flores S A, Marks G, et al. Circumcision status and risk of HIV and sexually transmitted infections among men who have sex with men: a meta-analysis[J]. Jama, 2008, 300(14): 1674-1684.
[48] Baggaley R F, Boily M C, White R G, et al. Risk of HIV-1 transmission for parenteral exposure and blood transfusion: a systematic review and meta-analysis[J]. Aids, 2006, 20(6): 805-812.
[49] Smith D K, Grohskopf L A, Black R J, et al. Antiretroviral postexposure prophylaxis after sexual, injection-drug use, or other nonoccupational exposure to HIV in the United States: recommendations from the US Department of Health and Human Services[J]. Morbidity and Mortality Weekly Report: Recommendations and Reports, 2005, 54(2): 1-20.
[50] Kaplan E H, Heimer R. HIV incidence among New Haven needle exchange participants: updated estimates from syringe tracking and testing data[J]. Journal of acquired immune deficiency syndromes and human retrovirology: official publication of the International Retrovirology Association, 1995, 10(2): 175-176.
[51] Cardo D M, Culver D H, Ciesielski C A, et al. A case–control study of HIV seroconversion in health care workers after percutaneous exposure[J]. New England Journal of Medicine, 1997, 337(21): 1485-1490.
[52] Attia S, Egger M, Müller M, et al. Sexual transmission of HIV according to viral load and antiretroviral therapy: systematic review and meta-analysis[J]. Aids, 2009, 23(11): 1397-1404.
[53] Donnell D, Baeten J M, Kiarie J, et al. Heterosexual HIV-1 transmission after initiation of antiretroviral therapy: a prospective cohort analysis[J]. The Lancet, 2010, 375(9731): 2092-2098.
[54] Rodger A J, Cambiano V, Bruun T, et al. Sexual activity without condoms and risk of HIV transmission in serodifferent couples when the HIV-positive partner is using suppressive antiretroviral therapy[J]. Jama, 2016, 316(2): 171-181.
[55] Bavinton B R, Pinto A N, Phanuphak N, et al. Viral suppression and HIV transmission in serodiscordant male couples: an international, prospective, observational, cohort study[J]. The lancet HIV, 2018, 5(8): e438-e447.
[56] Rodger A J, Cambiano V, Bruun T, et al. Risk of HIV transmission through condomless sex in serodifferent gay couples with the HIV-positive partner taking suppressive antiretroviral therapy (PARTNER): final results of a multicentre, prospective, observational study[J]. The Lancet, 2019, 393(10189): 2428-2438.
[57] Lancet Hiv. U= U taking off in 2017[J]. Lancet HIV, 2017, 4(11): e475.
[58] Cohen M S. Successful treatment of HIV eliminates sexual transmission[J]. The Lancet, 2019, 393(10189): 2366-2367.
[59] Wawer M J, Gray R H, Sewankambo N K, et al. Rates of HIV-1 transmission per coital act, by stage of HIV-1 infection, in Rakai, Uganda[J]. The Journal of infectious diseases, 2005, 191(9): 1403-1409.
[60] Powers K A, Ghani A C, Miller W C, et al. The role of acute and early HIV infection in the spread of HIV and implications for transmission prevention strategies in Lilongwe, Malawi: a modelling study[J]. The Lancet, 2011, 378(9787): 256-268.
[61] McQuillan G M, Kruszon-Moran D, Granade T, et al. Seroprevalence of HIV in the US household population aged 18-49 years: the National Health and Nutrition Examination Surveys, 1999-2006[J]. JAIDS Journal of Acquired Immune Deficiency Syndromes, 2010, 53(1): 117-123.
[62] Masciotra S, McDougal J S, Feldman J, et al. Evaluation of an alternative HIV diagnostic algorithm using specimens from seroconversion panels and persons with established HIV infections[J]. Journal of clinical virology, 2011, 52: S17-S22.
[63] Nasrullah M, Wesolowski L G, Meyer III W A, et al. Performance of a fourth-generation HIV screening assay and an alternative HIV diagnostic testing algorithm[J]. AIDS (London, England), 2013, 27(5): 731.
[64] CDC.HIV testing Algorithm Recommendation-Final[EB/OL].http://www.cdc.gov/hiv/pdf/HIVtestingAlgorithmRecommendation-Final.pdf.
[65] United States Centers for Disease Control and Prevention.Updated guidelines for antiretroviral postexposure prophylaxis after sexual, injection drug use, or other nonoccupational exposure to HIV—United States, 2016[EB/OL].http://stacks.cdc.gov/view/cdc/38856.
[66] 中国疾病预防控制中心性病艾滋病预防控制中心.艾滋病病毒暴露后预防技术指南(试用)[EB/OL].http://ncaids.chinacdc.cn/zxzx/zxzx/202011/W020201116802422550750.pdf
[67] Peters P J, Westheimer E, Cohen S, et al. Screening yield of HIV antigen/antibody combination and pooled HIV RNA testing for acute HIV infection in a high-prevalence population[J]. Jama, 2016, 315(7): 682-690.
[68] Jaspard M, Le Moal G, Saberan-Roncato M, et al. Finger-stick whole blood HIV-1/-2 home-use tests are more sensitive than oral fluid-based in-home HIV tests[J]. PLoS one, 2014, 9(6): e101148.
[69] Curlin M E, Gvetadze R, Leelawiwat W, et al. Analysis of false-negative human immunodeficiency virus rapid tests performed on oral fluid in 3 international clinical research studies[J]. Clinical Infectious Diseases, 2017, 64(12): 1663-1669.
[70] Centers for Disease Control and Prevention.Home tests[EB/OL].http://www.cdc.gov/hiv/testing/hometests.html.
[71] World Health Organization. WHO recommends HIV self-testing[EB/OL].https://www.who.int/hiv/pub/vct/who-recommends-hiv-self-testing/en/.
[72] 中国疾病预防控制中心性病艾滋病预防控制中心.2019 年全国艾滋病病毒抗体诊断试剂临床质量评估报告[R].北京:中国疾病预防控制中心性病艾滋病预防控制中心,2019.
[73] World Health Organization. WHO recommends HIV self-testing[R]. World Health Organization, 2016.
[74] 彭红等译.艾滋病自我检测和伴侣告知指南:对艾滋病检测服务综合指南的补充[M].东南大学出版社:南京,2018:21-21.
[75] Fiebig E W, Wright D J, Rawal B D, et al. Dynamics of HIV viremia and antibody seroconversion in plasma donors: implications for diagnosis and staging of primary HIV infection[J]. Aids, 2003, 17(13): 1871-1879.
最后,打个广告啦,更多有关常见病的医学科普内容,欢迎关注我个人的纯科普微信公众号:「燃竹同学」,无广告,无推销。
这些都是我一个字一个字打出来的,觉得不错可以赞赏、点赞、分享、收藏、转发,谢谢!!! |
|
 /3
/3 