金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
上期和小伙伴们聊了PCR实验中RNA的提取及cDNA的合成,这期内容针对第三部分的cDNA扩增及常见结果数据的问题进行与大家讨论。
一般cDNA扩增步骤:
预变性
模板DNA完全变性与PCR酶的完全激活对PCR能否成功至关重要,建议加热时间参考试剂说明书,一般未修饰的Taq酶激活时间为两分钟。
变性
循环中一般95℃,30s足以使各种靶DNA序列完全变性,可能的情况下可缩短该步骤时间。变性时间过长损害酶活性,过短靶序列变性不彻底,易造成扩增失败。
引物退火
退火温度需要从多方面去决定,一般根据引物的Tm值为参考,根据扩增的长度适当下调作为退火温度。然后在此次实验基础上做出预估。退火温度对PCR的特异性有较大影响。
引物延伸
引物延伸一般在72℃进行(Taq酶最适温度)。但在扩增长度较短且退火温度较高时,本步骤可省略延伸时间随扩增片段长短而定,一般推荐在1000bp以上,含Pfu及其衍生物的衍生设定为1min/kbp。
循环数
大多数PCR含25-35循环,过多易产生非特异扩增。
最后延伸
在最后一个循环后,反应在72℃维持10-30分钟.使引物延伸完全,并使单链产物退火成双链。(DNA扩增步骤常依据试剂盒说明书进行)
引物设计常见方法及步骤:
引物设计在DNA扩增中起着决定性作用,引物设计的好坏常常直接决定最后的扩增结果。
目标基因的引物设计我们通过文献或自己设计而得,正确的途径和方法去寻找合适的引物,往往扩增结果都是比较理想的,在此和同学们介绍引物的设计的一般流程:
引物设计前我们一般首先去寻找pubmed数据文献数据库里存在我们目标基因PCR引物的文献,发表过的文章中的引物,相对可靠性更高。若不放心引物的准确性,我们可以把引物复制到NCBI-BLAST网站页面,进行引物搜索考察确认;我们还可以通过primerbank或商业公司在线网页进行自行设计。(此部分内容将在下期视频演示中详细讲解)。
Primerbank与Blast页面
引物设计原则:
1) 引物长度一般在15-30bp。常用的为18-27bp,因为过长会导致其延伸温度大于74℃,不适于Taq DNA聚合酶进行反应。
2) 引物GC含量一般为40%-60%, 45-55%为宜,GC含量过高或过低都不利于引发反应,上下游引物GC含量和Tm值要保持接近,一般Tm值不超过5℃。
3) 引物所对应的模板序列的Tm值在55-80℃之间,最好为72℃左右。
4) 引物的延伸是从3′端开始的,不能进行任何修饰,且 3’端的碱基一般不用A;引物3’端出现3个以上的连续碱基,如GGG或CCC,或者引物3’端的互补、二聚体或发夹结构也可能导致PCR反应失败。
5) 碱基要随机分布,且引物自身和引物之间不能有连续4个碱基的互补。
6) 尽量在基因的编码区(CDS序列)上设计引物,限制基因组DNA扩增。
7) 使用BLAST检索,确认引物特异性。
引物设计完成以后,应对其进行BLAST检测。如果与其它基因不具有互补性,就可以进行下一步的实验了
8) 引物5'端和中间△G值应该相对较高,而3'端△G值较低。△G值是指DNA双链形成所需的自由能,它反映了双链结构内部碱基对的相对稳定性,△G值越大,则双链越稳定。应当选用5' 端和中间△G值相对较高,而3'端△G值较低(绝对值不超过9)的引物。引物3'端的△G值过高,容易在错配位点形成双链结构并引发DNA聚合反应(不同位置的△G值可以用Oligo 6软件进行分析)。
9) 引物的5'端可以修饰,而3'端不可修饰。
引物的5'端决定着PCR产物的长度,它对扩增特异性影响不大。因此,可以被修饰而不影响扩增的特异性。引物5'端修饰包括:加酶切位点;标记生物素、荧光、地高辛、Eu3+等;引入蛋白质结合DNA序列;引入点突变、插入突变、缺失突变序列;引入启动子序列等。引物的延伸是从3'端开始的,不能进行任何修饰。3'端也不能有形成任何二级结构可能。
10) 扩增产物的单链不能形成二级结构。
某些引物无效的主要原因是扩增产物单链二级结构的影响,选择扩增片段时最好避开二级结构区域。用有关软件(比如RNAstructure)可以预测估计mRNA的稳定二级结构,有助于选择模板。实验表明,待扩区域自由能(△G°)小于58.6lkJ/mol时,扩增往往不能成功。若不能避开这一区域时,用7-deaza-2'-脱氧GTP取代dGTP对扩增的成功是有帮助的。
PCR结果解析与常见问题解决
1.什么是扩增曲线和熔解曲线?
对于荧光定量PCR结果的判断,最直观就是看是否符合正常标准。如果是做染料法qPCR,还需要检查熔解曲线是否符合标准。
良好的扩增曲线和熔解曲线的标准主要有:
1)扩增曲线有明显的4个时期,基线期平滑无上扬,拐点清楚,指数期明显,曲线整体平滑。
2)复孔间扩增曲线的指数增长期重复性较好(复孔Ct数值相差<0.5)。
3)熔解曲线单峰。
2. 扩增曲线(图1)是随着PCR反应的进行,扩增产物不断积累,荧光信号强度不断增加,仪器每经过一次循环,收集一次荧光信号,通过荧光强度的变化监测扩增产物量的变化,得到的扩增曲线图。
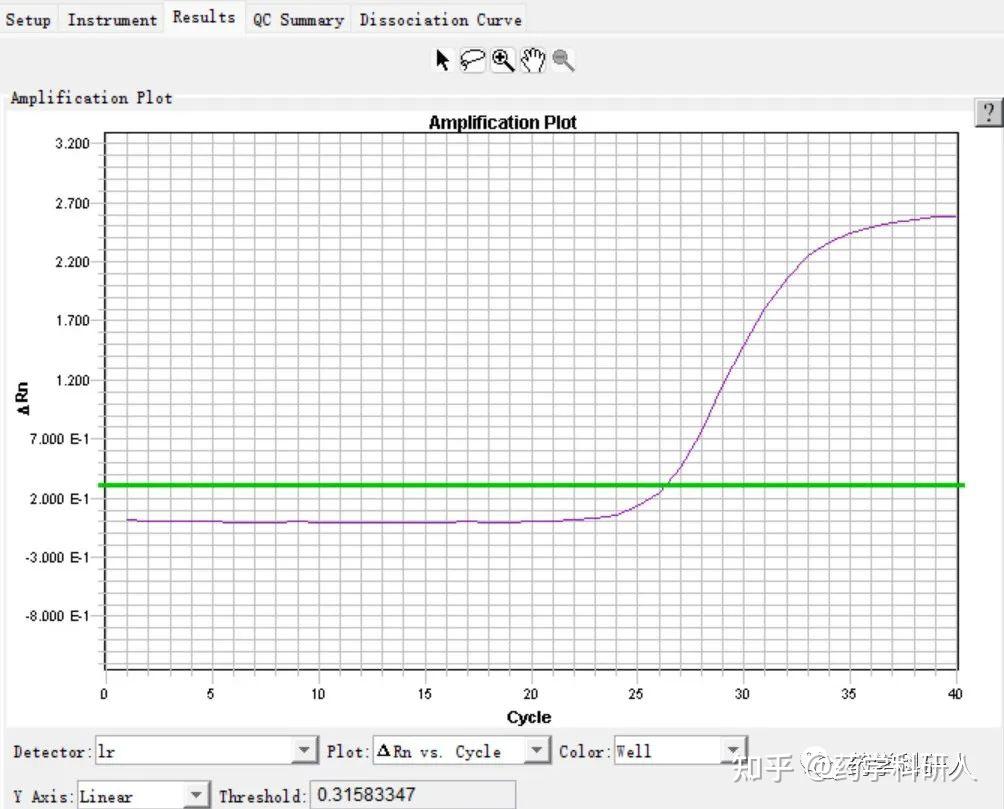
图1.正常扩增曲线
3. 扩增曲线平台期不平滑呈现锯齿状(图2)
原因分析:RNA模板纯度低,杂质所造成的干扰;仪器需要校准;
解决方案:增加稀释倍数优化反应,或者重新制备高纯度的RNA模板;建议定期校准仪器;
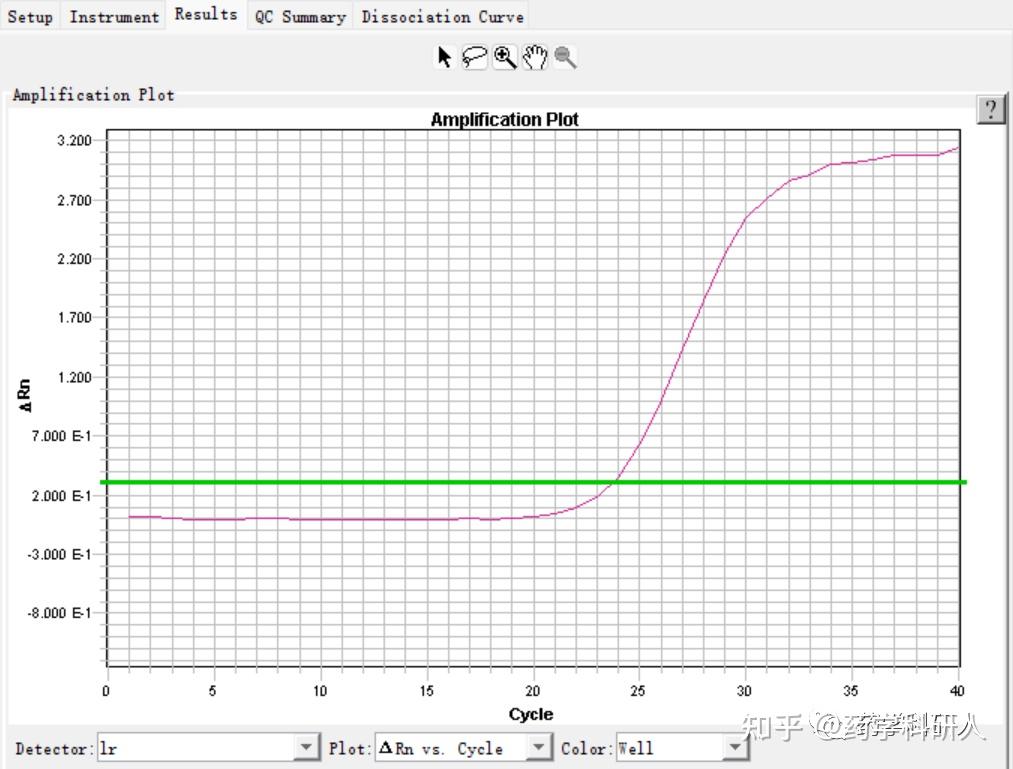
图2. 扩增曲线平台期不平滑呈现锯齿状
4. 反应后无扩增曲线(无Ct值)出现:
每个反应管内的荧光信号到达设定的域值时所经历的循环数被称为Ct值。
1) 确认程序中是否设置了信号采集步骤:两部法扩增程序一般将信号采集设置在退火延伸阶段;三步法扩增程序应当将信号采集设置在72℃延伸阶段。
2) 扩增效率问题:电泳检测realtimePCR反应产物,观察是否有正确大小的目的条带出现。如果没有,则逐一排查引物、模板以及反应条件问题。
3) 循环数不够:一般可设置循环数为40 (不超过40个循环)。
4) 引物或探针降解:可通过PAGE电泳检测引物和探针是否降解。
5) 模板量可能降解或上样量不足:对未知浓度的样本应从系列稀释样本的最高浓度做起;如果发生模板降解,建议将RNA模板样本小量分装储备,避免反复冻融模板被降解。
5. Ct值出现过晚
在相对定量中, Ct值一般控制在15-25之间比较好,如果在绝对定量中,对低拷贝数的样品,Ct值会增大, 但是一般不宜超过40循环, 否则定量不准确。因此,判断Ct值出现过晚是否属于非正常情况, 需要根据具体实验设计和目的进行。
1) 扩增效率低。该情况适用于针对所有的基因,特别是内参基因仍无法获得较好的扩增信号时,可以考虑:引物之间或者引物和探针的比例不合适,需要进行优化;引物或探针设计不合理, 需要重新设计。
2) PCR程序不合适, 改用三步法进行反应, 或者优化退火/延伸温度, 可以适当降低退火温度; 退火/延伸时间短(可以在推荐的时间条件下延长10s)。
3) MgCl₂浓度不合适,增加镁离子浓度等。PCR各种反应成分的降解或加样量的不足。
4) PCR产物太长。PCR产物设计超过500bp。
5) 模板中存在抑制物。用高纯度模板进行PCR检测或将模板进行稀释。
6.熔解曲线是指反应随温度升高,双链扩增产物逐渐解链,荧光信号逐渐减弱的曲线。
在染料法定量扩增实验中,熔解曲线发挥着关键作用,它可以帮助我们判断反应是否有非特异扩增。那么熔解曲线的基本原理是什么呢?
首先我们需要了解染料法荧光标记的作用原理。SYBR Green I是应用最广泛的染料法荧光标记,可以广泛地结合到DNA双链的小沟中,从而发出比游离状态下强10³倍的荧光。因此,在PCR的延伸期,随着双链产物的不断增加,嵌入到双链中的荧光分子也不断增多,荧光信号的变化可以反映产物量的变化。
那么熔解曲线是如何产生的呢?在扩增结束后,荧光信号强度达到一个最高值,之后我们设置一段由65℃逐渐升温到95℃的程序,随着温度逐渐升高,DNA双链逐渐解链为单链,从以上的原理我们知道,嵌入到双链中的荧光染料分子也会逐渐脱落下来,所以荧光信号强度逐渐下降。在某段温度时,双链迅速而大量地解链,荧光信号强度骤然下降,这段温度中,一半的双链解链的温度我们称为熔解温度(即Tm值)。最终,DNA双链完全解链为单链,荧光值下降为一个本底水平,这一过程中的荧光信号随温度变化的曲线就是熔解曲线,称为原始图谱。该图谱做负导数换算后得到熔解曲线的导数图谱,导数图谱会出现熔解峰,熔解峰对应的温度就是Tm值 (图3)。
不同的产物按照其GC含量,片段大小,盐离子浓度的不同,其对应的Tm值也是不同的。熔解曲线为一个单一的尖锐峰,说明无非特异性荧光产生,此时定量准确。熔解曲线出现杂峰,说明产生了非特异产物,荧光值不能反映目的产物量的值,此时定量不准确。
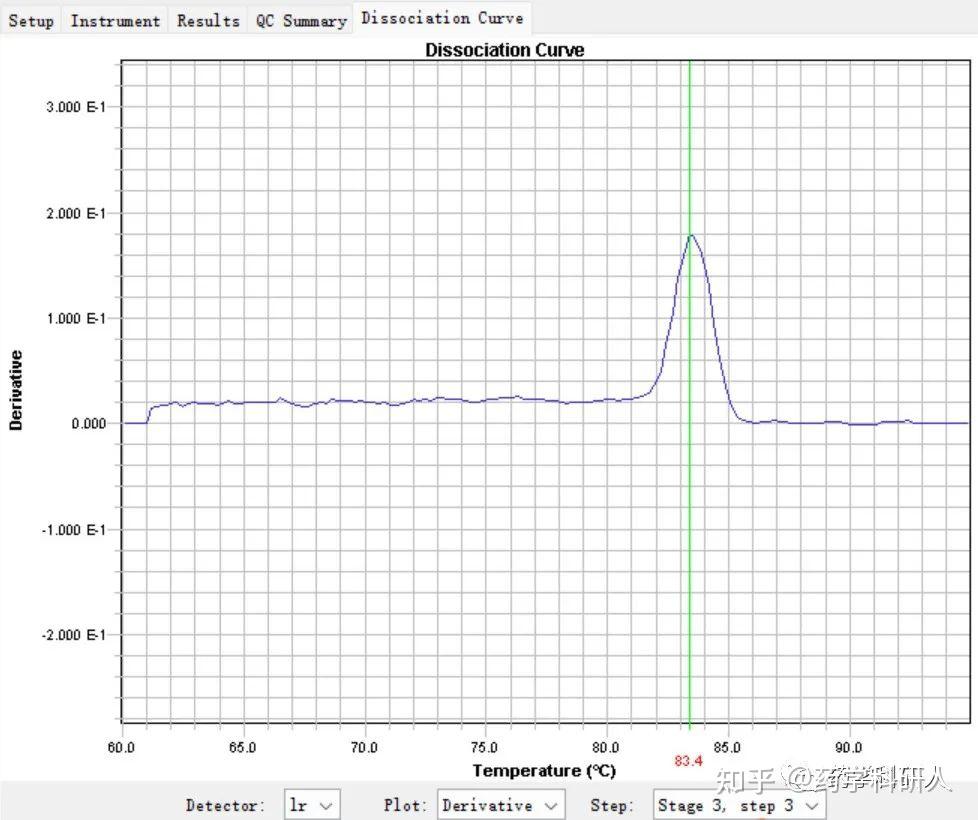
图3. 正常熔解曲线
7. 熔解曲线出现非特异性荧光
可能的原因及排除方法有:
1) 引物设计不合理,存在引物二聚体(图4A主峰前面出现一个小峰)或非特异扩增现象(图4B主峰后面出现一个小峰)。
解决方案:提高模板的加入量;降低引物的加入量;稍微提升退火温度;重新设计合适的定量引物得到特异扩增产物(这招好使!重新设计引物就和电脑重启差不多的功效)。
2) 体系存在杂质或者污染
解决方案:提取RNA之后进行RNA纯度和完整性鉴定,避免使用不纯的模板;操作过程在超净台中进行,避免引入环境污染;注意试剂的取用和保存,避免交叉污染。
3) 试剂抗逆性较差
解决方案:选用高效的荧光定量试剂消除非特异性扩增;优化反应条件和反应体系。
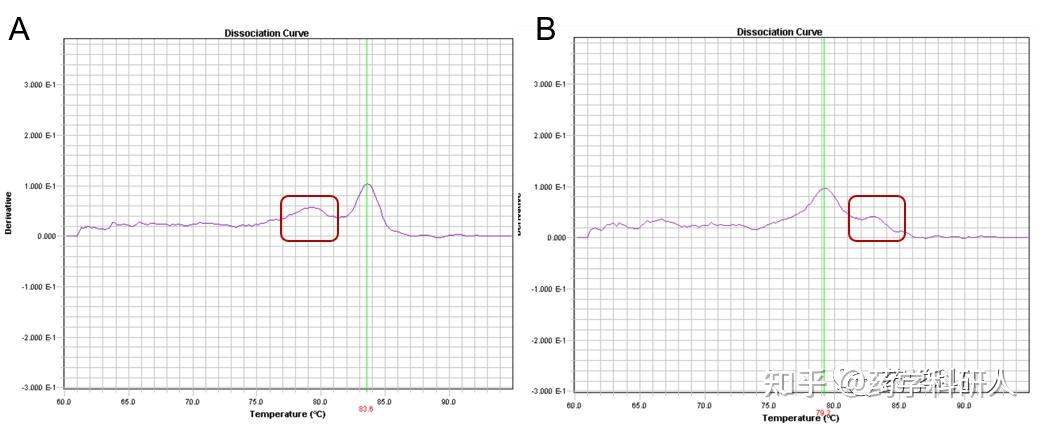
图4. 熔解曲线出现引物二聚体(A)和非特异性扩增(B)
8. 熔解曲线单峰但不尖锐(图5):存在大小相近的非特异性产物
解决方案:使用高分辨率的电泳进行确认后,或重新设计引物。
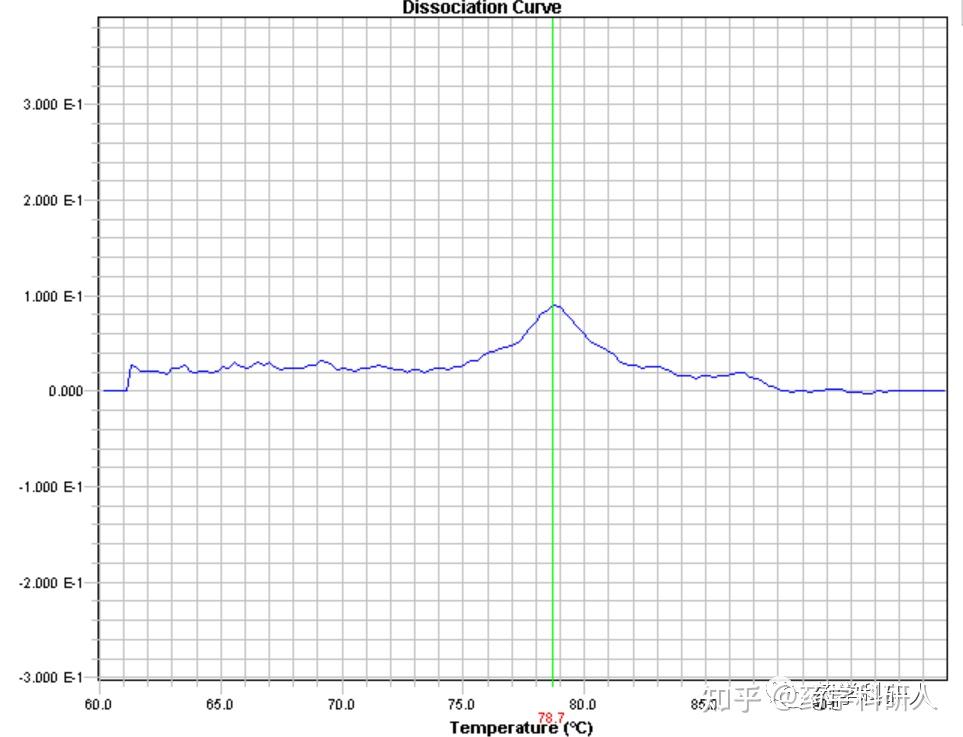
图5. 熔解曲线单峰不尖锐
9. 关于引物二聚体(图6):
什么是引物二聚体?怎样消除引物二聚体?
引物二聚体其实就是一对引物或者引物自身的3&#39;端部分碱基互补结合,在Taq酶的作用下从 3&#39;末端延伸所形成的小分子量的双链DNA片段。引物二聚体的出现是必然的,只是或多或少的问题,电泳时看不到引物二聚体带也不代表没有二聚体出现,只是含量低我们的肉眼看不到而已。提高PCR严谨性(包括提高退火温度,降低引物浓度等)可大大降低二聚体的浓度。
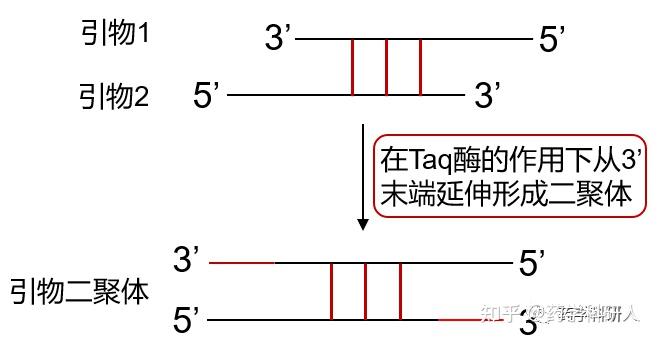
图6.引物二聚体的形成
减少PCR产物中引物二聚体的解决方案:
1) 从引物自身考虑,重新设计引物,这是解决这一问题的最根本办法;
2) 模板浓度过小,适当加大模板量;
3) Taq酶,引物,Mg2+浓度可能过高,可降低它们的浓度;
4) 取所要加的上下游引物混合后,在100℃下的沸水中煮5min,然后迅速拿出置于冰上瞬时冷却,这时再加入反应体系当中,引物二聚体就会消失的 (引物可能会发生发夹结构,自身环化等结构,在100℃下的沸水中煮5min可使引物变为单链,以减少二聚体);
5) 所配MIX中加5%的甘油或者5%的DMSO,可以增强特异性;
6) PCR反应体系的配制在冰上进行,最后加TAq酶,PCR结束后,产物勿放置在室温下过长时间,有人认为室温下有些TAQ酶会将多余的引物合成为二聚体;
7) 增加循环数;
8) 降低退火温度后有条带,则应逐渐提高温度,若提高温度的同时产物量减少,则考虑增加镁离子浓度(根据扩增片断长度而定,片段长则相应镁离子浓度应该高一些);
9) 若降低退火温度,发现还是只有引物二聚体,而且镁离子的浓度在20-25mmol/L没有区别,则考虑Buffer等试剂没有完全融解、混匀,导致吸取的试剂浓度不对;
10) 以上次的PCR产物作模板二次PCR,可以提高引物与模板的特异性,减少引物二聚体,如果两次时间间隔短的话,可以把原产物稀释100-1000倍,如果间隔较长可以稀释50-100倍。
10. 阴性
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
解决方案:①选定一个好的引物合成单位。②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败。如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
11. 靶序列或扩增产物的交叉污染:
产生这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生。
解决方案:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。所用离心管及样进枪头等均应一次性使用。必要时,在加标本前,反应管和试剂用紫外线照射,以破坏存在的核酸;可用巢式PCR方法来减轻或消除此种污染。
资料参考:知乎; 丁香通; 丁香园 |
|
 /3
/3 