金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
摘 要
循环肿瘤细胞(Circulating tumor cell,CTC)检测作为一种创新的液体活检技术,与ctDNA(Circulating tumor DNA,ctDNA)及外泌体,合称为液体活检的三驾马车,在胃肠肿瘤精准诊疗领域展现出了巨大潜力。通过对CTC的捕获与鉴定,该技术能够提供有关肿瘤动态、治疗响应及预后情况的关键信息,从而助力医生制定个性化的治疗方案。本研究系统阐述了CTC检测的基本原理、技术进展及其在胃肠肿瘤诊疗中的应用价值。在检测方法方面,目前常用的免疫法和物理法捕获各具优势,而新兴技术如基于免疫磁珠的分离技术、微流控芯片技术及深度学习的图像识别技术等,正不断提升检测的敏感性和特异性。在临床应用上,CTC检测不仅可用于胃肠肿瘤的早期诊断,还能有效监测治疗效果并评估预后,为患者提供更加精准、及时的治疗建议。研究指出,尽管CTC检测仍面临技术挑战,如稀有性、异质性和现有技术的局限性,但通过不断的技术创新和优化,这些问题有望得到解决。未来,随着技术的进一步发展和临床数据的积累,CTC检测有望在胃肠肿瘤精准诊疗中发挥更大的作用,为患者带来更为个性化的诊疗体验和更好的生存质量。
第一章 引言
循环肿瘤细胞检测作为一种新兴的液体活检技术,在近年来受到了广泛的关注。其在胃肠肿瘤精准诊疗中的重要性日益凸显,为临床提供了更多有关肿瘤状态的信息,有助于指导治疗策略和预后评估。
循环肿瘤细胞是从原发或转移性肿瘤灶脱落进入血液循环的肿瘤细胞,这些细胞携带着丰富的肿瘤相关信息,如基因突变、表达谱变化等。通过对这些细胞的检测和分析,可以实时监测肿瘤的动态变化,了解肿瘤的异质性,并评估不同治疗方案的效果[1]。在胃肠肿瘤中,CTC检测的应用具有特别的意义。由于胃肠肿瘤的早期症状不明显,且传统诊断方法如内镜检查和影像学检查等具有一定的局限性。影像学需要待肿瘤长到一定大小才能发现,具有滞后性,而血清标志物是由在恶性肿瘤的发生和增殖过程中的肿瘤细胞本身所产生的或是由机体对肿瘤细胞反应而异常产生和(或)升高的,反映肿瘤存在和生长的一类物质,包括蛋白质、激素、酶、多胺及癌基因产物等,仅携带肿瘤部分信息,本身的特异性有限,因此,寻找一种无创、敏感且特异的检测方法显得尤为重要。CTC检测正好满足了这一需求,它能够通过简单的血液检测,捕捉到肿瘤细胞的微小变化,为胃肠肿瘤的精准诊疗提供有力支持[1]。
关于循环肿瘤细胞检测在胃肠肿瘤诊疗中的研究已经取得了一定的进展。多项研究表明,CTC的数量和特性与胃肠肿瘤的分期、预后以及对治疗的反应密切相关。通过对CTC的深入分析,有望为胃肠肿瘤患者提供更加个性化的治疗方案,提高治疗效果和生活质量[1][2][3][4]。CTC检测技术在实际应用中仍面临一些挑战,如检测的灵敏度、特异性和可重复性等问题,需要进一步的研究和改进。未来,随着技术的不断进步和研究的深入,循环肿瘤细胞检测有望在胃肠肿瘤的精准诊疗中发挥更大的作用。
第二章 循环肿瘤细胞检测的基本原理
2.1 检测方法概述
循环肿瘤细胞检测是近年来肿瘤学领域的研究热点,其在胃肠肿瘤的精准诊疗中扮演着重要角色。CTC在血液中有多种存在形式,包括不同的分子分型[上皮型CTC(Epithelial CTC,E-CTC)、间质型CTC(Mesenchymal CTC,M-CTC)和混合型CTC] 和细胞分型[ 单个CTC、循环肿瘤微栓(Circulating tumor microemboli,CTM)和中性粒细胞CTM(CTC-neutrophil clusters)]。CTC的稀有性和高度异质性是CTC分离富集需要克服的技术难题[5]。CTC与血液中其他细胞在物理特性、免疫学特性和基因表达等方面有显著差异。这些构成CTC分离富集的理论基础[6]。由中华医学会肿瘤学分会胃癌学组、中国医师协会结直肠肿瘤专业委员会、中国抗癌协会大肠癌专业委员会、中国抗癌协会胃癌专业委员会和中国抗癌协会消化道息肉及癌前病变专业委员会,5家权威学术机构(中华医学会、中国医师协会及中国抗癌协会)共同发布的《循环肿瘤细胞检测在胃肠道肿瘤诊疗中的应用中国专家共识(2023版)》中,便清晰地展示了胃肠肿瘤CTC的不同细胞类型[7]。
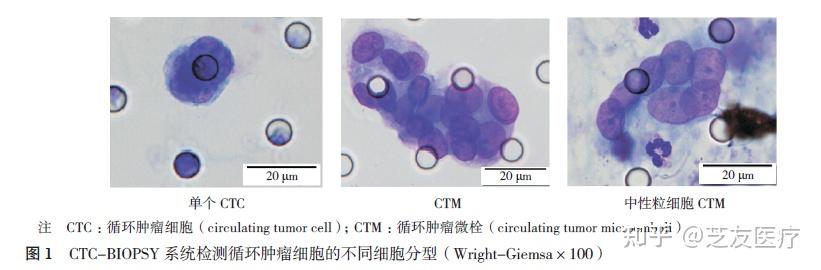
目前,CTC检测的方法多种多样,其中最关键在于从血液中进行CTC的捕获,鉴定则可以通过多种细胞学及分子生物学方法来实现。目前免疫法和物理法捕获循环肿瘤细胞是两种常用的技术手段。
免疫法,是运用免疫学及细胞化学的原理和方法,对细胞内的特定抗原进行定位和定性研究的技术。在CTC检测中,该方法通过特异性抗体标记肿瘤细胞表面的抗原,从而实现对循环肿瘤细胞的识别和计数。由于大部分CTC表达CK和EpCAM等上皮细胞标记,因此可通过这些特异标志物进行免疫识别,在此核心原理的基础上结合纳米、微流和磁珠等技术,实现CTC的阳性或阴性分离。CellSearch 系统和CTC-Chip 分别利用磁珠法和微流控芯片进行阳性分离,表面标记均为EpCAM,两种方法捕获的CTC纯度较高,但是会遗漏部分上皮间质转化或EpCAM缺失表达的亚型。阴性分离通常是直接靶向白细胞表面的特异性抗原(如CD45),优先去除血液中的白细胞从而实现CTC的富集,这类方法操作步骤较多,富集的CTC纯度偏低[8]。
物理学捕获方法利用CTC和正常血液细胞在大小、形态和流体力学等物理学方面的差异进行CTC分离,根据肿瘤细胞特有的核型特征进行CTC鉴定。其优势是能保证CTC形态完好,可以兼容下游各种细胞分析和鉴定技术。其中ISET系统和CTC-BIOPSY 系统是纳米微孔膜滤过装置,根据细胞大小的差异通过8um过滤孔来分离CTC,然后通过细胞病理学染色进行鉴定[9][10]。

ClearCell®FX 系统和Parsortix系统采用微流控技术,结合细胞大小及其形变能力对CTC 进行分离和富集。OncoQuick系统利用CTC与白细胞的密度差异进行分离,密度梯度离心后白细胞经过多孔滤膜去除,CTC被富集于介质层中可洗脱获得。
除了上述两种常用方法外,还有一些新兴的技术手段也被应用于CTC检测中,如流式细胞术、微流控芯片技术等。这些技术各具特点,在胃肠肿瘤的精准诊疗中发挥着重要作用。流式细胞术能够实现对大量细胞的快速分析和分选,具有较高的通量和自动化程度;而微流控芯片技术则能够实现对微量样本的高通量检测和分析,具有灵敏度高、操作简便等优点。
循环肿瘤细胞检测的方法多种多样,每种方法都有其独特的优势和局限性。在胃肠肿瘤的精准诊疗中,应根据患者的具体情况和实际需求选择合适的检测方法进行综合应用,以提高诊疗的准确性和有效性。同时,随着科学技术的不断进步和发展,未来还将有更多新兴的CTC检测方法涌现出来,为胃肠肿瘤的诊疗带来更大的突破和希望。
2.2 技术进展与应用
循环肿瘤细胞检测技术的不断进步为胃肠肿瘤的精准诊疗提供了新的视角。这些技术不仅提高了CTC检测的敏感性和特异性,还推动了其在临床实践中的广泛应用。
在检测技术方面,近年来出现了多种新兴方法,如基于免疫磁珠的分离技术、微流控芯片技术、以及结合深度学习的图像识别技术等[11][12]。这些方法在富集效率、检测速度、以及准确性方面均有所突破,为胃肠肿瘤的早期诊断、病情监测和预后评估提供了更为可靠的工具。
具体应用上,CTC检测在胃肠肿瘤的临床诊疗中展现出了重要价值。对于结直肠癌患者,CTC检测有助于发现早期复发和转移的迹象,从而指导及时调整治疗方案[13]。研究表明,CTC的数量与结直肠癌患者的预后密切相关,高水平的CTC往往预示着更高的复发风险和更差的生存结局[14]。因此,通过定期监测患者血液中的CTC数量,医生可以更为精准地评估病情进展,制定个性化的治疗方案。CTC检测在胃癌的诊疗中也发挥着重要作用。胃癌术后的复发和转移是导致患者生存率下降的主要原因之一,而CTC在这一过程中扮演着关键角色[15]。通过检测患者血液中的CTC,医生可以更早地发现肿瘤复发的迹象,及时采取干预措施以延长患者的生存期。同时,CTC检测还有助于评估胃癌患者对治疗的反应,指导个体化治疗策略的制定[11][15]。
随着技术的不断进步和应用领域的拓展,CTC检测在胃肠肿瘤的精准诊疗中展现出了广阔的应用前景。未来,随着更多研究的深入和临床数据的积累,有理由相信CTC检测将成为胃肠肿瘤诊疗过程中不可或缺的一部分。
虽然CTC检测在胃肠肿瘤诊疗中的应用取得了显著进展,但仍存在一些挑战和问题需要解决。例如,如何进一步提高CTC检测的敏感性和特异性、如何标准化检测流程和解读结果、以及如何将CTC检测与其他生物标志物和影像学检查相结合以提供更全面的诊疗信息等。这些问题的解决将有助于推动CTC检测在胃肠肿瘤精准诊疗中的更广泛应用和更深入发展。
第三章 循环肿瘤细胞检测在胃肠肿瘤诊疗中的应用价值
3.1 早期诊断的辅助手段
循环肿瘤细胞检测作为一种非侵入性的液体活检技术,近年来在胃肠肿瘤的早期诊断中展现出了广阔的应用前景。这种技术能够通过捕捉和分析外周血中的肿瘤细胞,为临床医生提供有关肿瘤状态、治疗响应和疾病进展的重要信息。在胃肠肿瘤的早期阶段,由于肿瘤细胞的微小转移和隐匿性,传统的诊断方法往往难以发现,而CTC检测则以其高敏感性和特异性成为了早期诊断的有力辅助手段。
在敏感性方面,CTC检测能够识别和计数外周血中极其稀少的肿瘤细胞。这得益于检测技术的不断进步,包括免疫磁珠分离、流式细胞术以及高分辨率显微镜等技术的联合应用,使得对单个肿瘤细胞的捕获和鉴定成为可能。通过这些技术,即使在肿瘤负荷较低的情况下,也能有效地检测出CTC,从而提高了胃肠肿瘤早期诊断的准确率。
特异性方面,CTC检测依赖于肿瘤细胞表面特异的标志物进行识别。这些标志物可能是肿瘤相关抗原、基因突变或染色体异常等,它们在肿瘤细胞中的表达模式与正常细胞存在显著差异。通过针对这些标志物的特异性抗体或探针,CTC检测能够准确地从复杂的血液背景中区分出肿瘤细胞。这种高度的特异性不仅有助于减少假阳性结果的出现,还能为后续的个体化治疗提供精确的靶点信息。
除了敏感性和特异性之外,CTC检测在胃肠肿瘤早期诊断中还具有其他优势。例如,该检测方法无需进行创伤性的组织活检,减少了患者的痛苦和并发症风险。同时,由于血液样本的易获取性,CTC检测可以实现动态监测和连续评估,有助于及时发现疾病的复发和转移。此外,随着技术的不断发展,CTC检测还有望实现自动化和高通量处理,进一步提高诊断效率和准确性。
尽管CTC检测在胃肠肿瘤早期诊断中展现出了巨大的潜力,但目前仍存在一些挑战和限制。例如,CTC的稀有性以及异质性,使得检测过程对样本处理和分析技术的要求极高,任何环节的失误都可能导致结果的偏差。此外,不同患者之间以及同一患者不同疾病阶段之间的CTC特征可能存在差异,这给标准化和规范化检测带来了难度。因此,在未来的研究中,需要不断探索和优化CTC检测技术,以提高其在胃肠肿瘤早期诊断中的可靠性和实用性。
循环肿瘤细胞检测以其高敏感性和特异性在胃肠肿瘤早期诊断中发挥着越来越重要的作用。随着技术的不断进步和临床应用的深入拓展,有理由相信,CTC检测将成为未来胃肠肿瘤精准诊疗领域不可或缺的一部分。
3.2 治疗监测与疗效评估
循环肿瘤细胞检测作为一种非侵入性的液态活检技术,在胃肠肿瘤的治疗监测与效果评估中扮演着愈发重要的角色。通过连续监测患者血液中CTC的数量变化,临床医生能够获得关于肿瘤动态、治疗效果及预后情况的实时信息,从而指导个体化治疗方案的调整。
在治疗监测方面,CTC检测提供了一种便捷的方式来追踪肿瘤对治疗的响应。传统的影像学方法,如CT或MRI,虽然能够显示肿瘤的大小和位置,但往往无法及时反映治疗对肿瘤细胞的杀灭效果。相比之下,CTC检测能够捕捉到血液中游离的肿瘤细胞,这些细胞是肿瘤转移和复发的潜在源头。因此,通过定期检测CTC数量的变化,可以更早地发现治疗的响应情况,包括肿瘤细胞的减少或增加。
在疗效评估方面,CTC检测为临床医生提供了一个客观的指标来评估治疗的效果。传统的疗效评估主要依赖于影像学检查和患者的临床症状,这些方法具有一定的主观性和滞后性。而CTC检测则能够直接反映肿瘤细胞在体内的存活状态,从而更准确地评估治疗的效果。例如,在化疗过程中,如果CTC数量持续减少,说明化疗药物对肿瘤细胞具有有效的杀灭作用;反之,如果CTC数量增加或出现新的突变,则可能提示肿瘤对化疗产生了抵抗,需要及时调整治疗方案。
CTC检测还有助于预测患者的预后情况。多项研究表明,治疗前或治疗过程中CTC数量较高的患者往往预后较差,复发和转移的风险也相对较高。因此,通过监测CTC数量的变化,可以及时发现患者预后不良的迹象,并采取相应的干预措施以降低复发和转移的风险。
总的来说,循环肿瘤细胞检测在胃肠肿瘤的治疗监测与效果评估中具有重要的应用价值。通过连续监测患者血液中CTC的数量变化,临床医生能够更准确地了解肿瘤的动态和治疗效果,从而指导个体化治疗方案的制定和调整。随着技术的不断进步和应用的深入拓展,循环肿瘤细胞检测有望在未来胃肠肿瘤的精准诊疗中发挥更大的作用。
第四章 循环肿瘤细胞检测的挑战与展望
4.1 技术挑战与解决方案
循环肿瘤细胞检测作为一种新兴的胃肠肿瘤精准诊疗手段,尽管在理论和实践中都展现出了巨大的潜力,但在实际应用过程中仍面临一系列技术挑战。这些挑战主要源于循环肿瘤细胞的稀有性、异质性,以及现有检测技术的局限性。为了充分发挥循环肿瘤细胞检测在胃肠肿瘤诊疗中的价值,必须深入探讨这些技术难题,并提出切实可行的解决方案。
循环肿瘤细胞的稀有性是检测过程中最为突出的问题之一。在患者的外周血中,循环肿瘤细胞的数量通常极低,甚至可能达到每毫升血液中仅有几个细胞的水平。这就要求检测技术必须具备极高的灵敏度和特异性,才能从海量的正常细胞中准确识别出稀少的循环肿瘤细胞。为了应对这一挑战,研究者们正致力于开发新型的高灵敏度检测技术,如基于纳米技术的检测方法、单细胞测序技术等,以期实现对循环肿瘤细胞的高效捕获和准确鉴定。
除了稀有性,循环肿瘤细胞的异质性也是检测过程中的一大难题。由于肿瘤细胞的基因突变和表观遗传变化,不同患者甚至同一患者体内的循环肿瘤细胞都可能存在显著的差异。这种异质性不仅增加了检测的难度,还可能导致检测结果的误判。为了解决这个问题,研究者们正在探索基于多组学数据的整合分析方法,通过综合分析循环肿瘤细胞的基因组、转录组、蛋白组等多个层面的信息,以揭示其内在的生物学特征和变化规律,从而提高检测的准确性和可靠性。
现有循环肿瘤细胞检测技术的局限性也是不容忽视的问题。目前,虽然已有多种检测方法被应用于循环肿瘤细胞的检测,但每种方法都存在一定的优缺点,尚无法满足临床诊疗的所有需求。例如,免疫细胞化学法虽然具有较高的特异性,但灵敏度相对较低;而PCR法则在灵敏度上具有优势,但特异性又可能受到影响。因此,开发一种兼具高灵敏度和高特异性的新型循环肿瘤细胞检测技术,已成为当前研究的热点和难点。针对需求,研究者们将积极探索基于人工智能和机器学习技术等多种检测方法,通过多维度的参数构建高效的算法模型,实现对循环肿瘤细胞的精准识别和定量分析。
循环肿瘤细胞检测在胃肠肿瘤精准诊疗中具有重要的应用价值,但仍面临一系列技术挑战。为了充分发挥其潜力,必须深入探讨这些挑战背后的科学问题,并积极寻求切实可行的解决方案。随着新型检测技术的不断涌现和完善,相信在不远的将来,循环肿瘤细胞检测将成为胃肠肿瘤诊疗领域不可或缺的重要手段。
4.2 发展前景
循环肿瘤细胞检测作为胃肠肿瘤精准诊疗领域的新兴技术,其发展前景广阔且充满潜力。随着科学技术的不断进步和研究的深入,这一技术有望在未来几年内取得重大突破,为胃肠肿瘤的诊断和治疗带来革命性的变化。
从技术层面来看,循环肿瘤细胞检测正朝着更高精度、更高敏感性和更高特异性的方向发展。新型检测方法的不断涌现,如基于纳米技术的检测平台、单细胞测序技术等,为循环肿瘤细胞的捕获和分析提供了更为精细和全面的手段。这些技术的进步将极大地提高循环肿瘤细胞检测的准确性和可靠性,使其在临床应用中的价值得到进一步凸显。
在临床应用方面,循环肿瘤细胞检测有望成为胃肠肿瘤早期诊断、治疗监测和预后评估的重要工具。通过定期监测患者血液中循环肿瘤细胞的数量和变化,医生可以更加及时地了解肿瘤的动态,为患者制定更加个性化的治疗方案。此外,循环肿瘤细胞检测还有助于发现肿瘤的微小残留和早期复发,从而为患者提供更为精准的治疗和更好的生存质量。
此外,循环肿瘤细胞检测在基础医学研究中也具有重要意义。通过对循环肿瘤细胞的深入研究,科学家们可以更加深入地了解肿瘤的发生、发展和转移机制,为肿瘤的生物学特性和治疗靶点的研究提供新的思路和方法,比如通过CTC下游的单细胞测序可以发现,胃肠肿瘤相关的基因突变及相关信号通路基因的表达变化。
然而,要实现这一技术的广泛应用和普及,仍需要克服诸多技术和临床上的挑战。未来,随着各方研究的不断深入和合作,相信循环肿瘤细胞检测将为胃肠肿瘤的诊疗带来更为精准和有效的解决方案。
第五章 结论
循环肿瘤细胞检测作为一种新兴的技术手段,在胃肠肿瘤的精准诊疗中展现出了显著的重要性和应用价值。通过对循环肿瘤细胞的捕获与分析,这一技术为临床医生提供了更为全面、深入的肿瘤信息,从而有助于制定更为精确的治疗方案。本文在研究过程中,深入探讨了循环肿瘤细胞检测的基本原理、技术进展以及在胃肠肿瘤诊疗中的具体应用。结果表明,该技术在早期诊断、治疗监测与效果评估等方面均表现出色,显示出较高的敏感性和特异性。
循环肿瘤细胞检测仍面临诸多挑战,如技术难题、准确性和可靠性的进一步提升等。针对这些问题,上述提出了一系列可能的解决方案,期待未来通过不断的研究与实践,逐步攻克这些难关。展望未来,随着科技的不断进步和临床需求的日益增长,循环肿瘤细胞检测在胃肠肿瘤诊疗领域的应用将更加广泛,其潜在的临床意义也将得到进一步凸显。相信CTC检测技术将为胃肠肿瘤患者带来更为精准、个性化的诊疗体验,从而推动整个肿瘤诊疗领域的进步与发展。
参考文献
[1]武田,易滨.原发性肝胆肿瘤循环肿瘤细胞研究进展[J]. 中华肝胆外科杂志,2024,30(09):710-714.
[2]蒋金玲,张俊.液体活检对晚期肠癌治疗及疗效判断之临床意义[C].中国临床肿瘤学会.中国临床肿瘤学会,2016.
[3] 虞随,严泽军.循环肿瘤细胞检测在膀胱癌诊疗中的研究进展[J].医学综述 2020年26卷16期, 3206-3210页, ISTIC, 2020:浙江省医药卫生科技计划项目.
[4] 邓伟明,韦嘉章,李敏,等.循环肿瘤细胞检测在鼻咽癌诊疗中的研究进展[J].医学综述, 2021, 27(23):4719-4724.
[5] 中华医学会检验医学分会分子诊断学组.循环肿瘤细胞临床应用与实验室检测专家共识[J]. 中华检验医学杂志, 2021, 44(11): 1008-1020.
[6] Paterlini-Brechot P, Benali NL. Circulating tumor cells(CTC) detection: clinical impact and future directions[J].Cancer Lett, 2007, 253(2): 180-204.
[7]中华医学会肿瘤学分会胃癌学组,中国医师协会结直肠肿瘤专业委员会,中国抗癌协会大肠癌专业委员会,等.循环肿瘤细胞检测在胃肠道肿瘤诊疗中的应用中国专家共识(2023版)[J].实用肿瘤杂志, 2023.
[8]Bankó P, Lee SY, Nagygyörgy V, et al. Technologies forcirculating tumor cell separation from whole blood[J]. J Hematol Oncol, 2019,12(1):48.
[9] Hong B, Zu Y. Detecting circulating tumor cells: current challenges and new trends[J]. Theranostics, 2013, 3(6):377-394.
[10]Changdan X U, Xiaohong X U, Shao W,et al.CTC Detection and Whole-exome Sequencing Might Be Used to Differentiate Benign and Malignant Pulmonary Nodules[J].中国肺癌杂志, 2023, 26(6):449-460.
[11] 张宁伟,任宾.循环肿瘤细胞检测在临床癌症的应用进展[J].临床医学进展, 2023, 13(12):19062-19071.
[12] 黄浩森.基于深度学习的循环肿瘤细胞检测方法研究[D].苏州大学,2023.
[13] 王丽丽,袁海花,刘峰,等.循环肿瘤细胞检测在结直肠癌临床中的应用[J].现代肿瘤医学, 2019.
[14] 王丽丽,刘峰,张燕捷,等.结直肠癌术后循环肿瘤细胞检测的临床意义[J].中华解剖与临床杂志, 2019, 24(6):8.
[15] 王刘星,王黔.循环肿瘤细胞在胃癌中应用的研究进展[J].安徽医药, 2023, 27(9):1736-1740.
作者 | 吴 高
编辑 | 盛亚琴
声明:本公众号原创发表的文章,任何个人、媒体、网站如需转载,须在文中注明转载自“个体化医学前沿”,并注明作者;文章中标注“来源于网络”的图片,若侵权可联系删除。 |
|
 /3
/3 