金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
蝙蝠,作为唯一会飞的哺乳动物,具有非常特殊的生存能力:它们是大量病毒的宿主,但却毫无症状,这些病毒有埃博拉病毒(Ebola virus)、尼帕病毒(Nipah virus)、亨德拉病毒(Hendra virus)以及SARS-CoV病毒(severe acute respiratory syndrome coronavirus)等【1,2】。
这些RNA病毒具有非常强的致病性,对于人类以及许多其他动物都是非常致命的,当这些病毒在社会中传播时,会带来严重的公共健康问题的经济影响。然而,无论是自然状态下感染,还是在实验中被感染,蝙蝠都不会表现出明显的症状,即使它们体内病毒滴度非常高【3,4】。
蝙蝠身上有许多病毒,那为什么蝙蝠不会死亡?除此之外,根据体型大小推算,蝙蝠还表现出异常的长寿现象,这与生命速率学说(Rate of living theory)严重不符【5,6】。以上这些现象表明,蝙蝠的一些生命特征导致了它们特殊的抗感染以及长寿特质。因此,研究清楚蝙蝠抗感染以及长寿的具体机制具有非常重要的意义,也引起了广泛的关注。
2023年5月11日,来自杜克-新加坡国立大学医学院的王林发教授团队在Cell发表了他们最新的研究成果:Bat ASC2 suppresses inflammasomes and ameliorates inflammatory diseases ,
他们鉴定了蝙蝠体内的一个抑制炎症的关键蛋白ASC2,这个蛋白能够通过抑制炎症小体的作用抑制免疫细胞的炎症反应,这个蛋白在蝙蝠抵抗病毒引发的炎症反应中具有重要作用。

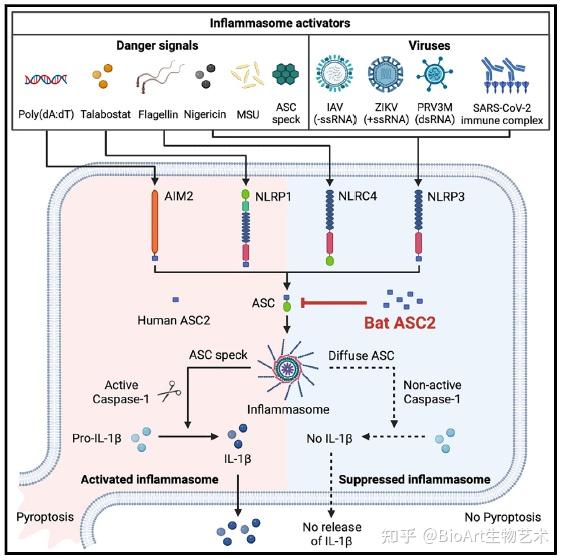
炎症小体是一个由多个蛋白组成的复合物,主要成分是接头蛋白ASC(也叫PYCARD)和效应器caspase-1。炎症小体的组装源于模式识别受体(patter-recognition receptor, PRR)的激活,模式识别受体主要有NLRs(NOD-like receptors)以及ALRs(AIM-like receptors)。激活的NLRs和ALRs会导致胞内ASC聚集形成斑点,然后招募caspase-1,切割并分泌促炎因子IL-1β和IL-18,炎症的产生还会引起细胞发生细胞焦亡。
前期,研究人员发现蝙蝠体内的炎症小体信号通路发生异常,包括ALRs的缺失、NLRP3表达水平的下降以及caspase-1活性和IL-1β分泌的降低。基于此,研究人员聚焦于蝙蝠体内的ASC2蛋白,这个蛋白仅含有PRYIN结构域,但没有CARD结构域,因此不能招募和激活caspase-1。
研究人员首先检测了ASC2在蝙蝠体内的表达水平,发现在13种蝙蝠体内都有ASC2的表达。与人源ASC序列比对证实ASC2缺少CARD结构域,而系统发育分析显示6种蝙蝠ASC2和4种灵长类ASC来源于同一个祖先基因,并不是单独发育形成的。在人体中ASC2基因的表达水平很低,相比ASC,ASC2在蝙蝠体内表达水平更高。
接下来,研究人员在HEK293细胞系中组成性过表达了NLRP3-mCitrine,AIM2-mCitrine以及ASC-mPlum以检测炎症小体的形成。而蝙蝠ASC2的协同过表达既能抑制蝙蝠NLRP3的作用也能抑制人源NLRP3的作用,且抑制了ASC斑点的形成。但是人源ASC2的过表达对于NLRP3的作用以及ASC斑点的形成没有影响。通过免疫荧光,研究人员还观察到蝙蝠ASC2和ASC的共定位,而人源ASC2则没有与ASC形成共定位。以上实验结果表明,蝙蝠ASC2能够有效抑制人源NLRP3和AIM2炎症小体。这个结论在THP-1细胞系中也得到了进一步的验证。
为了进一步检测蝙蝠ASC2的作用,研究人员构建了一种转基因小鼠,先将小鼠体内的ASC2基因清除,然后将蝙蝠ASC2基因重新在小鼠体内表达,这种转基因小鼠可以利用小鼠模型检测蝙蝠ASC2基因的作用。在这个小鼠模型中,研究人员发现,蝙蝠ASC2的表达能够抑制nigericin引起的NLRP3炎症小体活化、ASC斑点形成以及IL-1β的分泌。另外,蝙蝠ASC2的表达对于MSU晶体引起的NLRP3炎症小体活化、poly (dA:dT)引起的AIM2炎症小体活化以及鞭毛蛋白(flagellin)转染引起的NLRC4活化都有抑制作用。
研究人员实施了进一步的体内实验,发现蝙蝠ASC2能够抑制MSU晶体和ASC斑点引起的无菌性腹膜炎,抑制甲型流感病毒(Influenza A virus, IAV)、寨卡病毒、SARS-CoV-2病毒引起的炎症小体活化以及IL-1β分泌。
最后,研究人员研究了ASC2发挥功能的关键结构域和氨基酸位点。通过构建多个结构域融合蛋白以及功能实验检测,研究人员发现蝙蝠ASC2中有4个基因区域是其发挥功能所必需的。接下来,研究人员通过蝙蝠和人源ASC2基因序列比对,在这4个基因区域中找到了26个错配的氨基酸位点。通过单独的点突变,研究人员从这26个氨基酸位点中找到了蝙蝠ASC2发挥功能的4个氨基酸位点,与人源ASC2相比,分别是E10K、R37E、C61Y和G77R。在大部分不同种类的蝙蝠中,这4个氨基酸位点都是高度保守的,仅有一小部分蝙蝠体内含有C61R突变。将人源ASC2序列中这4个氨基酸位点对应的氨基酸突变为蝙蝠中的氨基酸,会导致人源ASC2获得与蝙蝠ASC2相同的功能,说明这4个氨基酸是蝙蝠ASC2发挥功能最主要的原因。
总之,本文通过一系列实验发现蝙蝠体内的ASC2能够抑制炎症小体的活化,并抑制病毒入侵导致的炎症反应,并找到了蝙蝠ASC2发挥作用的分子机制,对于理解蝙蝠的病毒抵抗力和长寿起到了重要的推动作用。
原文链接: https://doi.org/10.1016/j.cell.2023.03.036
参考文献
1. Olival, K.J., Hosseini, P.R., Zambrana-Torrelio, C., Ross, N., Bogich, T.L., and Daszak, P. (2017). Host and viral traits predict zoonotic spillover from mammals. Nature 546, 646–650.
2. Clayton, B.A., Wang, L.F., and Marsh, G.A. (2013). Henipaviruses: an updated review focusing on the pteropid reservoir and features of transmission. Zoonoses Public Health 60, 69–83.
3. Middleton, D.J., Morrissy, C.J., van der Heide, B.M., Russell, G.M., Braun, M.A., Westbury, H.A., Halpin, K., and Daniels, P.W. (2007). Experimental Nipah virus infection in pteropid bats (Pteropus poliocephalus). J. Comp. Pathol. 136, 266–272.
4. Munster, V.J., Adney, D.R., van Doremalen, N., Brown, V.R., Miazgowicz, .L., Milne-Price, S., Bushmaker, T., Rosenke, R., Scott, D., Hawkinson, A., et al. (2016). Replication and shedding of MERS-CoV in Jamaican fruit bats (Artibeus jamaicensis). Sci. Rep. 6, 21878.
5. Seim, I., Fang, X., Xiong, Z., Lobanov, A.V., Huang, Z., Ma, S., Feng, Y., Turanov, A.A., Zhu, Y., Lenz, T.L., et al. (2013). Genome analysis reveals insights into physiology and longevity of the Brandt’s bat Myotis brandtii. Nat. Commun. 4, 2212.
6. Wilkinson, G.S., and South, J.M. (2002). Life history, ecology and longevity in bats. Aging Cell 1, 124–131. |
|
 /3
/3 