金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
关注“Being科学”微信公众号,了解更多精彩内容和福利!!
CRISPR是一种强大而精确的基因编辑技术,可以用于研究基因功能、探索生物过程以及治疗疾病。CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)是一种自然存在于细菌和古细菌中的免疫系统,而CRISPR-Cas9就是利用这一系统进行基因编辑的工具。CRISPR基因敲除通过利用Cas9蛋白或者有类似功能的蛋白和单导RNA(sgRNA)来实现对目标基因的精确编辑。sgRNA可以指导Cas9蛋白或者有类似功能的蛋白定位到目标基因的特定位点,并引导其产生DNA双链断裂。细胞在修复这些断裂时,可以通过不同的修复机制引起基因发生功能丧失或突变。
CRISPR基因敲除基础版---- CRISPR-Cas9
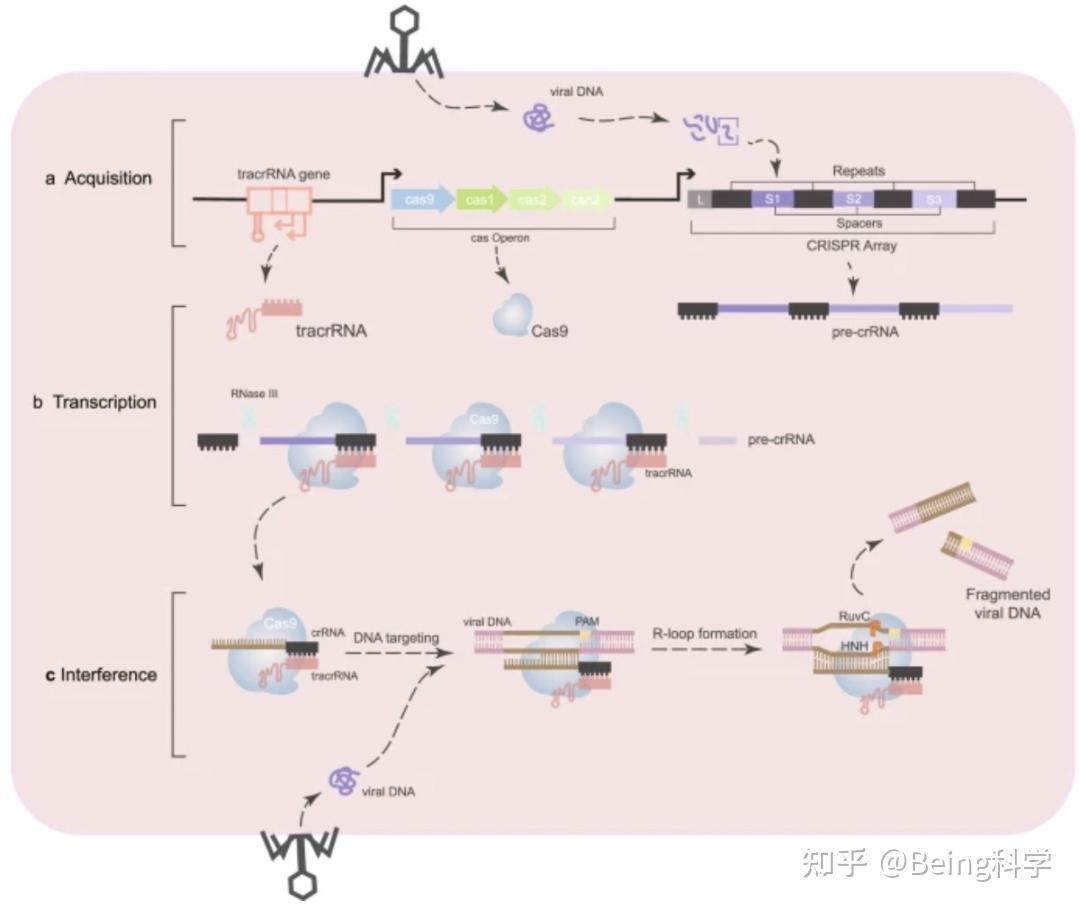
图1: CRISPR-Cas9示意图[1]
CRISPR-Cas9是一种基因编辑技术,用于准确、高效地编辑生物体的基因组。它利用CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)和Cas9(CRISPR associated protein 9)来实现对目标基因的精确编辑。CRISPR是一种存在于细菌和古细菌中的天然免疫系统,能够识别和剪切外源DNA序列,以抵御病毒入侵。Cas9是CRISPR系统中的核酸酶蛋白,可以通过与相应的单导RNA(sgRNA)配对,指导Cas9定位到目标基因的特定位点。
CRISPR-Cas9技术具有以下优点:高度精确,能够实现对基因组的高度特异性编辑,避免对非目标基因的影响;简便和高效:相对于传统的基因编辑方法,如转座子和核酸酶等,CRISPR-Cas9更简便、高效且经济实惠;多样性应用:可以用于各种生物体,包括细菌、植物、动物以及人类细胞的基因组编辑;可编程性:通过设计合适的sgRNA,可以指导Cas9定位到任意目标基因的特定位点。
CRISPR基因敲除进阶版---- CRISPR- Cpf1
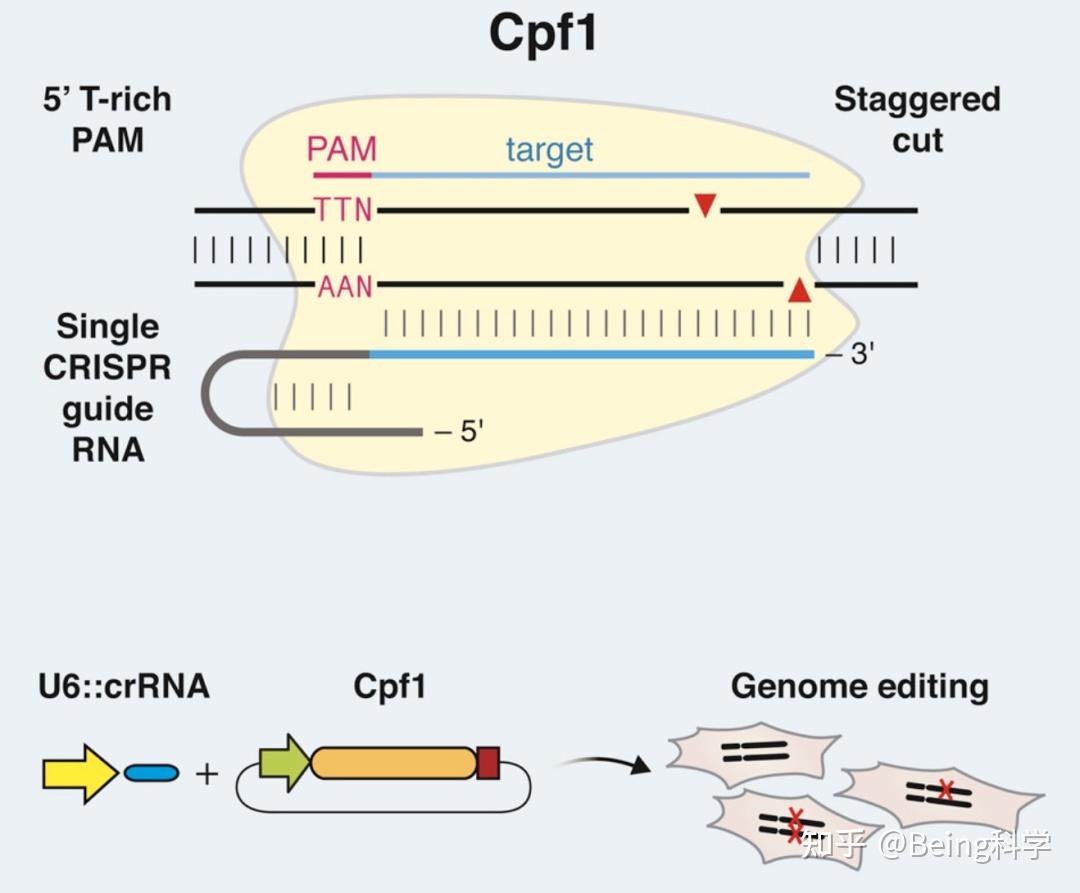
图2: CRISPR- Cpf1示意图[2]
CRISPR-Cpf1系统中的主要组分是Cpf1蛋白和crRNA。Cpf1蛋白负责切割DNA,而crRNA的序列则用于引导Cpf1定位到目标基因组位点。与Cas9不同,Cpf1具有一些独特的特征和优势。首先,Cpf1识别目标序列时不需要依赖辅助分子(如tracrRNA),因此设计和构建crRNA相对简单。其次,Cpf1切割DNA的方式也不同于Cas9。Cpf1产生的切割位点具有突出的5'末端保护簇(PAM),这意味着Cpf1可以在更广泛的基因组位点上实现切割,提供了更多的选择性。
CRISPR-Cpf1技术具有以下优点:更广泛的基因组位点选择:由于Cpf1的切割特点,它可以在更广泛的DNA序列上实现切割。这扩展了基因组编辑的潜力,并提供了更大的灵活性;低离靶效应:CRISPR-Cpf1相对于Cas9来说具有更低的离靶效应,这意味着在编辑过程中更容易避免不希望发生的副作用。这对于精确的基因编辑和研究非常重要;直接结合crRNA:与Cas9需要额外的tracrRNA不同,Cpf1可以直接结合它的crRNA。这样一来,Cpf1系统的构建更加简单,节省了实验上的时间和成本。
CRISPR-Cpf1技术的应用:CRISPR-Cpf1技术可以在许多领域应用,包括基础研究和应用研究。CRISPR-Cpf1可以用于编辑基因组中特定位点的基因,从而研究基因的功能和调控机制。CRISPR-Cpf1可以用于编辑植物基因组,以改良农作物的性状、抗病性及产量。CRISPR-Cpf1还可以被应用于研发疾病治疗方法,例如修复某些遗传缺陷或针对性地抑制关键基因。最后,CRISPR-Cpf1可以用于编辑微生物中的基因,以改变其代谢途径或生产特定的化合物。总之,CRISPR-Cpf1作为CRISPR系统的一个变体,具有许多优点和广泛的应用潜力。它提供了一种简单、高效且可靠的基因编辑方法,对于推动科学研究和应用具有重要意义。
CRISPR基因敲除升级版---- CRISPR-Cas13
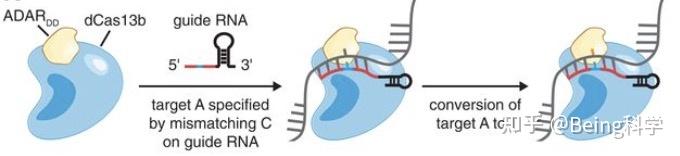
图3: CRISPR-Cas13示意图[3]
CRISPR-Cas13是一种基因编辑技术,类似于CRISPR-Cas9,但其主要用途是靶向RNA而不是DNA。它利用CRISPR和Cas13蛋白来实现对RNA的精确编辑。
根据目标RNA序列设计合适的sgRNA,使其能够与目标RNA序列特异性结合。Cas13与sgRNA复合物的形成:将Cas13蛋白与sgRNA结合,形成Cas13/sgRNA复合物;Cas13/sgRNA复合物通过与目标RNA序列互补配对,定位到目标RNA的特异位点。
RNA切割与降解:Cas13蛋白可识别并切割与sgRNA互补的目标RNA序列,并激活非特异性RNA降解酶,导致目标RNA的降解。
CRISPR-Cas13技术具有以下优点:靶向RNA:相较于CRISPR-Cas9,CRISPR-Cas13主要用于靶向RNA,使得它在编辑RNA病毒、调控基因表达和研究RNA功能等方面具有优势;高度特异性:通过合理设计sgRNA,CRISPR-Cas13能够实现对目标RNA的高度特异性编辑,减少对非目标RNA的影响;具有反应性:Cas13蛋白在切割目标RNA时会产生一个“信号”,这使得CRISPR-Cas13技术在检测和诊断领域具有潜力;无需DNA转染:相较于CRISPR-Cas9,CRISPR-Cas13不需要将基因编辑工具导入细胞核,因此不涉及细胞核的复杂过程。
CRISPR-Cas13的应用包括但不限于用于靶向编辑病原体RNA,抑制病毒复制和传播,从而为抗病毒研究提供新的策略;CRISPR-Cas13可用于研究RNA修饰如甲基化、羟甲基化等对基因表达和细胞功能的影响;通过靶向编辑RNA,CRISPR-Cas13可以实现对基因表达的精确调控,探索基因功能和调查复杂的基因调控网络;CRISPR-Cas13的反应性特点使其成为一种潜在的快速、准确的基因诊断技术,可以用于检测和诊断病原体和遗传疾病。
正如其他基因编辑技术一样,CRISPR-Cas13的应用也需要严格遵守伦理规范和法律法规,确保在科学和医学领域中的安全和可持续发展。此外,对于CRISPR-Cas13技术的进一步研究和优化,仍需要更多的实验和验证。
CRISPR基因编辑激活版---- CRISPRa
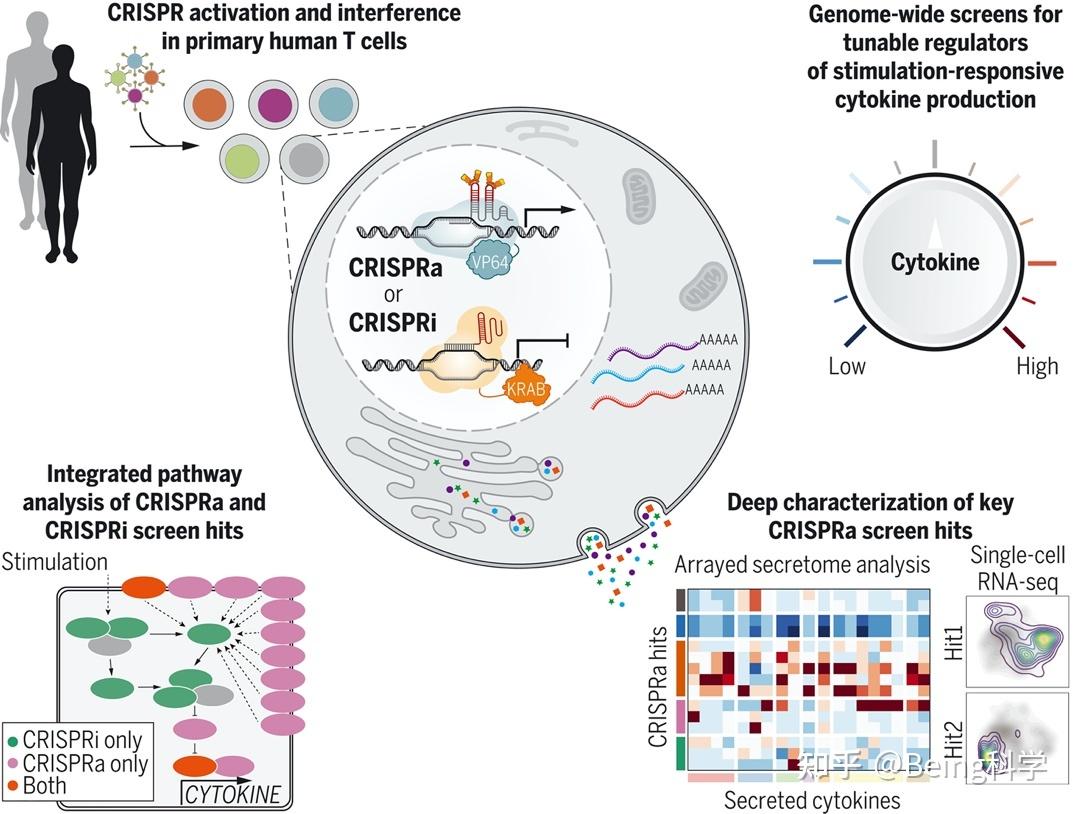
图4: CRISPRa和CRISPRi示意图[4]
CRISPRa(CRISPR Activation)也是一种基因编辑技术,但跟其他的CRISPR基因敲除不同,它主要用于增强特定基因的表达。与常见的CRISPR-Cas基因编辑技术相比,CRISPRa不是通过剪切和修复DNA来进行基因编辑,而是利用CRISPR-Cas蛋白和辅助激活因子来增强目标基因的转录活性。
根据目标基因的启动子区域设计合适的sgRNA,使其能够与该区域特异性结合。CRISPRa复合物的形成:将Cas蛋白与sgRNA结合,并结合辅助激活因子,形成CRISPRa复合物;CRISPRa复合物与目标基因的启动子区域结合,使得辅助激活因子能够促进该启动子的活性;通过辅助激活因子的作用,CRISPRa技术能够增强目标基因的转录活性,从而增加其表达水平。
CRISPRa技术具有以下优点:精确性:CRISPRa技术能够针对特定基因进行增强,具有高度特异性;可逆性:相比于基因敲除等不可逆的基因编辑技术,CRISPRa可以通过调整CRISPRa复合物的浓度或停止给予辅助激活因子来实现对基因表达水平的可逆调控;实验操作简单:CRISPRa技术不需要引入外源DNA片段,只需设计和导入合适的sgRNA和辅助激活因子,实验操作相对简单。
CRISPRa的应用包括但不限于:基因功能研究:通过增强目标基因的表达,可以揭示该基因在细胞、组织或整个生物体中的功能和调控机制;药物发现:CRISPRa技术可以用于筛选具有治疗潜力的靶点基因。通过增强目标基因的表达,可以评估该基因在疾病发展中的作用,并进一步探索潜在的药物干预方法;农业改良:CRISPRa技术可以用于增强农作物中有益基因的表达,从而提高产量、抵抗病害或改进品质等特征;细胞工程:通过增强特定基因的表达,CRISPRa可以用于改善细胞工程应用中的生产效率、代谢途径等。
虽然CRISPRa技术在基因调控和研究领域具有潜力,但在实际应用中仍需要进一步的研究和优化。此外,使用CRISPRa技术时也需要谨慎,确保对目标基因的增强不会引发意外的副作用或紊乱其他基因的正常表达。
总结
CRISPR基因编辑技术具有许多优势,首先,它具有高度的精确性和特异性,能够针对性地编辑目标基因,避免对其他基因的影响。其次,CRISPR基因敲除相对简便、高效且经济实惠,相较于传统的基因编辑方法,如转座子和核酸酶等,更为便捷。此外,CRISPR基因敲除还可以在不同生物系统中应用,包括细菌、植物、动物以及人类细胞。CRISPR基因敲除的应用非常广泛。在科学研究领域,它被用于探索基因功能、鉴定疾病相关基因和研究疾病机制。在农业方面,CRISPR基因敲除可以用于改良农作物的性状、提高产量和抗病性。此外,CRISPR基因敲除还被广泛应用于药物研发、治疗基因缺陷和传染病等方面。总的来说,CRISPR基因敲除技术在基因编辑领域具有广泛的应用前景和重要的研究意义。需要注意的是,在使用该技术时需要谨慎,确保编辑精确性和避免可能的副作用。
图片参考文献:
1. Wang, S.W., et al., Current applications and future perspective of CRISPR/Cas9 gene editing in cancer. Molecular Cancer, 2022. 21(1).
2. Zetsche, B., et al., Cpf1 Is a Single RNA-Guided Endonuclease of a Class 2 CRISPR-Cas System. Cell, 2015. 163(3): p. 759-771.
3. Cox, D.B.T., et al., RNA editing with CRISPR-Cas13. Science, 2017. 358(6366): p. 1019-1027.
4. Schmidt, R., et al., CRISPR activation and interference screens decode stimulation responses in primary human T cells. Science, 2022. 375(6580): p. 513-+. |
|
 /3
/3 