金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
FoundationOne CDx是首个获得FDA批准的用于实体瘤患者组织样本的广谱伴随诊断产品,大Panel的“鼻祖”。
FoundationOne CDX覆盖了309个癌症相关基因的所有外显子、1个启动子区域、1个非编码RNA(ncRNA),以及34个常见基因融合所在的内含子区域,其中21个还包括外显子区域,另外还有3500多个分布于基因组各处的SNP位点。

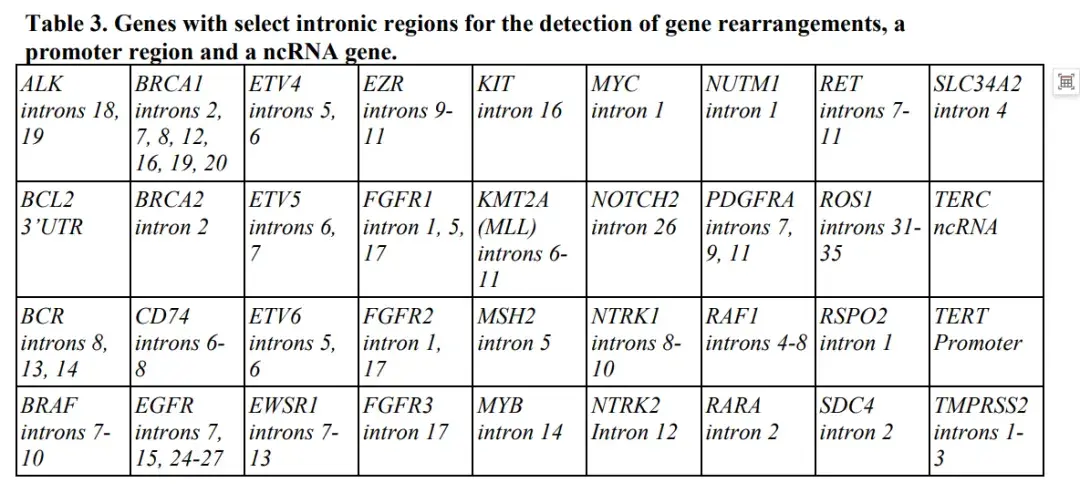
汇总去重之后,该Panel共检测324个基因的相关指标,覆盖基因组范围1.8M左右,但是编码CDS区只有0.8M左右(793kb,用于TMB计算),可看到检测融合的内含子区域占了一半多。
该Panel能同时检测突变,CNV,MSI和TMB。
探针设计:
每个探针长度为120bp,使用叠瓦式策略进行设计,外显子区域探针之间有60bp重叠,内含子区域(需去除重复区域)探针之间有20bp重叠。
每个靶向区域需至少设计3个探针。SNP位点只设计一个探针。

前面说到WES+定制化Panel的策略是现在MRD的主流,Natera的产品Signatera是此路线的标杆产品(MRD标杆:Natera的Signatera解析)。
对Signatera解析的最后一段中,我对大Panel+定制化Panel的路线持怀疑态度,主要是因为Signatera的定制化突变位点达到了16个,另外现在国内好多同路线产品都在“卷”定制突变的个数,动辄50多个。
WES覆盖了人体2w多个基因的全部外显子,大小一般30~70M+(是滴。。WES Panel也有很多不同版本。),突变数目完全够用。
但大Panel一般只覆盖300-1000+基因的外显子,大小1-3M左右,只有WES的几十分之一,成本大幅降低。
但是如果第二步定制Panel还需靶向如此多突变的话,会有好多TMB很低的样本突变数目达不到要求,这时只能减少定制突变的数目,而定制突变数目的减少又会引起敏感性的降低。
那么就研究一下Foundation Medicine和Natera强强联合的产品--FoundationOne Tracker,是如何做的:

FoundationOne Tracker就是将第一步对组织测序的WES改为了上面介绍的大Panel--FoundationOne CDX。
后续定制突变的筛选策略和定制突变Panel的实验及生信流程和Signatera完全一致。
相比WES 100-500ng的DNA投入量,大Panel DNA建库投入量50-100ng,少了很多。
目标测序深度为500x,95%的外显子深度大于100x,虽然目标测序深度是WES的5倍,但毕竟只有1.8M,只有不到Signatera WES的1/36, 另外还不需要配对分析。
目标测序数据量预估只有1.8G左右(按照50%的靶向率估算),而Signatera的目标测序数据量组织+配对白细胞达到22.5G,大Panel的组织测序数据量只有Signatera的不到1/10。
生信处理流程:
使用bwa比对到参考基因组,然后使用picard和samtools去除重复的reads,再使用GATK进行比对优化,最后使用贝叶斯方法的方法进行突变Calling。
最后call出的突变:普通突变的突变频率在5%以上,热点SNV突变的突变频率在1%以上,热点Indel突变的突变频率在3%以上。
因为没有使用配对白细胞,FoundationOne使用了下面一套流程进行胚系Germline突变的过滤:
先使用dbSNP和ExAC人群频率数据库过滤胚系突变,过滤不掉的胚系突变再使用SGZ(somatic-germline/zygosity)算法进行过滤。
SGZ算法是一个逻辑回归模型,基于观察到的基因突变频率(AF)与推断的预期胚系突变频率之间的差异进行建模,每个突变会得到一个“somatic probability score”,即体细胞突变概率值。概率值高的突变才会被认为是体细胞突变。
体细胞突变找好了,下面最关键的就是定制Panel的突变个数,突变数目足够的就直接选16个突变进行定制,不够的就只能少选一些,突变实在很少的样本(少于2个)就直接不能进行定制了。
下图展示的是FoundationOne Tracker在非小细胞肺癌中定制突变的数目:
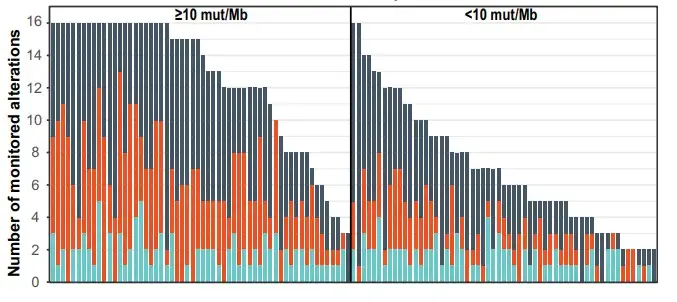
其中TMB大于10的样本(至少有8个体细胞突变)中还是有不少能够满足16个突变数的,最后定制的突变个数中位数为13个,但也有一些样本只选择了3-4个突变,看来不是所有的突变能够进行监控,当然也可能是引物难以设计等原因。
TMB小于10的样本中,只有少数几个能达到16个突变数目的目标,定制突变个数中位数是7个,有些甚至只有2个。
至于有多少个样本达不到要求 (少于2个突变),根据文章中展示的数据,在非小细胞肺癌中比例是8%左右(19/253)。
不过即使有些样本定制突变数目很少,但是阳性的判定规则没有变,还是必须两个突变阳性,样本才阳性。
FoundationOne Tracker已经被美国医保覆盖监控所有实体瘤患者对免疫检查点抑制剂的反应:

但是可能最有吸引力的是对2019年8月20以后进行过FoundationOne CDX检测的患者不需要进行额外的组织测序了,尤其是TMB高的患者,可以直接进行定制Panel的血液检测。
毕竟已被获批很多年,积累的样本数目肯定很多了。
有钱还是上WES+定制化Panel吧, 万一突变很少,TMB很低。。毕竟大Panel也不便宜。。
参考资料:
Kansara M, Bhardwaj N, Thavaneswaran S, et al. Early circulating tumor DNA dynamics as a pan‐tumor biomarker for long‐term clinical outcome in patients treated with durvalumab and tremelimumab[J]. Molecular Oncology, 2023, 17(2): 298-311.
Pellini B, Madison R W, Childress M A, et al. Circulating tumor DNA monitoring on chemo-immunotherapy for risk stratification in advanced non–small cell lung cancer[J]. Clinical Cancer Research, 2023, 29(22): 4596-4605.
另外还有FoundationOne CDX的技术文档,三个参考资料打包文件可关注“玩转ATGC”微信公众号,后台发送“FoundationOne”获取。 |
|
 /3
/3 