金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
宫颈癌,2020年以约60万的全球新发病例位于三大妇科肿瘤(宫颈癌、子宫内膜癌、卵巢癌)之首。在其治疗中,根据美国NCCN指南推荐,早期宫颈癌的一线治疗为手术切除,中晚期无法手术的宫颈癌则主要采取放疗和化疗。目前的治疗策略下,宫颈癌的5年生存率约为67%,但复发和/或转移情况下5年生存率仅为17%。对于复发和/或转移宫颈癌患者,现有治疗选择十分有限,一线标准治疗主要以含铂双药化疗联合或不联合抗血管生成药物(贝伐珠单抗)为主,一线治疗后出现疾病进展的患者,治疗选择则更加有限,且尚未确立标准治疗。
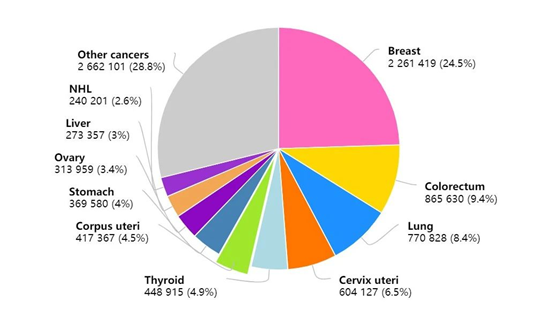
2020年全球女性癌症新发病例数前十的癌症类型
近年来,包括PD-1/L1免疫检查点抑制剂在内的各类靶向治疗药物为各类实体瘤的治疗带来了革命性的改变。2018年6月,美国FDA加速批准帕博利珠单抗(PD-1抑制剂)单药用于化疗期间/后疾病进展、PD-L1表达(CPS≥1)的复发或转移性宫颈癌(二线治疗),使其成为了晚期宫颈癌患者的首款抗PD-1免疫疗法。而随着更多有潜力的免疫检查点的探索,以及双特异性抗体、ADC药物等创新药技术的进一步发展,宫颈癌的治疗在这两年也取得了多项突破性进展。
1、PD-1联合化疗挺进宫颈癌一线治疗
2021年10月13日,美国FDA批准帕博利珠单抗与含铂化疗联用,加或不加贝伐珠单抗(bevacizumab),一线治疗肿瘤表达PD-L1(CPS≥1)的持续性、复发性或转移性宫颈癌患者。这是首个获批用于这类患者一线治疗的抗PD-1组合疗法。同时,美国FDA也将2018年对帕博利珠单抗单药用于宫颈癌二线治疗的加速批准转为了全面批准。
此次一线治疗的获批是基于一项随机双盲、含安慰剂对照的关键性Ⅲ期临床研究KEYNOTE-826的结果,该临床试验共入组617名持续性、复发性或转移性宫颈癌成人患者(无论PD-L1表达状态如何),这些患者没有接受过全身化疗。研究结果已于今年9月发表在《新英格兰医学杂志》上。

研究结果显示,对于肿瘤表达PD-L1(CPS≥1)的患者(n=548),帕博利珠单抗联合化疗(±贝伐珠单抗)组相较于化疗(±贝伐珠单抗)组,患者死亡风险降低36%,mPFS为10.4个月(vs. 8.2个月),客观缓解率(ORR)为68%(vs. 50%),mDOR为18.0个月(vs. 10.4个月)。
2、首款国产双特异性抗体申请上市,剑指宫颈癌
2021年9月, 国家药品监督管理局(NMPA)正式受理了一款靶向PD-1和CTLA-4的双特异性抗体凯得宁单抗(Cadonilimab,AK104)用于复发或转移性宫颈癌的上市申请,并获的优先审评。这使得这款由国内企业自主研发并产业化的抗体药物有望成为全球首款获批上市的基于PD-1的双特异性抗体药物,也将成为中国第一款获批上市的自主研发的双特异性抗体药物。
在Cadonilimab的II期临床中,其单药治疗复发或转移性宫颈鳞癌表现出了令人鼓舞的有效性和安全性数据,ORR达到47.6%,DCR为66.7%。安全性方面,3级及以上药物相关不良事件(TRAE)的发生率仅为12.9%。
3、基于PD-1单抗的双免联合策略展现潜力
2021年6月,美国FDA受理了另一款PD-1单抗Balstilimab(巴替利单抗)单药用于化疗期间或化疗后疾病出现进展的复发性或转移性宫颈癌的上市申请,同时授予其优先审查资格,预定的批准日期为2021年12月16日。然而,在10月份帕博利珠单抗单药在该适应症上获得完全批准后,Balstilimab的上市申请也随之被撤回,并将停止其单药治疗宫颈癌的临床研究。不过,该撤回决定不影响Balstilimab联合疗法的开发计划,包括与CTLA4抗体(AGEN1184、AGEN1181)的联合治疗方案。
Balstilimab此前的上市申请是基于2020 ESMO大会上提交的Balstilimab单独或联合使用抗CTLA-4单抗Zalifrelimab(AGEN1184)在复发转移宫颈癌中的两项独立Ⅱ期试验的初步结果,Balstilimab单药治疗的ORR为14%,双免联合方案的ORR为22%,在安全性方面,两种策略中的患者均对治疗表现出较好的耐受性,联合治疗在增加有效性的同时,不良事件的发生率也相应增加。
此外,随着更多有潜力的免疫检查点被探索和研究,PD-1单抗的联合策略也有了更为广泛的选择。目前,TIGIT单抗也与PD-1单抗联合用于复发或转移性宫颈癌患者的临床研究中。
国内药企开发的候选产品中,BGB-A1217(抗 TIGIT 单抗)联合替雷利珠单抗( 抗PD-1单抗用于既往经治的复发或转移性宫颈癌患者的Ⅱ期研究,目前正在我国多家三甲医院开展临床试验。
Ø 国外药企研发的抗TIGIT单抗Tiragolumab,目前也在国内获批进入临床试验阶段,与阿替利珠单抗(PD-L1单抗)联合用于多种实体瘤,其中包括转移性和/或复发性PD-L1表达阳性的宫颈癌。
4、首个治疗宫颈癌的ADC药物上市
今年9月,美国FDA加速批准一款靶向TF(组织因子)的ADC药物Tivdak(Tisotumab Vedotin)上市,用于在化疗期间或化疗后病情进展的复发性或转移性宫颈癌患者。据悉,这是首个获批治疗宫颈癌的ADC药物。
此次批准是基于一项Ⅱ期临床研究innovaTV204的积极数据,该研究纳入了101名复发或转移性宫颈癌患者,这些患者在复发或转移背景下接受过不超过两次的全身方案,包括至少一次先前的铂类化疗方案。结果显示,Tisotumab Vedotin的ORR为24%,其中完全缓解率7%;mDOR为8.3个月,mPFS为4.2个月,中位OS为12.1个月。安全性方面,TRAE(1-2级)为65%,TRAE(≥3级)为28%。
小结
长期以来,全球范围内上市的宫颈癌靶向药只有抗血管生成药贝伐珠单抗,目前,PD-1单抗和ADC药物在该适应症上的获批,突破了长期以来晚期宫颈癌患者治疗选择的局限性。随着临床研究和监管批准的进一步推进,双特异性抗体、免疫联合策略等将为这类患者提供更广泛的选择。
宫颈癌项目:
1、一项在既往经治的复发或转移性宫颈癌患者中评价抗PD-1单克隆抗体替雷利珠单抗(BGB-A317)联合或不联合抗TIGIT单克隆抗体BGB-A1217的有效性和安全性的2期研究。
具体详情可以阅读这篇文章:
患者招募|经治复发或转移性宫颈癌,这种治疗方式可考虑参考资料:
[1] 世界卫生组织(WHO)国际癌症研究机构(IARC) :2020年全球最新癌症负担数据
[2] 周晖、刘昀昀、罗铭、林仲秋. 《2021 NCCN子宫颈癌临床实践指南(第1版)》解读[J]. 中国实用妇科与产科杂志, 2020, v.36(11):71-77.
[3] 李玉英, 赵 丽, 袁 芳. 新型免疫检查点在宫颈癌中的应用前景[J]. 临床医学进展, 2021, 11(8):8.
[4] “FDA approves pembrolizumab combination for the first-line treatment of cervical cancer”from https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pembrolizumab-combination-first-line-treatment-cervical-cancer
[5] Colombo et al., (2021). Pembrolizumab for Persistent, Recurrent, or Metastatic Cervical Cancer. NEJM, DOI: 10.1056/NEJMoa2112435
[6] NMPA官网:https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[7] 2020 ESMO Congress; September 20, 2020; virtual.Abstract LBA34.
[8] https://www.biospace.com/article/releases/agenus-provides-update-on-balstilimab-development/?keywords=Agenus
[9] 康方生物:Akeso 2021 R&D Day Company Presentation
[10] https://www.biospace.com/article/releases/seagen-and-genmab-announce-fda-accelerated-approval-for-tivdak-tisotumab-vedotin-tftv-in-previously-treated-recurrent-or-metastatic-cervical-cancer/?keywords=Tivdak |
|
 /3
/3 