金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
一直以来,凋亡、自噬、炎症等相关通路都是科研者们研究的重点和热点,在这些通路的研究中,Cleaved-Caspase 3、Bax、Bcl-2、LC3B、IL-6、TNFα等小分子量蛋白作为标志性角色,更是科研实验中必不可少的研究对象。然而小分子蛋白的WB检测总是容易出现各种各样的问题:分离效果差,条带拖尾模糊,无条带等,无一不是大家科研路上的绊脚石,有时尝试各种优化调整甚至更换样本和抗体仍不能获得理想的结果。今天,小优细节君就来和大家聊一聊获得小分子蛋白理想条带有什么好的办法。
在进行小分子蛋白WB实验时,我们经常忽略的电泳步骤,可能是条带好坏的关键影响因素。目前最常用的Tris-Glycine-SDS-PAGE凝胶电泳体系,原理是让蛋白与SDS结合,蛋白带上大量负电荷,在电场作用下向前迁移。根据蛋白质通过凝胶孔的时间,将不同分子量大小的蛋白分离开来。而小分子蛋白在电泳时形成的复合物的大小和电荷与SDS微团相近,很难被分离出来[1],导致结果条带模糊或无条带,那我们可以怎么做来改善这一情况呢?
凝胶体系
有研究者提出可以减少电泳中SDS的用量,但效果并不佳。Schagger[1]等提出可以在高离子强度下电泳来实现更好的分离效果,他们用三羟甲基氨基甘氨酸(Tricine)代替甘氨酸(Gly),形成了一种新的Tricine-SDS-PAGE凝胶电泳体系。与Gly(pK 9.6)相比,Tricine(pK 8.15)在pH为6.8~8.8时,更多以阴离子形式存在,在胶中的迁移速度更快,能够显著提高对小分子蛋白的分离效果。用两种体系对相同样本进行检测,Tricine-SDS-PAGE能够有效分离17.2-2.5kDa的蛋白(Fig.1a),而相同实验步骤下,Glycine-SDS-PAGE体系分离效果较差,条带并未被分离(Fig.1 b)。
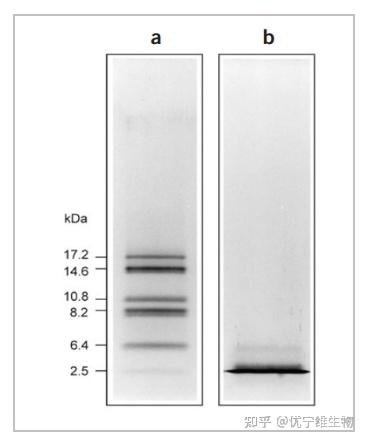
Fig.1 不同体系分离蛋白对比图
与常规的体系相比,Tricine-SDS-PAGE凝胶系统一般需要使用2种不同的缓冲液:阳极缓冲液和阴极缓冲液,阴极缓冲液中用Tricine代替Glycine。电泳时在电泳槽底部加入阳极缓冲液,两块胶的中间槽加入阴极缓冲液,实现对小分子蛋白更有效的分离。
凝胶浓度
凝胶浓度决定孔径,孔径是影响蛋白在电场中迁移速度的重要影响因素。凝胶的孔径越小,小分子蛋白在其中迁移的速度越慢,分辨效果也越好。
分离胶中丙烯酰胺和双丙烯酰胺的比例会影响凝胶的孔径大小。在Tricine-SDS-PAGE体系中,通过对比凝胶中丙烯酰胺和双丙烯酰胺的不同比例和交联度,发现经过改进的比例较原先的分离效果更好,可以更精细地分辨1-100kDa之间的蛋白[2]。如Fig.2a、b、c,改变凝胶中两种单体的百分比和交联度对于同一样品的分离效率不同。
在分离胶中添加尿素也可以提高胶的分离效果。尿素可以改变凝胶的结构,降低凝胶孔径的大小。在分离胶中添加一定比例的尿素,可以增强对小分子蛋白的分离效果[3,4](Fig.2d)。另有一些研究发现在分离胶中添加甘油也可以起到与尿素一样的效果[5]。
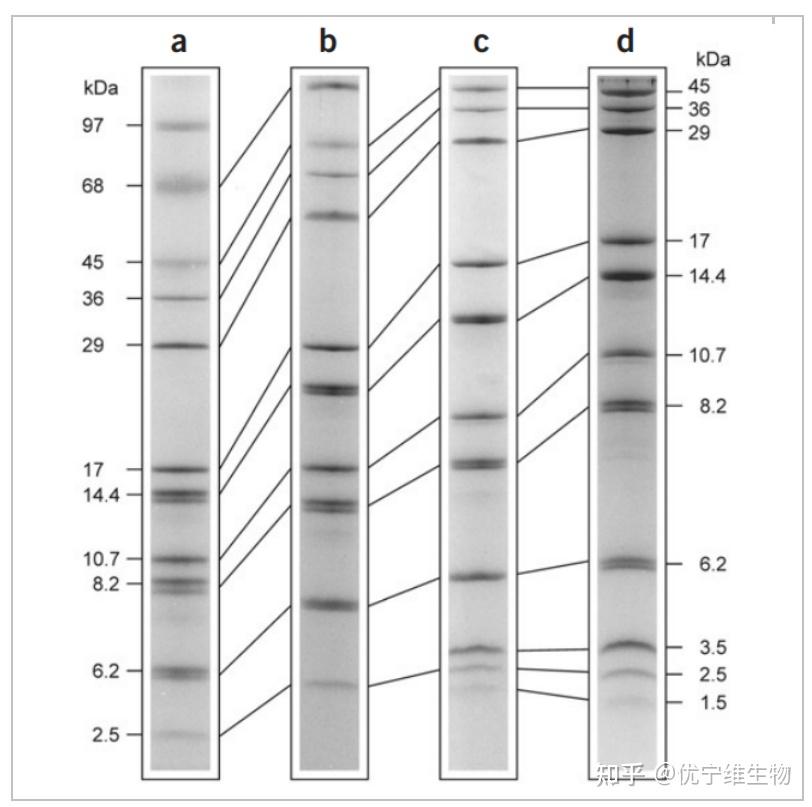
Fig.2 Tricine-SDS-PAGE不同凝胶配比结果对比图(a)10% T, 3% C (b)16% T, 3% C (c)16% T, 6% C (d)16% T, 6% C plus 6M ureaT: 两种单体的总百分比浓度. C: 交联剂的浓度
电泳条件
在电泳时控制跑胶时间,保证小分子蛋白与内参分开,尽量不要跑太久,前沿接近胶底部即可。尝试用恒流进行电泳,浓缩胶推荐30mA,分离胶推荐45mA。
电泳过程中注意降温,温度升高会加快小蛋白分子的运动,增加弥散速度。
转膜条件
可以适当减少转膜时间,降低转膜的电压电流,防止过转。同时在转膜后可以用丽春红染色确保转膜成功。建议使用0.22μm孔径的膜,且可以将膜在甲醇中激活的时间延长至2~3min,增加膜与蛋白的结合率。
其他小细节
(1)确定样本中靶标蛋白的表达量,可以通过The Human Protein Atlas、GeneCards、BioGPS等数据库查询。很多小分子蛋白需要适当刺激才能诱导表达,所以实验前要做好充分的文献调研。
(2)在样本制备过程中添加蛋白酶和磷酸酶抑制剂,防止蛋白降解;在制样过程中增加超声处理,尽可能的充分裂解样品,暴露抗原表位。尽量使用新鲜样本进行实验。
(3)小分子蛋白由于弥散拖尾现象较多,最好是保留3个以上marker,或者做全膜,避免蛋白被裁去。
参考文献:
[1] Schägger H, von Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem. 1987 Nov 1;166(2):368-79. doi: 10.1016/0003-2697(87)90587-2. PMID: 2449095
[2] 曹佐武.有效分离1kDa小肽的Tricine-SDS-PAGE方法[J]. 中国生物工程杂志, 2004(01): 74-76. DOI:10.13523/j.cb.20040118.
[3] Schägger H. Tricine-SDS-PAGE. Nat Protoc. 2006;1(1): 16-22.doi: 10.1038/nprot.2006.4. PMID: 17406207
[4] 詹玉春,刘文斌.用SDS-PAGE电泳测定豆粕酶解物中的低分子多肽分子量[J].畜牧与兽医, 2004(11): 4-6.
[5] 江龙法,钱志刚,杨海麟等.用于分离小分子肽的凝胶电泳的改进研究[J].化学世界, 2007(04): 200-202. DOI: 10.19500/j.cnki.0367-6358.2007.04.003.
更多推荐:
原文地址:https://zhuanlan.zhihu.com/p/677292636 |
|
 /3
/3 