金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
在前面的推文中,我已经详细地讲解了Western blot实验原理和过程,指路:
最全 Western blot 实验手册(上)
最全 Western blot 实验手册(下)
今天我们来聊聊磷酸化蛋白检测那点事儿
蛋白磷酸化是一种非常重要的翻译后加工,做信号通路必然是要检测蛋白磷酸化的,Western blot是评估蛋白磷酸化状态的最常用方法,其实和跑正常蛋白没什么出入,只不过孵育的是识别磷酸化的抗体,下面总结一下实验中要避的雷....
熊叔毒鸡汤:没有不进取的科研人儿,只有不进取的磷酸化抗体!
一、先弄明白样品中磷酸化蛋白表达情况
样品的磷酸化水平一般都比较低或压根不表达,这个时候可通过物理或化学方法进行一定的刺激和诱导,刺激条件各不相同,刺激的时间和强度需要自己查文献和进行预实验来确定,前提是要确保这个样品本身是能检测出目的蛋白的。可以利用PhosphoSitePlus数据库(https://www.phosphosite.org)查询蛋白的磷酸化情况。
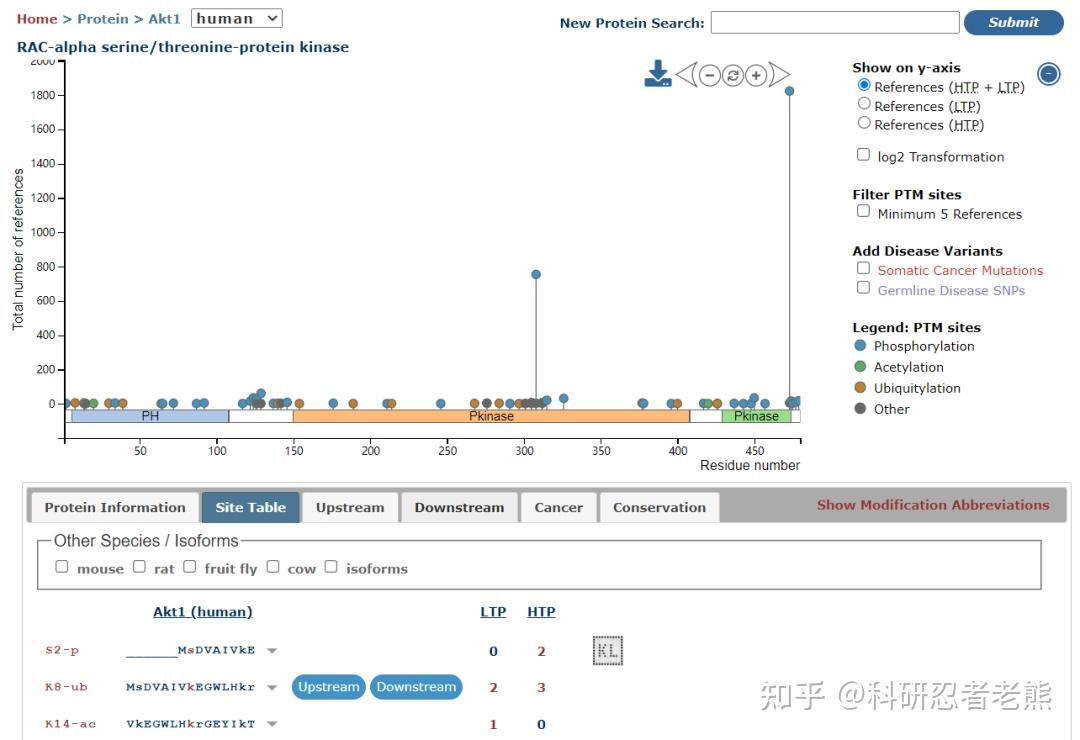
实验时别忘了设置阳性和阴性对照,可进一步确定抗体检测到的信号的特异性。
二、提取磷酸化蛋白要注意哪些事儿?
1、快、准、冷:蛋白的磷酸化是一个快反应,所以制样的过程要迅速,样品要新鲜,全程冰上操作。用PBS洗涤细胞时,PBS一定要4℃预冷。
如果样品来源是组织,提取蛋白时采用液氮研磨的方法,研磨器具也要提前预冷。
2、蛋白酶抑制剂:组织或细胞裂解时会释放出大量内源性蛋白磷酸酶,能催化磷酸化蛋白的去磷酸化,这就没办法体现样品体内的生理状态磷酸化差异。所以提取磷酸化蛋白的裂解液要新鲜配制,避免反复冻融。裂解液中一定要有蛋白酶抑制剂和磷酸酶抑制剂,否则即使条带出来也会很浅,结果可信度不高。另外,还要注意检测蛋白磷酸化位点是什么氨基酸,如果是酪氨酸还要加1µmol/L的原钒酸钠(sodium vanidate)。有的磷酸化抗体会特意注明上样前不要煮沸,煮沸可能会破坏其磷酸化位点。提取的磷酸化蛋白需要尽快变性蛋白并于-80℃分装保存,同时避免反复冻融导致磷酸基团的降解。
三、内参的问题
磷酸化蛋白检测需要设置两个内参,一个是磷酸化蛋白对应的总蛋白,比如你要检测Akt磷酸化,那你就要同时跑一个Akt的蛋白和Akt磷酸化的抗体,仅仅是检测到磷酸化蛋白表达量的变化不能说明问题,只有磷酸化蛋白与总蛋白比值变化了才能说明磷酸化水平发生变化了;另一个是普通内参比如actin和GAPDH等。普通内参是作为体系的对照,保证上样量一致从而排除体系本身的影响,对于结果分析很重要。
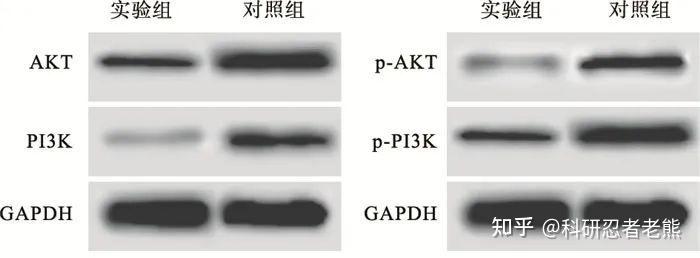
低剂量LBH589通过PI3K/AKT途径诱导对上皮性卵巢癌细胞凋亡作用机制研究 (bbmc.edu.cn)
四、Western Blot 操作过程中的问题
首先由于磷酸化蛋白的丰度较低,大概只有总蛋白量的10%,甚至更低,所以有时候为了能发出磷酸化条带,我们需要每个孔上足够蛋白量;
不得不强调,决定磷酸化发的好不好关键在磷酸化抗体(被坑了无数次的同学请举个手....),所以要选择paper里用的比较好的。
转膜后,用5%BSA(TBST溶解)进行封闭1h,非实验级别的奶粉可能含有磷酸酶等杂质,不适用于磷酸化蛋白的检测。另外避免膜封闭时间过长,可能会掩盖抗原表位,阻止抗体结合。用洗涤时摇床的转速不能太快,洗涤的时间不能太长。根据实验情况可加大一抗浓度以及孵育时间。
实验急不得,磷酸化检测更是急不得,4℃抗体孵育过夜的好处不仅使抗体有充足时间结合,而且低温环境下使蛋白抗原在膜上稳定不容易脱落,原因是蛋白抗原靠物理吸附作用停留在PVDF膜上,高温下PVDF膜上蛋白容易脱落导致抗原抗体结合效率降低。
五、抗体孵育和洗脱要注意的事儿
磷酸化蛋白和其对应总蛋白的条带位置基本是一致的。以标准的磷酸化WB来说,在检测完磷酸化抗体后,应该用抗体剥脱液(stripping buffer)洗脱抗体后,再孵总蛋白抗体。抗体剥脱液可以选择自己配制或购买商业化的试剂。
抗体剥脱液配方:取0.76g Tris-base、2g SDS和700µL β-巯基乙醇,加蒸馏水至100mL,用盐酸调整pH到6.8。
抗体洗脱液用来去除已结合的抗体,但也会去除部分蛋白,导致蛋白信号变弱。实验过程水浴温度即使设定为55℃,但温度往往不稳定,容易超过55℃,导致较多目的蛋白被去除,故建议温度设为50℃,30min。既能有效去除已结合的抗体,又能保护目的蛋白。抗体洗脱时膜一定要完全泡在抗体洗脱液中(可用较硬的塑料膜封好),然后将塑料膜完全浸入水中使其受热均匀,否则导致显影出来的总蛋白不均一,影响结果分析。
好了,就讲到这里,后面我们来聊聊为什么有些同学的WB图不尽人意,如何规避,以及内参选择的一些门道。
别忘了点赞、转发、关注,我是老熊,下一篇推文见!
参考文献
[1] Hirano S. Western blot analysis. Methods Mol Biol. 2012;926:87-97.
[2] 林秋雄, 吴炳义. 生物医学基础研究使用手册[M]. 人民卫生出版社, 2021
[3] 陶永光. 肿瘤分子生物学与细胞生物学实验手册[M]. 湖南科学技术出版社, 2014. |
|
 /3
/3 