金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
小分子或蛋白质与 RNA 或 DNA 的相互作用通常涉及核酸 (NA) 折叠和结构的变化。这些过程的生物物理表征有助于我们了解潜在的分子机制。利用 kinFRET,可以使用基于芯片的生物传感器通过 FRET(荧光共振能量转移) 信号直接跟踪分析物结合后 NAs(DNA 或 RNA)构象变化的动力学。

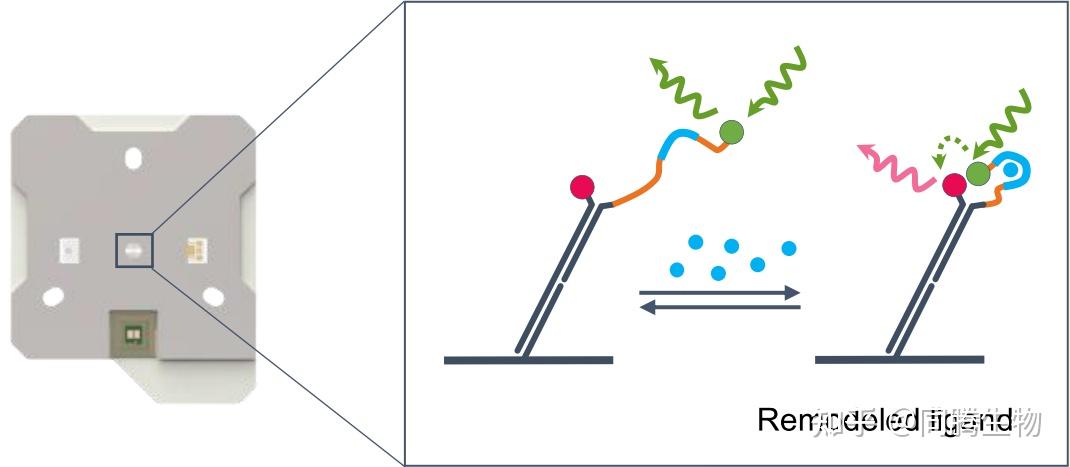
实验一
我们利用kinFRET监测了不同形式的aptamer (MN19) 与小分子分析物相互作用时的构象变化。
aptamer-quinine相互作用可在kinFRET 模式下测量。
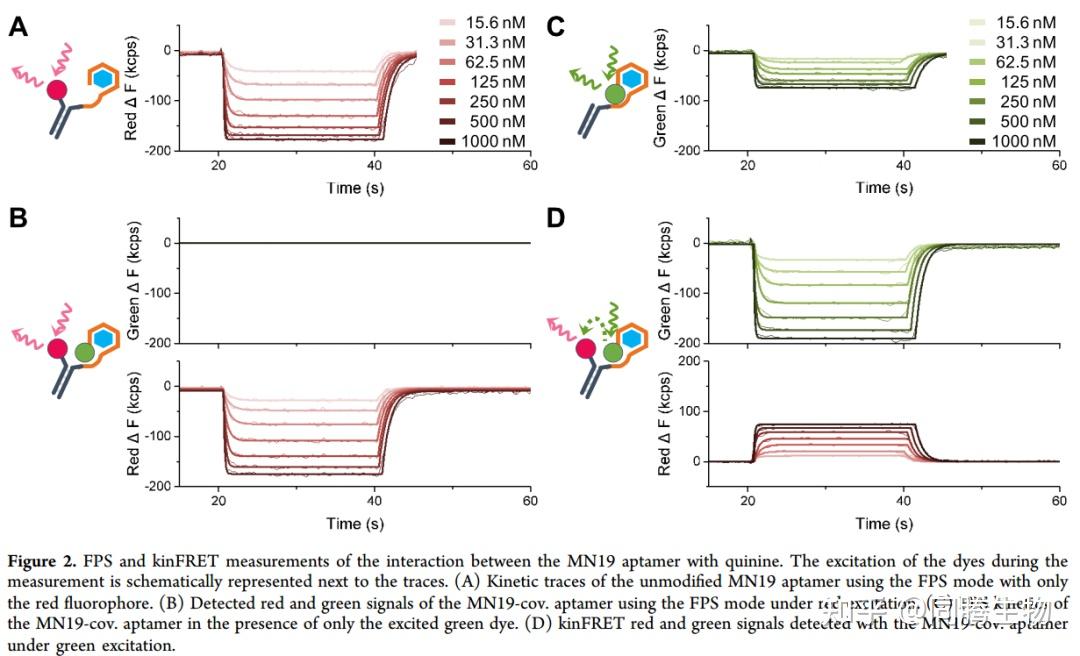
为了更详细地研究结合机制,我们开发了一种 kinFRET 测量方案,其中添加了绿色染料作为donor以形成 FRET 对。我们将绿色染料共价连接到aptamer的 5' 端,命名为MN19-cov。首先通过仅激发红色染料(图2B)来检测,以表征修饰的aptamer并确保额外的绿色染料对通过红色荧光监测结合的能力没有影响。由于缺乏绿色激发,没有观察到绿色荧光的变化。与此相反,红色 FPS 信号在结合时显示出quinine依赖性的降低。信号变化与未修饰的 MN19 aptamer(图2A)非常相似,幅度变化相似,这表明连接的绿色染料不会影响红色染料测量这种相互作用的能力。然后,我们分析了在没有红色染料的情况下附着的绿色染料报告的信号(图 2C)。不同浓度的quinine会导致染料的浓度依赖性淬灭,这表明共价连接的绿色染料也可以感知与quinine的相互作用。最后,我们研究了完整的 FRET设置,其中供体绿色染料和受体红色染料在绿色激发下都存在(图 2D)。绿色荧光信号会随着quinine浓度而降低,而红色荧光信号会增加。当解离分析物时,初始荧光会迅速恢复。绿色染料的荧光降低不仅是因为能量转移到红色染料(FRET),还因为结合相互作用本身以及染料靠近适配器链末端碱基时的折叠(FPS 信号),如图 2C 所示。
aptamer修饰和不同的小分子分析物导致不同的动力学过程。
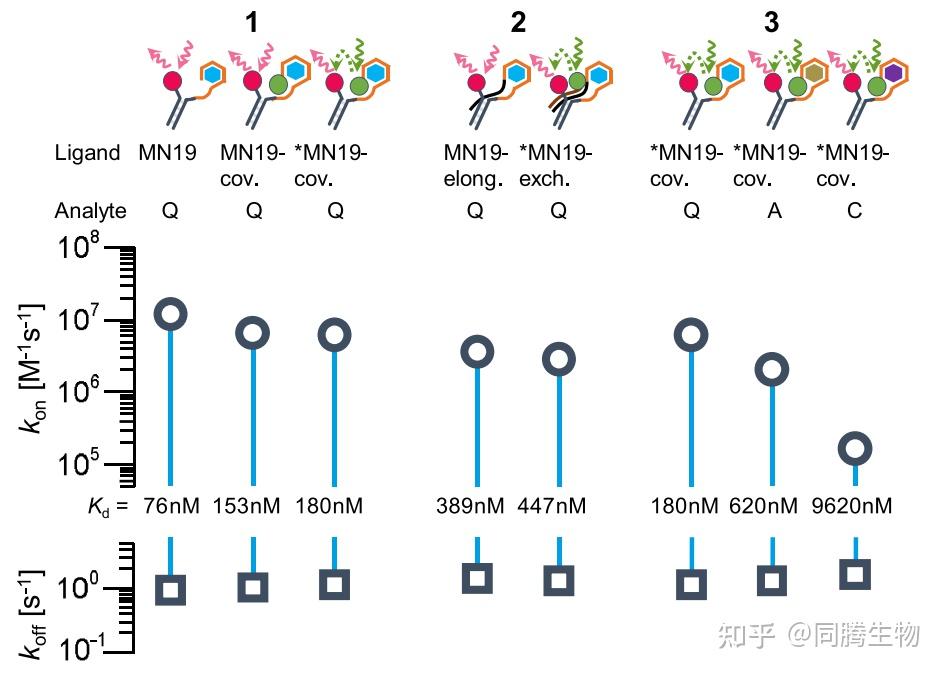
Kd 通过 koff(s−1)与 kon(M−1 s−1)的比率获得。图 3的第一列显示了quinine与 MN19 相互作用的动力学,用adapter链上的红色染料检测。旁边显示的是 MN19cov。在 5′ 端有两个额外的胸腺嘧啶和一个绿色染料,以红色激发(FPS 模式),相邻的是,可以看到相同的设置在绿色下激发(kinFRET 模式)。请注意,在 FPS 模式下,我们同时观察到构象变化和结合过程,而在 kinFRET 模式下测量的 MN19-cov的红色信号仅报告构象变化。MN19-cov 的 kon 大约低两倍。与 FPS 模式下测量的未修饰 MN19 相比,FPS 和 kinFRET 模式下的aptamer Kd 值同样增加了 2 倍,因为 koff 几乎相同。事实是,在 FPS 模式下测量的相同 MN19-cov. aptamer的 kon(6.47 ± 0.24 × 106 M−1 s −1 )和在 kinFRET 模式下测量的 kon(6.00 ± 0.22 × 106 M−1s −1 )几乎相同,支持我们的假设,即与未修饰 MN19 相比 kon 的降低可归因于增加的流体动力学阻力,这减慢了由额外的染料和用作间隔物的两个碱基引起的折叠。
实验二
人类胰岛素样生长因子 II mRNA 结合蛋白 3 (IMP3) 的串联KH结构域对RNA识别的结合动力学,揭示了两个 KH 结构域的不同动力学贡献。
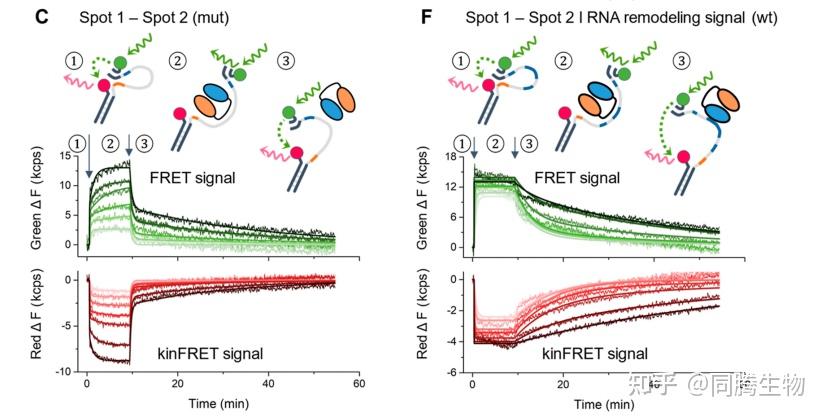
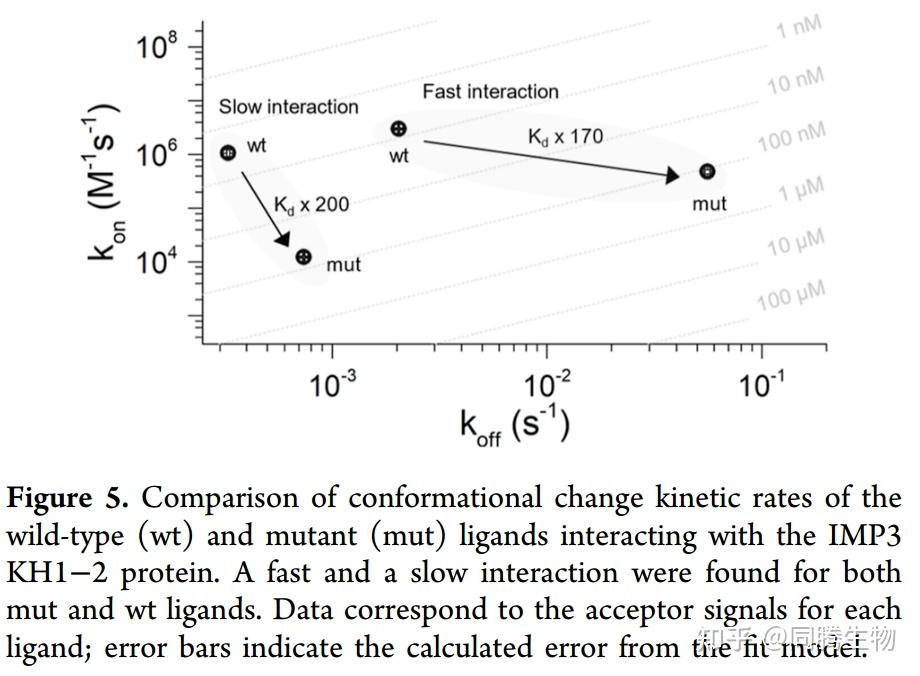
以上结果表明每种配体确定存在两种相互作用:一种结合和解离速率更快,一种结合和解离速率更慢。对于mut 配体,与慢速相互作用相比,快速相互作用的结合速率大约快 39 倍,解离速率快 76 倍。对于 wt 配体,快速相互作用的结合速率大约比慢速相互作用快 3 倍,解离速率快 6 倍。慢速和快速相互作用之间的差异表明蛋白质结构域之间存在强协同性来执行 RNA 重塑(在本例中为 RNA 环化)。如果我们现在将 mut 配体与 wt 配体进行比较,快速和慢速相互作用的 Kd 分别增加了约 170 倍和 200 倍。关于两种配体的缓慢相互作用,wt 配体的 kon 比 mut 配体的 kon 增加了近 90 倍,这很可能反映了亲和力,因为单个 KH2 结构域遇到 (CACA/ACA) 结合基序的概率更高,因为 wt 配体中有四个基序,而 mut 配体只有一个基序。关于两种配体的快速相互作用,wt 配体的 koff 比 mut 配体的 koff 慢约 27 倍,这可能是由于 KH2 的多个基序对两个蛋白质结构域的结合具有稳定作用。总之,我们假设缓慢相互作用反映了KH2如何识别具有亲和力效应和对 RNA 结构的潜在影响的多个 RNA 基序,而快速相互作用是 KH1 与两种配体中存在的单个 RNA 结合基序相互作用的结果。由于不仅慢速相互作用(受 KH2 及其 RNA 基序多样性的影响)而且快速相互作用(源自 KH1)也受到影响,我们可以得出结论,串联配置中 KH1 和 KH2 之间存在强烈的域相互作用。如果两个 KH 域作为与 RNA 结合的单独实体,则可以预期 wt 和 mut 配体的快速相互作用保持不变,因为两者都只包含一个 KH1 的 RNA 结合基序。然而,事实并非如此,因为我们观察到快速相互作用加强了它与 wt 配体的结合,这主要是由于较慢的 koff。这归因于 KH 域对彼此的影响(协同性)。
名词缩写
FRET, Förster resonance energy transfer;
kinFRET, kinetics FRET;
trFRET, time-resolved FRET;
smFRET, single molecule FRET;
kon, association rate constant;
koff, dissociation rate constant;
Kd, equilibrium dissociation constant;
NA,nucleic acid;
KH, K homology;
FPS, fluorescence proximity sensing;
mut, mutant; wt, wild-type;
IMP3, human insulin-like growth factor 2 mRNA binding protein 3 |
|
 /3
/3 