金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
撰文 | 李玉琛
责编 | 周宇祥
编者按:如果基因可以像搭积木一样随意,你想要做些什么?别想啦,你以为CRISPR/Cas9可以让你真成为上帝啊!可你也别小瞧了CRISPR/Cas9,说的没错,它正在改变世界——让那些一直高悬于人类头顶的疾病落荒而逃。
一. CRISPR/Cas9从哪里来
生物技术的变革往往令人意想不到。继ZFN、TALENs等基因编辑技术推出以后,CRISPR/Cas9横空出世,成为了当今最主流的基因编辑系统。从科学界首次报道了CRISPR成簇回文重复序列的1987年至今已经过去三十年,而CRISPR/Cas9介导的基因编辑技术在最近的5年里才真正在生命科学领域大放异彩。特别要提到2012年两位女科学家Jennifer Doudna和Emmanuelle Charpentier首次发现了在细菌适应性免疫系统中由Cas蛋白介导的核酸内切酶作用(如图1),两人因此也获得了2015年生命科学突破奖。从那以后最新一代基因编辑技术才真正应用到生命科学的各个领域,并迅速崛起引发生物医学领域新的革命。


图1.Jennifer Doudna (左)和Emmanuelle Charpentier
二. 揭下CRISPR/Cas9的神秘面纱
CRISPR/Cas(Clustered Regularly Interspersed Short Palindromic Repeats/CRISPR associated protein)由两部分构成:规律成簇的短间隔重复(CRISPR)和CRISPR相关蛋白(Cas)总称为常间回文重复序列丛集蛋白系统。其发挥作用还需要gRNA(guide RNA)和基因序列上的PAM结构指引Cas蛋白发挥核酸内切酶作用。在基因层面CRISPR位点主要由Cas基因,前导区域,CRISPR序列构成(如图2) 。其转录出的crRNA可以靶向Cas蛋白实施切割作用。
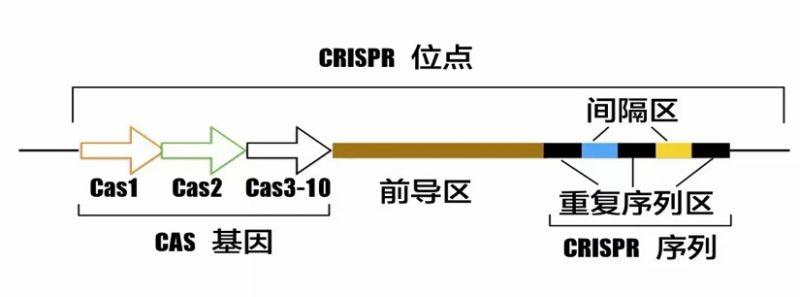
图2.CRISPR位点结构图
在与病毒的斗争中,细菌和古细菌进化出了复杂的CRISPR适应性免疫武器,这一武器可以分为三型。而二型CRISPR系统由于操作简便(只需sgRNA和Cas9蛋白)、效率高而被广泛应用。三种类型的CRISPR系统尽管有所不同,但都是通过三个主要过程完成其功能:
1.外源非宿主DNA的采集
病毒噬菌体等短片段DNA(protospacers)可作为原间隔序列插入到宿主CRISPR位点中,由相应的重复序列隔开。其中protospacers两侧的PAM序列(前间隔序列临近基序)也被整合进CRISPR位点中。
2.crRNA的合成
整合后的CRISPR系统转录生成初级产物pre-crRNA,经加工后形成一组短小的crRNAs,这些crRNA都包含着外源DNA的对应序列。在二型系统中反式作用crRNA(tracrRNA)可以与crRNA形成互补结构,对crRNA的加工成熟起着重要的作用。
3.CRISPR的靶向干扰
当外源DNA再次侵入时,通过扫描外源protospacers 旁的PAM,成熟的crRNA可以指引Cas蛋白靶向互补DNA。目标序列由专门的Cas核酸内切酶切割,达到基因编辑的目的。
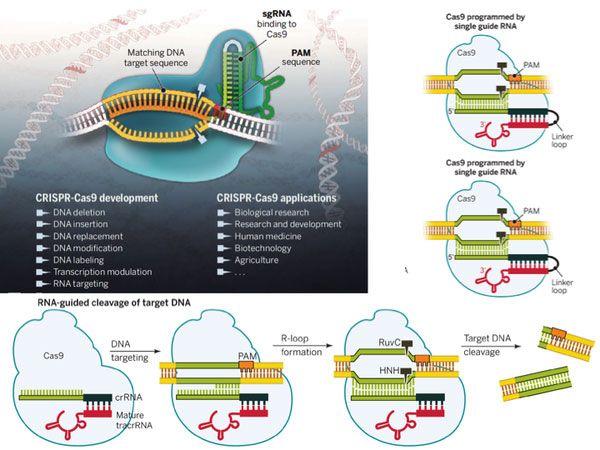
图3.CRISPR/Cas9基因编辑过程
总结一下CRISPR的原理: 细菌利用一小段RNA(gRNA)引导具有内切酶活性的蛋白(Cas9)识别并剪切外来DNA,达到降解外源DNA实现适应性免疫的目的(如图3)。在化脓性链球菌中发现的Cas蛋白(Cas9)是目前应用最广泛的Cas蛋白。上个月发表在cell上的一篇综述,详细地列举了可以用于哺乳动物细胞基因组编辑的多种Cas9酶(如图4)。
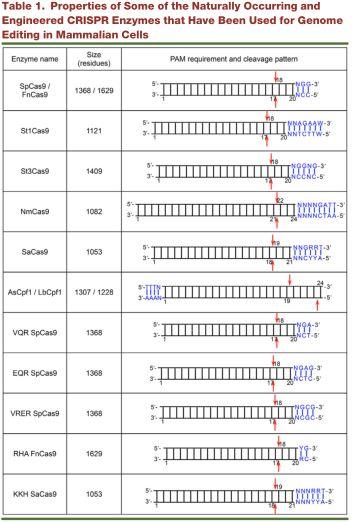
图4.多种可用于哺乳动物细胞基因编辑的酶
CRISPR/Cas9对靶片段进行剪切后产生基因片段的缺失。此时,细胞内的修复系统就会被激活。下面是见证奇迹的时刻(如图5),修复系统可以进行同源介导修复(HDR)或者非同源末端连接(HEJ)。利用HDR这一途径可以替换活细胞中部分基因组(knock in),这似乎就是人类梦寐以求的。当然要想实现这一基因编辑策略,外源的DNA必须与靶DNA有较高的同源性。而当非同源末端连接(NHEJ)发生在双链切除的位置,双链切除部位会进行随机插入或缺失。
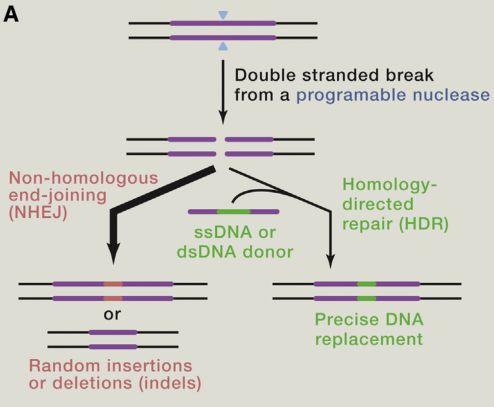
图5.基因的修复系统
虽然CRISPR/Cas9有着高效的基因编辑能力,但如何控制其对基因组的修改以及减少编辑过程中不良事件的发生,是该项技术需要完善和突破的地方。最新研究表明自然界中存在Cas9的抑制,科学家们找到了特异性抑制脑膜炎奈瑟菌CRISPR/Cas9系统的抑制性蛋白。这些anti-CRISPR可作为真核细胞基因编辑的有效抑制剂(如图6)。
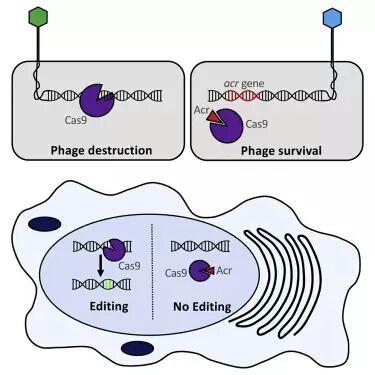
图6.Anti-CRISPR的抑制作用
除此之外科学家们还创造了一种更为高效可控的CRISPR基因组编辑平台——sOPTiKO(如图7)。可以对发育过程中的细胞实施knock out以及konck down,从而观察任何发育阶段基因的沉默和关闭。
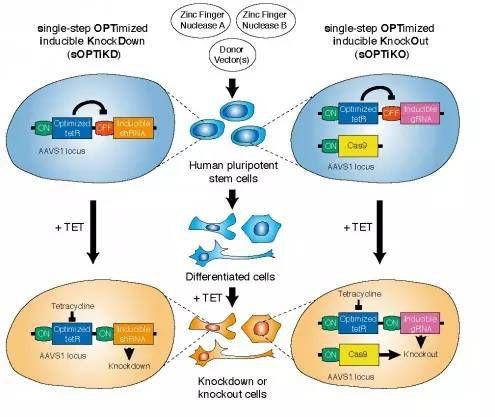
图7.sOPTiKO&sOPTiKD系统
年轻华裔科学家张峰(想膜男神的伙伴可以自行去Google scholar搜索)课题组的最新的一项研究中,研究者发现了一种依赖于sgRNA介导的ssRNA编辑系统(LshC2c2)(如图8)。和以往的靶向DNA的编辑系统完全不同,此种基于CRISPR 的RNA靶向技术可以仅仅在RNA层面调控基因的表达,而对细胞基因组很“温柔”,并不造成永久性“伤害”。这也为RNA的研究尤其是非编码RNA的研究提供了重要的突破口(Abudayyeh et al., 2016)。
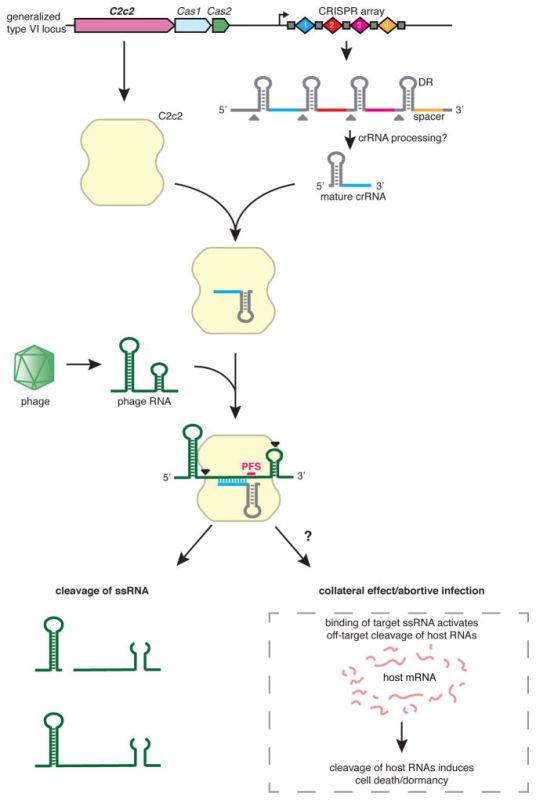
图8.LshC2c2编辑系统
另外该课题组还在土拉热弗朗西斯菌中发现了一种Cas9酶的潜在替代者Cpf-1。不需要核酸核酶也不需要tracrRNA ,该酶就可以以一人之力对pre-crRNA进行加工。更为重要的是其可以对DNA和RNA进行双重切割,还可以同时编辑多种靶点。毫无疑问,Cpf-1这个新人有望成为替代Cas9的一种新型切割工具酶(Zetsche et al., 2016)。
三.CRISPR/Cas9到哪里去
随着该项技术的发展,以CRISPR/Cas9为基础的基因编辑技术在基因治疗相关领域展示出极大的潜力,如恶性肿瘤、艾滋病以及其他多种遗传性疾病的基因治疗。下面总结基于CRISPR技术实施基因治疗的最新研究进展。
1. 肺癌还会是死亡的代名词吗?

中国华西医学院研究团队从患者血液中分离出免疫细胞,然后利用CRISPR技术敲除PD-1蛋白基因,此蛋白可降低免疫系统对肿瘤细胞的杀伤作用。让PD-1失去功能从而增强免疫系统对肿瘤的抵抗能力。目前该项试验是否有效果还有待观察(Cyranoski, 2016)。
2. 细胞的命运我做主
早在2006年日本京都大学医学院山中伸弥教授就发现成年或胚胎小鼠成纤维细胞可以经转化产生能够分化为任何一种细胞类型的干细胞(IPS细胞)。这也使得他在短短六年之后获得诺贝尔奖。
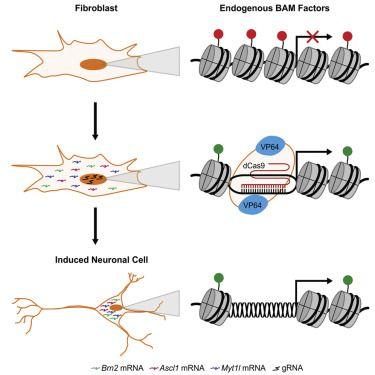
图9.成纤维细胞转化为诱导神经元细胞
最新的一项研究中,科学家运用dCas9介导的转录激活因子对特定基因组实施了表观遗传学修饰。经过修饰,成纤维细胞内可表达特定细胞的转录拷贝得到激活,近而将小鼠成纤维细胞转化为神经元细胞(如图9)(Black et al., 2016)。
3. 哪怕是一个碱基我也能改过来
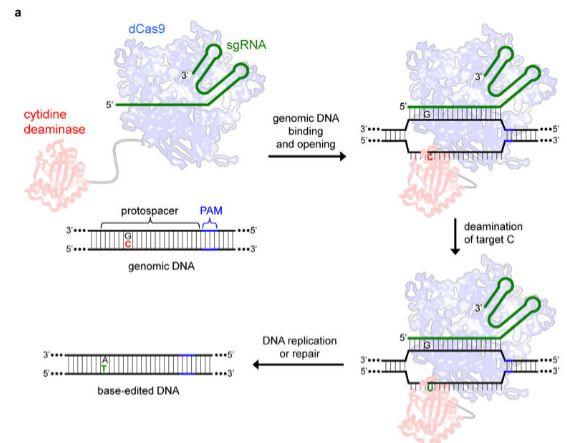
图10.CRISPR/Cas9应用于单碱基修复
人体的大多数遗传病本质上都是由于碱基的置换和突变导致的,而之前的基因编辑技术却不能对这些点突变进行高效的校正。最新的一项研究中,研究人员将胞嘧啶脱氨基酶与dCas9联结形成一种新型碱基编辑系统(如图10)。在小鼠和人细胞系中,运用此种方法可以将胞嘧啶转变为尿嘧啶,并有可观的有效率和低错误发生率。可以说,此项研究为治疗单碱基遗传病提供了广阔的前景。(Komor et al., 2016)。
4. HIV你别跑啊
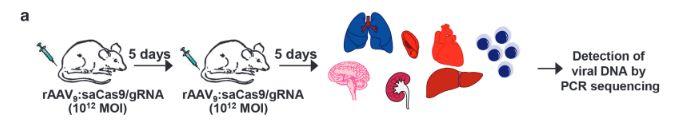
图11.HIV病毒DNA切除实验过程
HIV作为一种逆转录病毒,可以将其自身的RNA逆转录为DNA并插入到宿主细胞基因组以扩增新的遗传物质和病毒。他总是和我们的CD4+T细胞很是亲近,在茫茫人海寻找他的爱人,爱深了,就想着带她殉情,哈哈,可是我们的免疫系统就倒霉了。当敌人群起而攻,免疫系统人员不足,招架不住,生命随之消逝。不用担心,最新的一项研究中,研究人员利用CRISPR技术在小鼠细胞基因组中成功切除一段HIV-1 DNA序列,并且这种切除效应可在多种组织内存在(如图11)。这一研究成果可以让我们直面HIV病毒复制的源头—记忆T细胞基因组上的HIV DNA片段——然后狠狠得来上一拳。我们不难想象,此项技术若能联合使用抗逆转录病毒药物,必将给艾滋病的治疗带来颠覆性的改变,或许某一天我们可以对艾滋病say goodby啦。(Kaminski et al., 2016)。
5.猪和人类将更加亲密
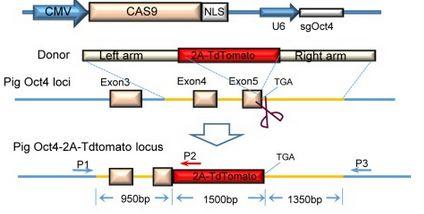
图12.Oct4-td- tomato导入示意
我们都知道转录因子Oct4在维持细胞干性中发挥重要作用,但是我们如何知道细胞是否已经表达了Oct4?研究人员通过CRISPR/Cas9介导的基因敲入技术,制备了携带有Oct4-td tomato的报告基因敲入猪。在目标位点2A-td-Tomato取代了Oct4的终止密码子(如图12),所以荧光能够准确反应Oct4基因的表达情况。老师再也不用担心我们的细胞没有表达Oct4了。(Lai et al., 2016)。

对于实施猪器官移植目前面临的主要问题,是如何减少免疫排斥反应以及猪供体器官内源性免疫病毒(PERV)的产生。最新一项研究中,科研工作者们利用CRISPR技术让猪胚胎中的62个猪内源性免疫病毒基因陷入永久的沉睡,从而使猪供体器官(心脏瓣膜,肝脏)在人体中的移植提供了可能性(Yang et al., 2015)。
7. 给艰难梭君的逐客令

艰难梭君可是医院感染的的头号危险分子。这位臭名昭著的罪犯可以在住院患者体内长期非法定居,一有机会就想搞个大新闻——致死性的腹泻和肠道炎症。来自波士顿儿童医院的研究小组通过CRISPR技术在体外培养的人体细胞引入突变,并进行全基因组筛选,发现编码Frizzled受体的基因被删除时,肠道器官会对艰难梭菌毒素产生抗性,之后的动物实验同样也获得阳性结果。原来罪犯是这样入侵的,我们人类可不会再给你机会啦。(Tao et al., 2016)。
后记:目前,CRISPR/Cas9已经成为科研人员研究生命系统和人类疾病的强有力工具。我们有充分的理由相信,在不远的将来,新的CRISPR系统可以有效治疗人类的遗传疾病。剑有双刃技术也一样,像CRISPR/Cas9这种可以编辑基因的技术已经不能用危险来形容。我们人类在挥剑杀敌的时候,一定要时刻警惕潜在的危机,完善相关法律法规应该是当务之急。
References
[1]. Abudayyeh, O.O., et al., C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science, 2016. 353(6299): p. aaf5573.
[2]. Zetsche, B., et al., Multiplex gene editing by CRISPR-Cpf1 using a single crRNA array. Nat Biotechnol, 2016.
[3]. Cyranoski, D., CRISPR gene-editing tested in a person for the first time. Nature, 2016. 539(7630): p. 479.
[4]. Black, J.B., et al., Targeted Epigenetic Remodeling of Endogenous Loci by CRISPR/Cas9-Based Transcriptional Activators Directly Converts Fibroblasts to Neuronal Cells. Cell Stem Cell, 2016. 19(3): p. 406-14.
[5]. Komor, A.C., et al., Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature, 2016. 533(7603): p. 420-4.
[6]. Kaminski, R., et al., Excision of HIV-1 DNA by gene editing: a proof-of-concept in vivo study. Gene Ther, 2016. 23(8-9): p. 690-5.
[7]. Lai, S., et al., Generation of Knock-In Pigs Carrying Oct4-tdTomato Reporter through CRISPR/Cas9-Mediated Genome Engineering. PLoS One, 2016. 11(1): p. e0146562.
[8]. Tao, L., et al. Frizzled proteins are colonic epithelial receptors for C. difficile toxin B. NATURE,2016. 538, 350-355.
原文地址:https://zhuanlan.zhihu.com/p/24453623 |
|
 /3
/3 