金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
参考书籍 ——《现代分子生物学·第5版》(朱玉贤)
绪论
分子生物学是研究核酸、蛋白质等所有生物大分子的形态、结构特征及其重要性、规律性和相互关系的科学,是人类从分子水平上真正揭开生物世界的奥秘,由被动地适应自然界转向主动地改造和重组自然界的基础学科。
分子生物学研究的终极目标是要在分子水平上阐明各种生命活动的规律,揭示生命的本质。
历史事件
- 1859年——达尔文(英国)——发表《物种起源》——确立了进化论的概念。
- 17世纪末——安东尼·列文虎克(荷兰)——制作第一架光学显微镜。
- 17世纪末——罗伯特·胡克(英国)——引入“细胞”这一概念。
- 十九世纪末——施莱登(德国植物学家)施旺(德国动物学家)——推动细胞学说。
- 十九世纪末——孟德尔(奥地利)——提出遗传学定律。
- 二十世纪初——摩尔根(美国)——实验证明了“基因学说”
- 1928年——格里菲斯(英国)——肺炎双球菌转化实验。埃弗里(美国)——实验证明基因是DNA分子。
- 1936年——萨姆纳(美国)——证明酶是蛋白质。
- 1952年——赫希(美国)蔡司(美国)——噬菌体侵染实验。
- 1953年——沃森(美国)克里克(英国)威尔金斯(英国)富兰克林(英国)——发现DNA双螺旋结构。
- 1953年——桑格(英国)——纸层析技术阐明胰岛素一级结构,开创了蛋白质序列分析的先河。
- 1954年——克里克(英国)——提出中心法则。
- 1958年——梅赛尔森(美国)斯塔尔(美国)——证明了DNA半保留复制。
- 1968年——尼伦伯格(美国)——破译遗传密码。
- 1980年——桑格(英国)——设计一代DNA测序法(双脱氧核苷酸测序)。
- 1983年——麦克林托克(美国)——发现转座基因(jumping gene)。
- 1989年——奥特曼(美国)切赫(美国)——发现核酶。
- 1997年——布鲁希纳(美国)——发现朊病毒。
- 2000年——布莱克本(澳大利亚)——揭示端粒和端粒酶机制。
分子生物学的三条基本原理:
- 构成生物体各类有机大分子的单体在不同生物中都是相同的。
- 生物体内一切有机大分子的构成都遵循共同的规则。
- 某一特定生物体所拥有的核酸及蛋白质分子决定了它的属性。
现代分子生物学主要包括如下四个方面的研究:
- 重组DNA技术(基因工程)
- 基因表达调控研究
- 生物大分子的结构功能研究(结构生物学)
- 基因组、功能基因组与生物信息学研究重组DNA技术(基因工程)
- 将不同的DNA片段按照人们的设计定向连接起来,在特定的受体细胞中与载体同时复制并得到表达,产生影响受体细胞的新的遗传性状。
- 重组DNA技术可用于定向改造某些生物的基因组结构,使它们所具备的特殊经济价值或功能得以成百上千倍地提高。
基因表达调控研究
- 基因表达调控实质上是遗传信息的转录和翻译。
- 在个体生长发育过程中生物遗传信息的表达按一定的时序发生变化(时序调节),并随着内外环境的变化而不断加以改正(环境调控)。
- 原核生物的基因组染色体结构简单,转录和翻译在同一时间和空间内发生,基因表达调控主要发生在转录水平。
- 真核生物有细胞核结构,转录和翻译过程在时间和空间上被分割开,且在转录和翻译后都有复杂的信息加工过程,其基因表达的调控可以发生在各种不同的水平上。
- 基因表达调控主要表现在信号转导研究、转录因子研究及RNA剪辑三个方面。
- 信号转导:外部信号通过细胞膜上的受体蛋白传到细胞内部,并激发诸如离子通透性、细胞形状或其他细胞功能方面的应答过程。
- 转录因子:一群能与基因5‘端上游特定序列专一结合,从而保证目的基因以特定的强度在特定的时间与空间表达的蛋白质分子。
- RNA的可变剪接:pre-mRNA会以多种方式进行剪接重连,由此产生不同的mRNA。因此一个基因可以编码多种蛋白质
染色体与DNA
染色体
遗传物质概述
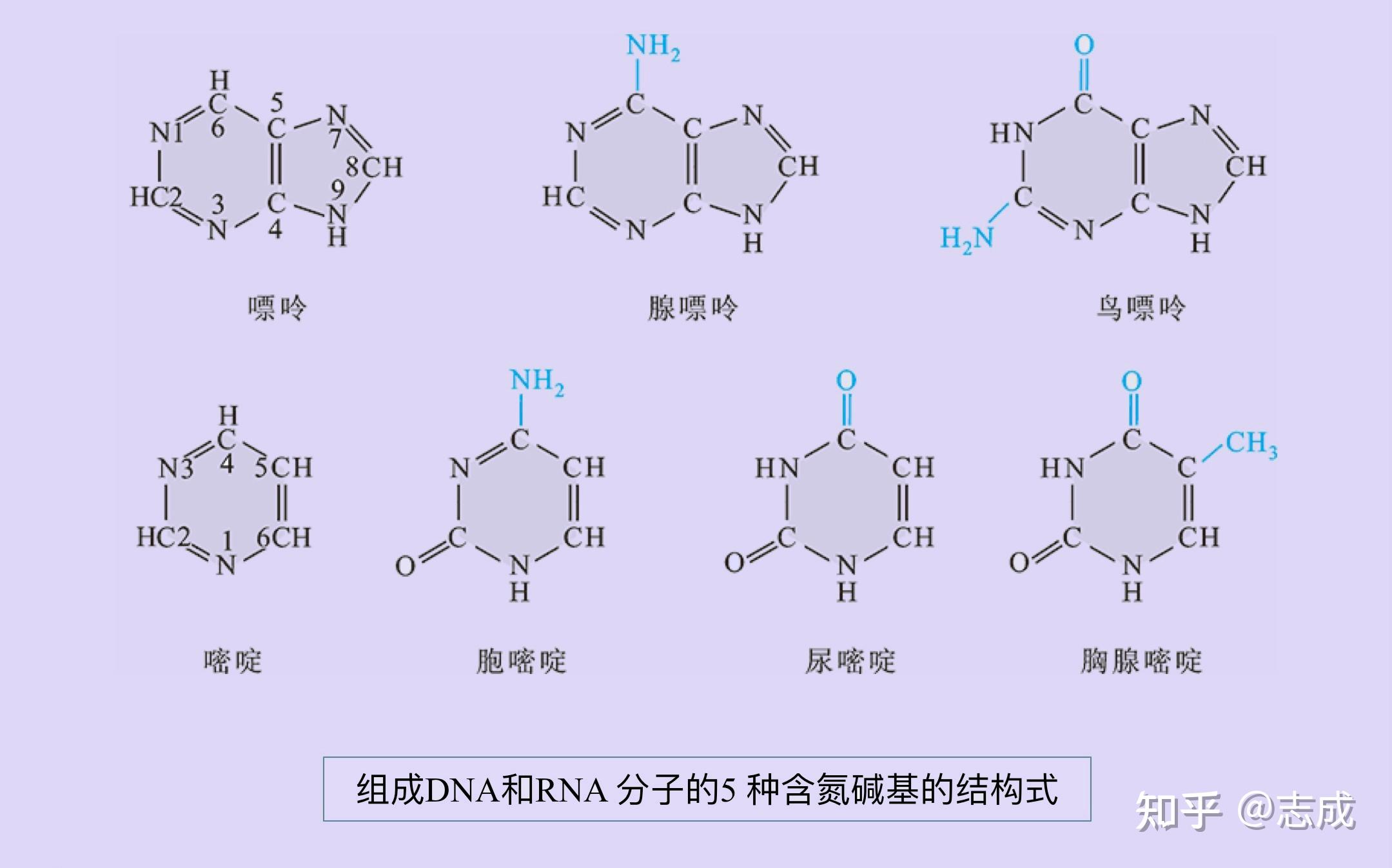
- 核酸(DNA和RNA)控制了生物的遗传性状。
- 核酸以核苷酸(nucleotide)为基本结构单位,由单核苷酸通过3’,5’-磷酸二酯键连接成链状大分子。
- 核苷酸可以进一步分解成核苷和磷酸,核苷再进一步分解成核糖和碱基(base)。
- 组合DNA分子的碱基:A(腺嘌呤),T(胸腺嘧啶),C(胞嘧啶),G(鸟嘌呤)
- 组成RNA分子的碱基:A,U(尿嘧啶),C,G
染色体概述
- 染色体在遗传上起着主要作用。遗传物质的主要载体是染色体。
- 染色体包括DNA和蛋白质两部分。DNA只有包装成为染色体才能保证其稳定性。
- 同一物种每条染色体所带DNA量不一定,单不同染色体或者不同物种之间变化很大。染色质(chromatin):是细胞中期核内DNA和蛋白质复合体。个别染色体不能区分开。它只能通过与DNA特异性作用的染料而识别。
染色单体(chromatids):复制时产生的染色体拷贝。次名字通常用来形容随后的细胞分裂期它们分开的之前的染色体。
原核生物DNA的主要特征
- 细菌DNA是一条相对分子质量在109左右的闭合双链分子,通常也称为染色体。
- 原核生物中一般只有一条染色体且大都带有单拷贝基因,只有很少数基因如(如rRNA基因)以多拷贝形式存在。
- 整个染色体DNA几乎全部由功能基因与调控序列所组成
- 几乎每个基因序列都与它所编码的蛋白质序列呈线性对应状态
- 细菌染色体外包裹着稀疏的蛋白质,这些蛋白质有些与DNA折叠有关,另一些则参与DNA的复制,重组及转录过程
真核生物染色体特征
- 分子结构相对稳定
- 能够自我复制,使亲子代之间保持连续性
- 能够指导蛋白质的合成,从而控制整个生命过程
- 能够产生遗传的变异
组蛋白
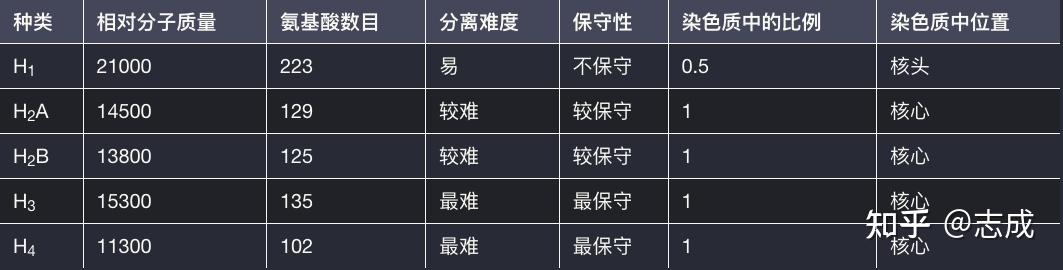
- 组蛋白是染色体的结构蛋白它与DNA组成核小体。通常可以用2mol/L或0.25mol/L的HCl/H2SO4处理组蛋白与DNA分开,然后用离子交换柱层析分离。
- 根据其凝胶电泳性质可以把组蛋白分为H1、H2A、H2B、H3、及H4
组蛋白都含有大量的精氨酸和赖氨酸,H1富含赖氨酸,H3、H4富含精氨酸,H2A、H2B介于两者之间
组蛋白的一般特性
- 进化上的保守性,不同种生物组蛋白的氨基酸组成十分相似
- 无组织特异性
- 肽链上氨基酸分布不对称性。碱性氨基酸集中分布在N端端半条链上。碱性的半条链易与DNA的负电荷区结合而另外半条链与其他组蛋白、非组蛋白结合。
- 组蛋白的修饰作用。由于组蛋白富含精氨酸核赖氨酸,可以发生包括甲基化等多种翻译后修饰。
- 在几种修饰中以 H3、H4的修饰作用比较普遍,并且以甲基化、乙酰化修饰为主,H2A、H2B能发生泛素化和乙酰化修饰,H1有泛素化和磷酸化修饰。
组蛋白的修饰作用
- 包括甲基化、乙酰化、磷酸化、及ADP核糖基化等
- 组蛋白甲基化是由蛋白甲基转移酶去甲基化催化的可逆修饰。甲基化可发生在组蛋白的赖氨酸和精氨酸残基上
- 组蛋白乙酰化主要发生在核心组蛋白上,在含有活性基因的DNA结构域中,乙酰化程度更高,H3,H4乙酰化程度大于H2A和H2B。乙酰化的主要位点分布在H3、H4的N端比较保守的赖氨酸位置上。乙酰化修饰由组蛋白乙酰基转移酶和组蛋白去乙酰化酶协调进行,以保证乙酰化水平的动态平衡。
- 乙酰化/去乙酰化修饰影响染色质结构和基因活化,组蛋白的乙酰化有利于DNA与组蛋白八聚体的解离,使核小体结构松弛,从而使各种转录因子和协调转录因子能与DNA结合位点特异性结合,激活基因的转录;反之,去乙酰化则抑制转录。
- 组蛋白的泛素化修饰位点为高度保守的氨基酸残基,组蛋白H1、H2A、H2B、和H3都能发生泛素化修饰。与经典的蛋白质泛素调节途径不同,组蛋白的泛素化修饰不会导致蛋白质的降解,却能招募核小体形成染色体,并参与X染色体的失活,影响组蛋白的甲基化和基因的转录,也在DNA损伤应答等生理过程中发挥重要作用。
- 修饰作用只发生在细胞周期的特点时间和组蛋白的特定位点
- 组蛋白H1、H2A、H2B、及H3能够和多聚ADP-核糖共价结合发生ADP核糖基化修饰,被认为是在真核细胞内启动复制过程的开关
- 作用:使DNA与蛋白之间的作用强度发生变化,进而使DNA与转录因子之间的相互作用发生变化,进而使使DNA与转录因子接触难易程度改变,影响转录作用的速率。
非组蛋白
- 包括酶类、与细胞分裂有关的收缩蛋白、骨架蛋白、核孔复合物蛋白以及肌动蛋白、肌球蛋白、微管蛋白、原肌蛋白等,它们也可能是染色质的结构成分。
- 高速泳动蛋白(HMG)
- 因其相对分子质量小、在凝胶电泳中迁移速度快而得名
- 能与DNA结合,也能与H1作用,但与DNA的结合并不牢固,可能与DNA的超螺旋结构有关,在DNA复制中和重组中起重要作用
- DNA结合蛋白
- 是一种能优先与DNA结合,并使其扭曲的高速移动性群蛋白。这类蛋白质可以改变核小体排列方式,产生更复杂的染色质结构。
- 可能是一些与DNA的复制或转录有关的酶或调节物质
- 非组蛋白的功能
- 酶(RNA合成酶、蛋白质磷酸化酶等)
- 遗传信息的保持和调节(HMG14,HMG17及许多酸性染色体蛋白质)
- 染色体的结构支持体
真核生物基因组DNA
- 真核细胞基因组中含有大量的重复序列,而且功能DNA序列大多被不编码蛋白质的非功能DNA所隔开
- 生物体内所有的染色体组成基因组,每Mb基因组DNA上所含有的平均基因数目称为基因密度
- 一种生物单倍染色体中DNA的总长度称为基因组大小。基因组的大小与生物体的复杂性相关
- 在真核生物中,基因组的大小一般是随生物进化而增加的,高等生物基因组的大小一般大于低等生物
- 基因密度是复杂度相近但基因组的大小迥异的物种之间的主要区别。基因密度越高,生物的复杂性越低。
- 与原核生物相比,真核生物不但基因密度低,而且各种变异相对较多。
- 对于复杂度高的生物,调控转录的序列长度显著增长,分散在真核生物中编码蛋白质的基因区段中的内含子的数目也大量增加
- 真核生物DNA序列大致上可分为三类:
- 不重复序列:一般只有一个或几个拷贝,占总DNA的40~80%。结构基因基本上属于不重复序列
- 中度重复序列:这类序列的重复次数在101~104之间,占总DNA的10~40%,各种rRNA、tRNA以及某些结构基因如组蛋白基因等都属于这一类
- 高度重复序列(卫星DNA):只在真核生物中发现,占基因组的10~60%,在DNA链上重复成千上万次。卫星DNA不转录,功能不明。
染色质
- 由DNA和组蛋白组成的染色质纤维细丝,是许多核小体连成的念珠状结构
- 染色质DNA的Tm值比自由DNA高,说明在染色质中DNA极可能与蛋白质分子相互作用
- 在染色质状态下,由DNA聚合酶和RNA聚合酶催化的DNA复制转录活性大大低于在自由DNA中的反应
- DNA酶1对染色质DNA的对消化远远慢于对纯DNA的作用
核小体
- 核小体是由H2A、H2B、H3、H4各两个分子生成的八聚体和由大约200bpDNA组成
- H3·H4四聚体的形成启动核小体的组装,四聚体然后与DNA结合,再与两个H2A·H2B二聚体结合,完成核小体的组装
- 八聚体在中间,DNA分子盘绕在外。而H1在核小体外面,且每个核小体只有1个H1
- 核小体中组蛋白和DNA的比例是每200bp DNA有H2A、H2B、H3、H4各两个,H1一个。缠绕在核小体上的DNA共146bp,缠绕1.65圈每圈80bp。核小体之间连接DNA的长度是可变的,一般为20~60bp
- 每个核心组蛋白有一个N端延伸的“尾巴”,上面有许多高度修饰的位点
- 核小体的形成是染色体中DNA压缩的第一个阶段
- 组蛋白H1通过与结合在核小体上的DNA结合使染色质进一步压缩,形成30nm螺线管
真核生物基因组的结构特点
- 真核基因组庞大,一般都远大于原核生物
- 真核基因组存在大量的重复序列
- 真核基因组的大部分为非编码序列,占整个基因组序列的90%以上,该特点是真核生物与细菌和病毒之间最主要的区别
- 真核基因组的转录产物为单顺反子
- 真核基因是断裂基因,很有内含子结构
- 真核基因组存在大量的顺式作用元件.包括启动子、增强子、沉默子等
- 真核基因组中存在大量的DNA多态性
- 多态性是指DNA序列中发生变异而导致的个体核苷酸序列的差异,主要包括单核苷酸多态性(single nucleotide polymorphism , SNP)和串联重复序列多态性(tandem repeats polymorphism)两类
- 真核基因组有端粒结构
- 端粒(telomere)是真核生物线性基因组DNA末端的一种特殊结构,它是一段DNA序列和蛋白质形成的复合体,其DNA序列相当保守,一般有多个短寡核苷酸串联在一起构成
- 具有保护线性DNA的完整复制、保护染色体末端和决定细胞的寿命等功能
原核生物基因组
- 原核生物基因组很小,大多只有一条染色体,且DNA含量少
- 此外,细菌的质粒、真核生物的线粒体、高等植物的叶绿体等也含有DNA和功能基因,这些DNA被称为染色体外遗传因子,也具有原核生物基因组的特点
- 原核细胞基因组DNA的结构特点:
- 结构简练 :
- 原核DNA分子的绝大部分是用来编码蛋白质的,只有非常小的一部分不转录,这与真核DNA的冗余现象不同。不转录DNA序列通常是控制基因表达的标签
- 存在转录单元 :
- 原核生物DNA序列中功能相关的RNA和蛋白质基因,往往丛集在基因组的一个或几个特定部位,形成功能单位或转录单元,它们可被一起转录为含多个mRNA的分子,称为多顺反子mRNA
- 有重叠基因 :
- 在一些细菌和动物病毒中有重叠基因,即同一段DNA能携带两种不同蛋白质信息
- 尽管这些重叠基因的DNA序列大致相同,但由于基因重叠部位一个碱基的变化可能影响后续肽链的全部序列,从而编码完全不同的蛋白质
DNA的复制
DNA复制的基本概念
- 半保留复制
- 半不连续复制,冈崎片段长度在1000~2000碱基
- 复制子: 生物体能独立进行复制的单位
- 复制叉: 复制时,双链DNA要解开成两股链分别进行,所以,这个复制起始点呈现叉子的形式
- 复制子: 从复制起点到终点的区域
- 一个复制子只含一个复制起点
- 复制叉从复制起点开始沿着DNA链连续移动,起始点可以启动单向复制或者双向复制,这主要取决于在复制起点形成一个复制叉还是两个复制叉
- 细菌、酵母、线粒体、叶绿体中的复制起始点的共同特点是都有丰富的AT序列
- 细菌、病毒和线粒体DNA分子都是作为单个复制子完成复制的,而真核生物基因组可以同时在多个复制起点上进行双向复制
- 复制终止点: 复制子中控制复制终止的位点,如大肠杆菌环状DNA中,复制终止点在起始点的相对位置(旋转180度)
- 某些环状DNA进行单向复制, 但主要还是双向复制
- 细菌复制速度比真核生物快2-~50倍
- 解旋:首先在拓扑异构酶的作用下解开负超螺旋,再由SSB蛋白(单链结合蛋白)在复制起点处解开单链,接着由引发酶等组成的引发体迅速作用于两条单链DNA上
- DNA解链酶(DNA helicase):DNA解链酶能通过水解ATP获得能量来解开双链DNA
- 单链结合蛋白(SSB蛋白):保证被解链酶解开的单链在复制完成前能保持单链结构
- DNA拓扑异构酶(DNA topoisomerase):消除解链造成的正超螺旋堆积
- 所有DNA复制都是从一个固定起始点开始的,而且所有DNA聚合酶都只能延长已存在的DNA链,不能从头合成。因此在复制时往往由引发酶(一种特殊的RNA聚合酶,不需要用特异性DNA序列来起始新RNA引物的合成)在DNA模版上合成一段RNA链,提供引发末端(引物),接着由DNA聚合酶从RNA引物3’端开始合成新的DNA链
- 后随链的引发由引发体完成,引发体由6种蛋白质(n',n'',n''',DnaB,DnaC,DnaI)共同组成
DNA聚合酶
- DNA聚合酶有延伸作用
- DNA聚合酶有三个结构域
- Mg2+和Zn2+有利于改变催化区域周围的化学环境,促进催化作用的进行
- DNA聚合酶有矫正错配的能力
后随链合成
- 引物酶合成约10个核苷酸大小的引物,两个引物间的距离在细菌中为1000~2000bp,在真核细胞中为100~400bp
- DNA聚合酶3以5‘->3‘方向延伸该引物,直到遇见相邻引物的5’端。这个新合成的DNA片段就是冈崎片段
- 在E.coli中,DNA聚合酶1具有5‘->3‘外切酶活性,被用来去除引物
- DNA连接酶连接相邻的冈崎片段使之成为一条完整的链
原核生物和真核生物DNA复制
原核生物DNA复制的特点
大肠杆菌基因组以环状DNA分子形式存在
大肠杆菌DNA聚合酶比较
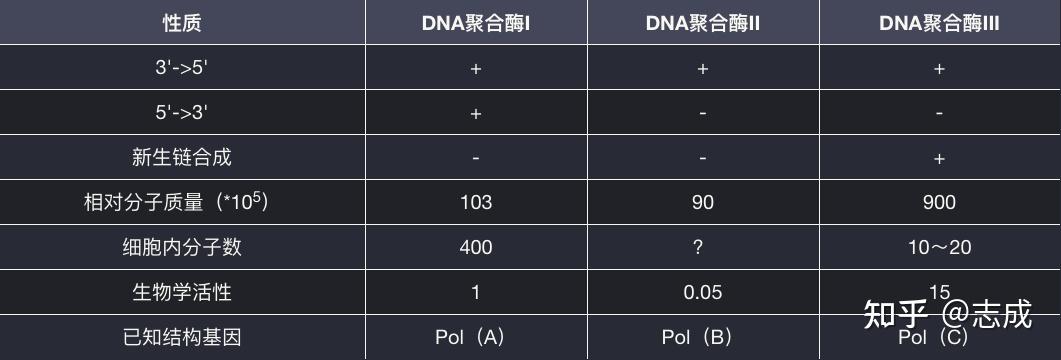
- DNA聚合酶I:第一个被鉴定出来的DNA聚合酶
- 不是复制大肠杆菌染色体的主要聚合酶
- 既可以合成DNA链,又能降解DNA保证了DNA复制的准确性
- 具有5'->3'核酸外切酶的活性活性
- DNA聚合酶II:
- 具有5'->3'方向的聚合酶活性
- 具有3'->5'核算外切酶活性可起矫正作用
- 生理功能主要是起修复DNA的作用
- DNA聚合酶III:
- 既有5'->3'聚合酶活性,又有3'->5'核酸外切酶活性
- 是大肠杆菌DNA复制中链演出反应的主导聚合酶原核生物DNA复制的调控
- 迅速分裂的细胞具较多复制叉,而分裂缓慢的细胞复制叉较少并出现复制的间隙
- 细胞内复制叉的多少决定复制起始频率的高低,这可能是原核细胞复制的调控机制
- 复制起始频率的直接调控因子是蛋白质和RNA
- DNA复制的调控主要发生在起始阶段,一旦开始复制,如果没有意外的阻力,就可以一直复制下去直到完成
真核生物DNA复制的特点
- 真核生物有多处复制起始点,原核生物只有一个
- 真核生物的染色体在全部完成复制之前,各个起点上DNA的复制不能再开始;原核生物可以连续开始新的复制,表现为虽只有一个复制单元但可有多个复制叉
- 真核生物每个细胞周期只精确地复制一次,且只在S期进行
- 真核细胞复制的起始需要在复制复合体pre-PC的指导下进行
- 酵母的复制起始点称为自主复制序列(ARS)
- 对指导复制起始的序列进行识别发生在G1期
- 真核生物DNA复制的起始需要起始点识别复合物(ORC)
- 只有在细胞从G1到达S期后,由于调控pre-RC的两种激酶Cdk和Ddk在S期被激活,pre-RC被磷酸化后诱发起始点上其他复制蛋白的组装和复制的起始
真核生物DNA聚合酶
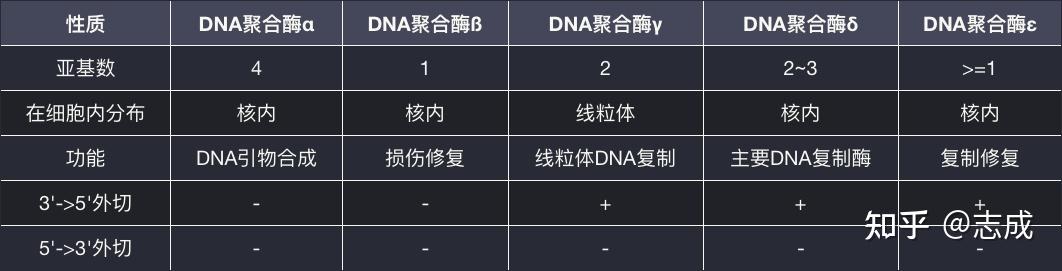
冈崎片段RNA引物去除
- 一种可以切除DNA- RNA杂合底物的RNA酶H1发挥内切核酸酶的活性,在靠近RNA与DNA的连接处切开引物
- 由具备5'->3'外切核酸酶活性的FEN1蛋白降解RNA片段
- 由DNA连接酶I将相邻的冈崎片段连接起来
DNA末端复制
由于所有新的DNA合成启动都需要一条引物,这使线性染色体末端的复制成为难题,当后随链到达染色体末端时,引物酶可能没有足够的空间去合成新的RNA引物,导致后随链DNA产物上3'端形成一小段单链DNA。在下一轮复制中,这个区域将被丢失,两个产物中的一个会因此逐步变短(端粒部分)
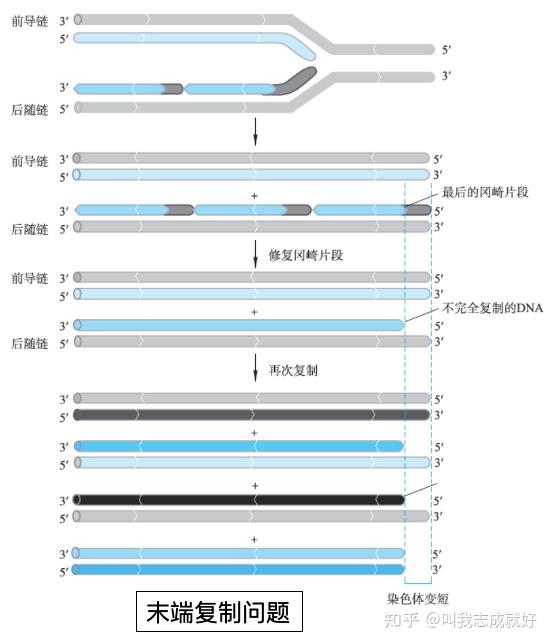
细胞解决末端复制问题的方法
- 用蛋白质代替RNA作为每个染色体末端最后一个冈崎片段的引物
- 多数真核生物利用端粒酶来延伸染色体3'端
- 端粒酶由蛋白质和RNA组成,端粒酶利用其自身含有的RNA成分作为模版将端粒序列添加到染色体3'端
DNA的突变与修复
复制错误和DNA损伤有两个后果:
- 基因突变:DNA产生永久性不可逆的改变,最终改变基因的编码序列
- 包括碱基替换、转换、颠换、插入突变、同义突变、错译突变、无意义突变、移码突变等
- DNA发生化学变化使得DNA不能再被用作模版进行复制和转录
DNA突变
- 基因突变:在基因内的遗传物质发生可遗传到结构和数量的变化
- DNA突变:DNA复制过程出现的错误、遗传物质的化学和物理损伤,以及转座子插入所造成的DNA序列变化
DNA修复系统
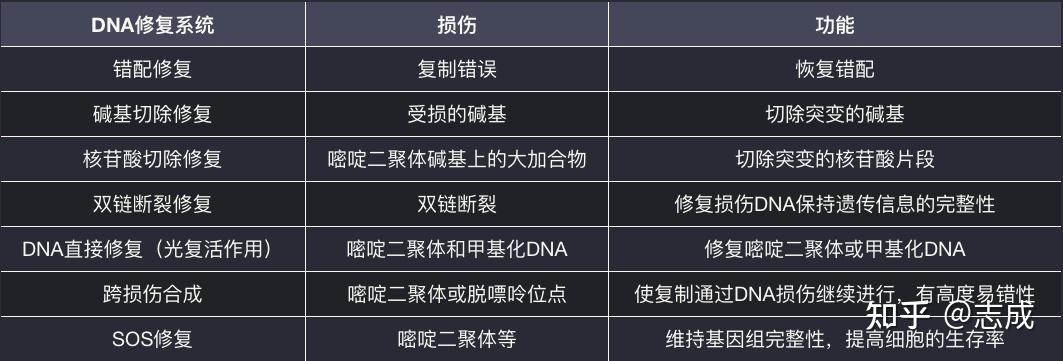
- 发现碱基错配
- 在水解ATP作用下,MutS、MutL与碱基错配位点的DNA双链相结合
- Muts- MutL在DNA双链上移动,发现甲基化DNA后由MutH切开非甲基化的子链
- 碱基起初修复:糖苷水解酶能特异性切除受损核苷酸上的N-ß糖苷键,在DNA链上形成去嘌呤位点,统称AP位点。一旦形成AP位点,AP核酸内切酶就会把受损核苷酸的糖苷-磷酸链切开,移去包括AP位点在内的小片DNA,由DNA聚合酶I合成新的片段
- 核苷酸切除修复:当DNA链上相应位置的核苷酸发生损伤皮,导致双链之间无法形成氢键,则由核苷酸切除修复系统负责修复
- 同源重组修复:是利用细胞内的同源染色体对应的DNA序列作为修复模版进行DNA修复的过程
- 直接修复:把损伤的碱基回复到原来的状态的一种修复。如DNA光解酶修复胸腺嘧啶聚二体及6-4光化物的过程
- 嘧啶二聚体(PD):是DNA或RNA中相邻碱基(嘧啶)在紫外线诱导下进行光化学合成,于C=C双键形成共价键而形成的一种化合物,它们改变了DNA原有结构,令聚合酶无法正常运作,DNA无法复制
- SOS修复系统:细胞DNA受到损伤或复制系统受到抑制的紧急情况下,细胞为求生存而产生的一种应急措施。它是一种旁路系统,允许新生的DNA链越过胸腺嘧啶二聚体继续复制,其代价是保真度的极大降低。
- 包括:诱导DNA损伤修复,诱变效应,细胞分裂的抑制以及溶原性细菌释放噬菌体等
DNA的转座
DNA的转座(移位):由可移位因子介导的遗传物质重排现象
在转座过程,可移位因子的一个拷贝常常留在原来的位置上,在新位点上出现的仅仅是拷贝,转座有别于同源重组,它依赖于DNA的复制
转座子(transposon,Tn)是存在于染色体DNA上可自主复制和唯一的基本单位转座子分类
- 插入序列(insertional,IS)
- 最简单的转座子,是细菌的一小段可转座元件,它不含有任何宿主基因而常被称为插入序列,它们是细菌染色体或质粒DNA的正常组成部分
- 常见的IS序列都是很小的DNA片段(约1000碱基对),末端具有反向重组区,转座时往往复制宿主靶位点一小段(4~15碱基对)DNA,形成位于IS序列两端的正向重复区
- 复合型转座子
- 是一类带有某种抗药性基因(或其他宿主基因)的转座子,其两翼往往是两个相同或高度同源的IS序列(在每个IS序列两侧各有反向重复区)
真核生物中的转座子
- 玉米细胞内控制的控制因子归纳为两大类
- 自主性因子:具有自主剪接和转录的功能
- 非自主性因子:单独存在时是稳定的不能转座,当基因组中存在与非自主因子同家族的自主性因子,它才具备转座功能,成为与自主性因子相同的转座子
转座作用的遗传学效应
- 转座引起插入突变。各种IS,Tn转座子都可以引起插入突变
- 转座产生新的基因。如果转座子上带有抗药性基因,它一方面造成靶DNA序列上的插入突变,同时也使这个位点产生抗药性
- 转座产生染色体畸变,当复制型转座发生在宿主DNA原有位点附近,往往导致转座子两个拷贝之间的同源重组,引起DNA缺失或倒位
- 转座引起的生物进化,由于转座作用,使原来在染色体上相距甚远的基因组合到一起,构建成一个操纵子或表达单元,可能产生有新的生物学功能的基因和新的蛋白质分子
SNP的理论与应用
单核苷酸多态性(single nucleotide polymorphism ,SNP):指基因组DNA序列中由于单个核苷酸的突变而引起的多态性
- SNP是基因组中最简单最常见的多态性形式,具有很高的遗传稳定性
- SNP广泛存在人类基因组中,其发生频率约为1%或更高
- 位于染色体上某一区域的一组相关联的SNP等位位点称为单倍型(haplotype)
- 相邻SNPs的等位位点倾向于以一个整体遗传给后代
- SNP时继限制性片段长度多态性(RFLP)和微卫星标记(SSR)之后的第三代遗传标记
思考题
- 能自我复制,使亲子代保持连续性
- 分子结构稳定
- 能指导蛋白质合成,控制生命过程
- 能产生可遗传的变异
- 核小体是由H2A、H2B、H3、H4、各两分子生成的八聚体以及大约200bpDNA组成
- H3·H4四聚体的形成启动核小体的组装,四聚体与DNA结合,再与两个H2A·H2B二聚体结合,完成核小体组装
- 八聚体在中间,DNA分子盘绕在外,H1在核小体外,每个核小体只有一个H1
- 核小体串联起来形成染色质细丝
- 形成过程:两分子的H3和两分子的H4先形成四聚体,然后由H2A和H2B形成的异二聚体在四聚体两侧,分别结合形成八聚体。长146bp的DNA以左手螺旋的形式盘绕在八聚体上1.8圈,形成核小体的核心颗粒,每圈约80bp。核心颗粒两端的DNA各有11bp与H1结合,形成完整的核小体
- 请举例3项实验证据来说明为什么染色质中DNA与蛋白质分子是相互作用的。
- 用小球菌核酸酶处理染色质进行电泳,可以得到一系列片段,这些被保留的DNA片段均为200bp基本单位的倍数
- 染色质的电子显微镜图显示出由核小体组成的念珠状结构可以看到一条细丝连接着一串直径为10nm的球状体。在染色质的X射线衍射图中也发现了10nm的重复单位
- 在染色质状态下,由DNA聚合酶催化的DNA复制和转录活性大大低于在自由DNA中的反应。DNA聚I对染色质DNA的消化远远慢于对纯DNA的作用
- 组蛋白修饰作用只发生在细胞周围的特定时间和组蛋白的特定位点上,由于其富含精氨酸和赖氨酸,可以发生包括甲基化、乙基化、磷酸化及泛素化等修饰,所有这性修饰作用都有一个共同的特点:降低组蛋白所携带的正电荷,直接或间接影响基因的转录活性
- 甲基化可发生在组蛋白的Lys和Arg残基上,不同程度的甲基化极大地增加了组蛋白修饰和调节基因表达的复杂性,组蛋白甲基化的异常导致肿瘤等多种人类疾病的发生
- 乙酰化主要发生在核心组蛋白上,主要分布在H3和H4的N端比较保守的赖氨酸位置上。乙酰化修饰由组蛋白乙酰转移酶和组蛋白去乙酰化酶协调进行,以保证乙酰化水平的动态平衡。参与DNA修复、拼接和复制,参与染色体组装以及细胞的信号传导,与某些疾病的形成密切相关
- 磷酸化参与基因转录、DNA修复、细胞凋亡及染色体浓缩等过程
- 泛素化修饰位点为高度保守的赖氨酸残基。泛素化修饰不会导致蛋白质的降解,却能招募核小体形成染色体
- DNA一级结构是指4种核苷酸的连接及排序,表示该DNA分子的化学构成。组成DNA分子的碱基有4种,配对方式为A与T、C与G,由于碱基能以任何顺序排列,构成DNA分子多样性,许多脱氧核苷酸经3‘->5‘磷酸二酯键聚合而成为DNA链
- DNA二级结构指两条多核苷酸反向平行盘绕所生成的双螺旋结构。其特点为,DNA分子有两条相互平行的脱氧核苷酸长链盘绕而成,DNA分子中的脱氧核糖和磷酸交替连接,排在外侧,构成基本骨架,碱基排列在内侧,两条链上的碱基通过氢键相结合,形成碱基对,它的组成有一定的规律,即:嘌呤与嘧啶配对(A与T,G与C配对)碱基之间的这种一一对应的关系称为碱基互补配对原则,由于碱基可以任何顺序排列,因此构成了DNA分子的多样性。通常情况下DNA的二级结构分为两大类:一类是右手螺旋,如A-DNA和B-DNA,DNA通常以右手螺旋形式存在;另一类是左手螺旋,即Z-DNA。
- DNA三级结构是指DNA双螺旋进一步扭曲盘旋所形成的特定空间结构,包括超螺旋、线性双链中的纽结,多重螺旋等。其中超螺旋结构其主要形式可分为正超螺旋(右手螺旋)和负超螺旋(左手螺旋)两类,负超螺旋是细胞内常见的DNA高级结构形式,正超螺旋是过度缠绕的双螺旋,它们在不同类型的拓扑异构酶作用下或特殊情况下可相互转变
- 原核生物DNA具有哪些不同于真核生物的DNA特征?
- 结构简练。原核DNA分子的大部分是用来编码蛋白质的,只有非常小的一部分不转录,这与真核细胞DNA冗余现象完全不同。不转录的DNA通常是控制基因表达的序列
- 存在转录单元。原核生物DNA序列中功能相关的基因,往往丛集在基因组的一个或几个特定部位,形成功能单位或转录单元,它们可被一起转录为含多个mRNA的分子,称为多顺反子mRNA,受同一操纵基因调控。
- 有重叠基因
- 谁提出了DNA双螺旋结构模型?简述其主要实验依据及其在分子生物学发展中的重要意义。
- Watson和Crick在1953年提出DNA双螺旋结构模型
- 该模型的建立对促进分子生物学及分子遗传学的发展具有划时代意义。对DNA本身对复制机制、遗传信息的存储方式和遗传信息的表达、生物遗传稳定性和变异性等规律的阐明起了非常重要的作用。同时,该模型的建立也推进了一系列分子生物学技术的发展,如PCR、DNA分子杂交技术等。
- DNA以何种方式进行复制?如何保证DNA复制的准确性?
- 半保留复制
- 碱基互补配对原则;DNA聚合酶的识别作用;DNA聚合酶具有3‘->5‘外切酶的作用,可以自我校对;使用RNA引物,减少复制差错;有错配机制;Mn2+和Mg2+的比例、浓度对核苷酸原酶活性进行调控,确保细胞内四种dNTP的浓度平衡
- 原核生物双链DNA都以半保留复制方式遗传,DNA的复制在整个细胞周期都能进行
- 只有一个复制起点,复制子较大
- 只有一个复制单元,但可以有多个复制叉
- 复制叉移动速度很快,是真核生物很多倍
- 半不连续复制
- DNA聚合酶组成和功能上与真核生物有很大不同
- DNA分子是环形,不存在末端缩短问题
- 冈崎片段大(1000~2000bp)
- Tm值:增色效应达到最大值一半时的温度
- DNA均一性:均一性高,溶解过程爆发的温度范围窄
- DNA分子中的GC含量:GC含量高,Tm值大,T=69.3+0.41(G+C)%
- DNA溶液的离子强度:在低离子强度低介质中,DNA的Tm值较低而范围宽。高离子强度Tm值
- DNA复制时为什么前导链时连续复制,而后随链时不连续复制?并请以大肠杆菌为例简述后随链复制的各个步骤。
- DNA两条链反向平行,而DNA聚合酶只有5‘->3‘聚合酶活性。因此两条链中有一条复制叉移动方向和DNA合成方向相反,必须在引物酶的作用下,先合成一段引物,在DNA聚合酶III的作用下,合成冈崎片段,然后由DNA聚合酶I切除引物,相邻的片段之间的缺口最后由连接酶连接起来
- 复制起始:
- 复制叉形成:复制蛋白DnaA识别大肠杆菌复制起始点(oriC)并与其结合,然后DnaC结合上去允许解旋酶DnaB结合,将母链DNA分开,形成一个复制叉,在起始点出现复制泡,从起点向两个方向移动
- 引物形成在后随链上,DNA引发酶(DnaG)与DnaB结合形成复合体,ATP水解驱动复合物沿模版链移动,促使母链分开,单链结合蛋白(SSB)与单链DNA相结合,DnaG催化合成短的RNA引物
- 延伸:
- DNA聚合酶III从引物3‘-OH起,延伸冈崎片段,当聚合酶复合物遇到已经合成的冈崎片段引物时,延长反应停止;DNA聚合酶III从DNA模版链上解离下来。前导链继续合成,直到终点
- 终止:
- DNA聚合酶I去除引物,并填补留下的空隙
- DAN连接酶封闭缺口,完成链的合成
- 细胞生活周期水平调控:也称为限制点调控,即决定细胞停留在G1期还是进入S期。许多外部因素和细胞因子参与限制点调控。促细胞分裂剂、致癌剂、外科切除等都可以诱发细胞由G1期进入S期。一些细胞因子如四磷酸二腺苷和聚ADP-核糖也可诱导DNA的复制
- 染色体水平调控:决定不同染色体或同一染色体不同部位的复制子按一定顺序在S期起始复制,这种有序复制的机制还不清楚
- 复制子水平调控:决定复制的起始与否,这种调控从单细胞生物到高等动物是高度保守的。此外,真核生物复制起始还包括转录活化、复制起始复合物的合成和引物合成等阶段,许多参与复制起始蛋白功能与原核生物中相类似。酵母染色体复制只发生于S期,各个复制子按专一的时间顺序活化,在S期的不同阶段起始复制
- 细胞通过哪几种对DNA损伤进行修复?它们在维持基因稳定性中的作用是什么?
- DNA直接修复(direct repair):DNA损伤直接修复而并不需要切除碱基或核苷酸的机制,直接修复是把损伤的碱基回复到原来的一种状态。如DNA光解酶修复胸腺嘧啶二体及6-4光化物的过程
- 错配修复(mismatch repair):一旦在DNA复制过程中发生错配,细胞能通过准确的错配修复识别新合成链中的错配并加以矫正,DNA子链中的错配几乎完全能被修正,充分反映了母链系列的重要性。该系统识别母链的依据来自Dam甲基化酶
- 碱基切除修复(base-excision rapier):细胞中有能识别受损核酸的糖苷水解酶,特异性切除受损核苷酸上的N-ß糖苷键,在DNA链上形成去嘌呤或去嘧啶位点统称为AP位点,一旦产生AP位点,AP内切核酸酶就会把受损的核苷酸的糖苷-磷酸键切开,移去包括AP位点在内的小片段DNA,由DNA聚合酶I合成新的片段
- 核苷酸切除修复(nucleotide-excision repair):当DNA链上相应位置的核苷酸发生损伤,导致双链之间无法形成氢键,则由核苷酸切除修复系统负责修复
- 同源重组修复(homologous recombination repair,HR)和非同源末端连接(non-homologous endjoining,NHEJ):当DNA发生双链断裂时,可通过同源重组修复和非同源末端连接来进行修复。同源重组修复时利用细胞内的同源染色体对应的DNA序列作为修复模版进行DNA修复的过程
- 跨损伤合成(translation synthesis,TLS)是一类复制后修复,也被称为“跨缺刻修复”或“备份复制”(backup synthesis),最先发现于原核细胞中,在DNA链复制过程中,当DNA聚合酶遇到嘧啶二聚体或脱嘌呤位点等没有被修复等损伤而使复制停顿时,复制机器必须越过损伤以防止复制叉的崩塌,机体必须启动跨损伤合成系统并忽略已存在的损伤
- SOS修复系统(SOS repair):是细胞DNA受到损伤或复制系统受到抑制的紧急情况下,细胞为求生而产生的一种应急措施。它是一种旁路系统,允许新生的DNA链越过胸腺嘧啶二聚体继续复制,其代价是保真度的极大降低。SOS修复系统包括诱导DNA损伤修复、诱变效应、细胞分裂的抑制以及溶原性细菌释放噬菌体
- 转座子(transposon,Tn)是存在于染色体DNA上可自主复制和位移的基本单位。转座子分为两大类:插入序列(insertion sequence,IS)和复合型转座子(compositetransposon)
- 插入序列(IS):最简单的转座子,是细菌的一小段可转座元件,它不含任何宿主基因而常被称为插入序列,它们是细菌染色体或质粒DNA的正常组成成分。常见的IS序列都是很小的DNA片段(约1k碱基对)末端具有反向重复区,转座时往往复制宿主靶位点一小段(4~15碱基对)DNA,形成位于IS序列两端的正向重复区
- 复合型转座子是一类带有抗药性基因(或其他素主基因)的转座子,其两翼往往是相同或高度同源的IS序列,表明IS序列插入到某个功能基因时就可能产生复合型转座子。一旦形成复合型转座子,IS序列就不能再单独移动,因为它们的功能被修饰了,只能作为复合体移动
- SNP是single nucleotide polymorphism的缩写,中文翻译为单核苷酸多态性:指基因组DNA序列中统一位置上的每个碱基类型叫做一个稳定性。随着SNP检测和分析技术的进一步发展,已经成为继限制性片段长度多态性(RFLP)和微卫星标记(SSR)之后的第三代遗传标记
- 优点:数量多且分布广泛;SNP比STR扩增更可靠,不会产生假阳性,具有代表性;能稳定遗传;可实现分析自动化,减少研究时间
从DNA到RNA
DNA双链中,与mRNA序列相同的那条称为:编码链或有义链。另一条称为模板链或反义链
只有成熟的、相对分子质量明显变小并经过化学修饰的前体RNA才能进入细胞质,参与蛋白质合成
原核生物常以AUG(或GUC,UUG)为起始密码子,而真核生物几乎永远以AUG为起始密码子
RNA的结构、分类和功能
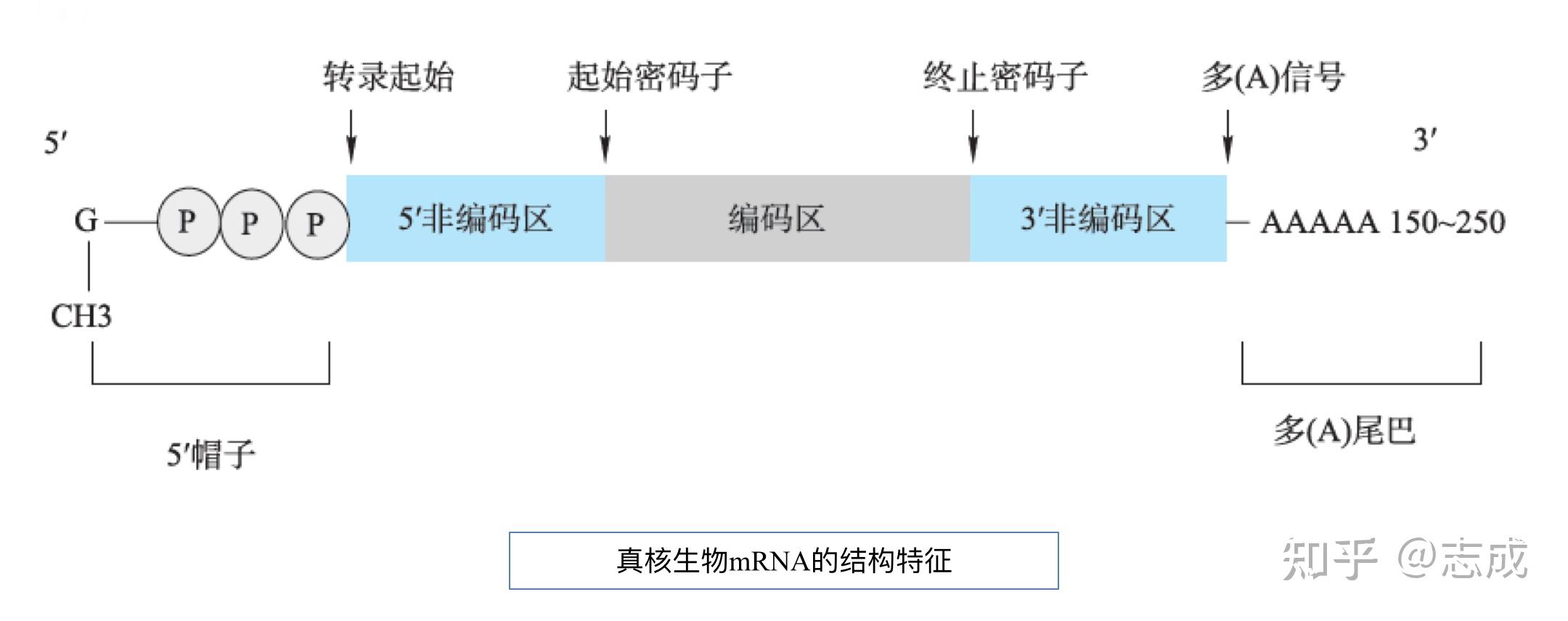
mRNA结构特点
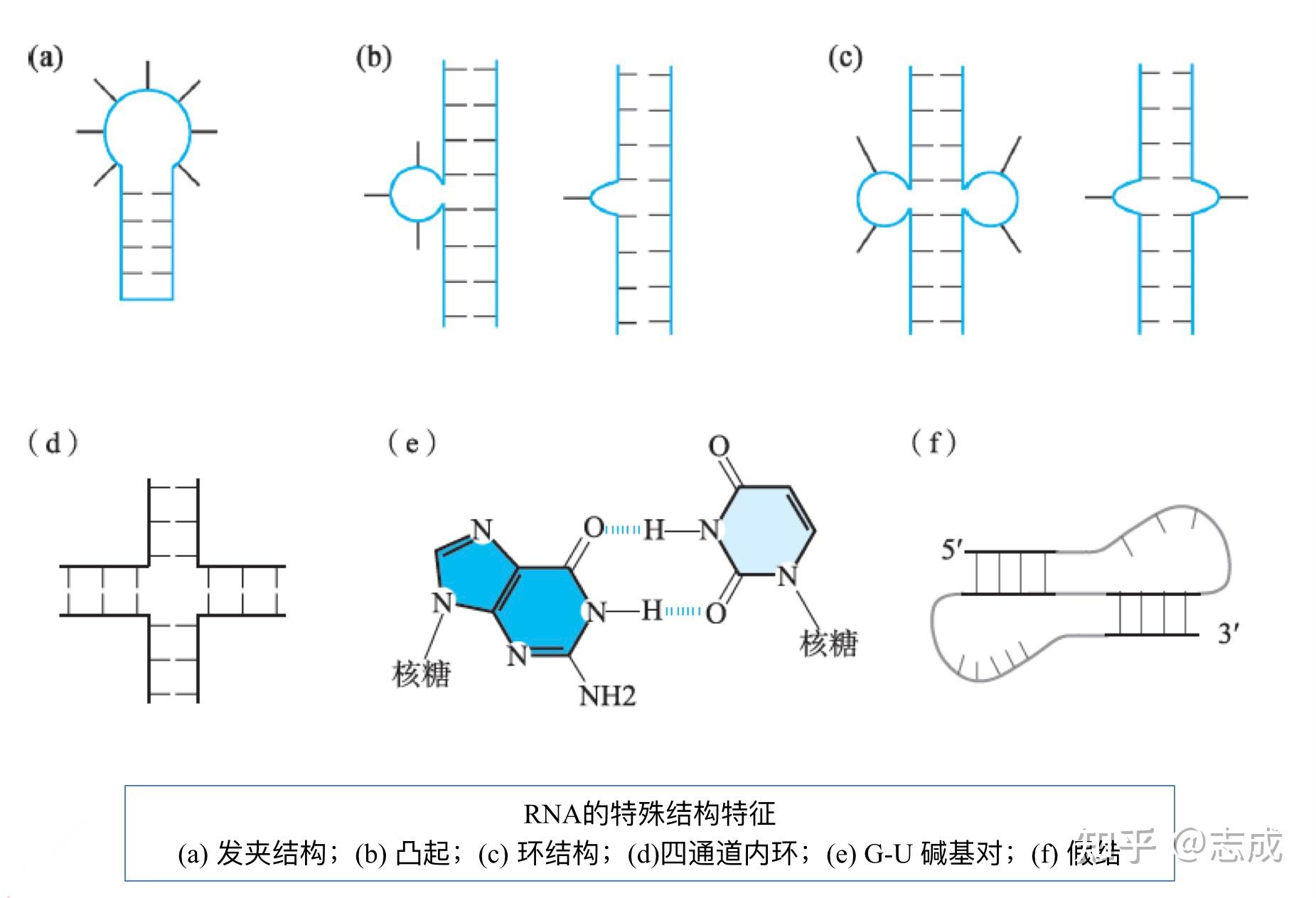
- RNA含有核糖和嘧啶(AGCU),通常是单链线性分子
- 由于RNA链频繁发生自身折叠,在互补序列间形成碱基配对区,所以尽管RNA是单链分子,它仍然具有大量双螺旋结构
- RNA有多种茎环结构:发卡结构(hairpin)、凸起(bulge)、环状结构(loop)、四通道内环(four-stemjunction)
- RNA中含有G-U配对
- RNA可折叠形成复杂的三级结构
环状RNA
- 环状RNA广泛存在于从古菌到人类多种生物的细胞中
- 环状RNA不受RNA外切酶到影响而不易降解,比线性RNA稳定
- 表达存在细胞和组织表达特异性
- 环状RNA可以通过不同途径影响基因表达生物体中不同的RNA种类(RNA分类)
- 信使RNA,mRNA(messenger RNA):编码特定的蛋白质序列
- 前信使RNA,pre-mRNA(precursor mRNA)「 hnRNA(heterogeneous nuclear RNA)」:真核生物mRNA前体,未成熟的mRNA,hnRNA可以包含那些并不最终成为胞浆中mRNA的细胞核内RNA转录物
- 转运RNA,tRNA(transfer RNA):能特异性解读mRNA中的遗传信息,将其转化为相应氨基酸后加入多肽链中
- 核糖体RNA,rRNA(ribosomal RNA):与多种核糖体蛋白质共同构成核糖体,参与蛋白质合成
- 非编码RNA,ncRNA(non-coding RNA):没有编码蛋白质能力的RNA
- 小分子RNA,miRNA(microRNA):真核生物中广泛存在的一种长约21到23个核苷酸的RNA分子,可调控其他基因表达
- 小分子干扰RNA,siRNA(small interfering RNA):长度20到25个核苷酸的双链RNA,目前已知主要参与RNA干扰现象
- 核内小RNA,snRNA(small nulear RNA):与许多蛋白质结合在一起成为小胞核核糖蛋白(snRNPs)参与pre-mRNA的剪接
- 核仁小RNA,snoRNA(small nucleolar RNA):可引导rRNA或其他RNA的化学修饰作用
- 细胞质小RNA,scRNA(small conditional RNA):起信号转导的作用
- 长链非编码RNA,lncRNA(long non-coding RNA):长度超过200nt但不编码蛋白质的转录产物RNA功能
RNA既是信息分子,又能作为功能分子发挥作用
作为功能分子的作用有:
- 作为细胞内蛋白质生物合成的主要参与者
- 部分RNA可作为核酶在细胞中催化一些重要的反应,主要作用于出事转录产物的剪接加工
- 参与基因表达,与生物的生长发育密切相关
- 在某些病毒中,RNA是遗传物质
RNA转录概述
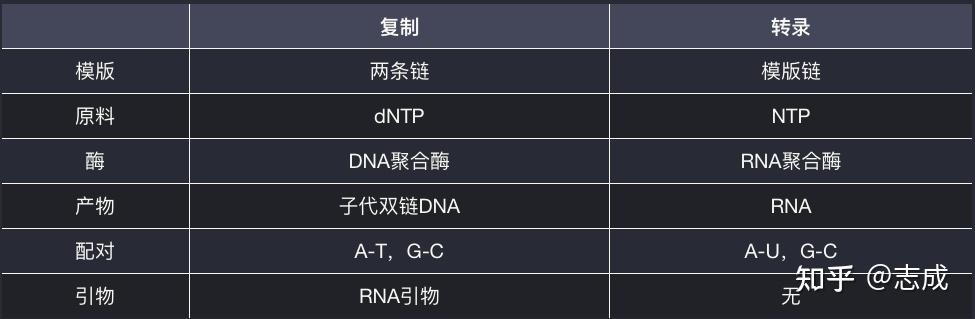
RNA转录和DNA复制的区别
- RNA聚合酶可以从头起始转录,在催化RNA合成时不需要引物
- 多个RNA聚合酶可以同时转录一个基因,在短时间内合成大量的转录产物
- 转录具有选择性
- 转录过程缺乏严谨的矫正机制
RNA聚合酶
RNA聚合酶以Mg2+/Mn2+为辅助因子,以NTP为活性前体,以双链DNA为模版催化RNA链的起始、延伸、终止,且不需要任何引物
启动子与转录
- 启动子(promoter):一段位于结构基因5‘端上游区的DNA序列,能活化RNA聚合酶,使之与模版DNA准确相结合并具有转录起始的特异性
- 转录单位(transcript unit):从启动子到终止子等DNA序列
- 转录起点:与RNA链第一个核苷酸相对应DNA链上的碱基,通常为嘌呤
- 常将5‘端的序列称为上游序列,3’端的序列称为下游序列
RNA转录的基本过程
RNA链的合成特点
- RNA按5‘到3’方向合成,以DNA双链中的反义链(模版链)为模版,在RNA聚合酶催化下,以NTPs为原料,根据碱基互补配对原则,各核苷酸间通过形成磷酸二酯键相连,不需要引物参与。
- 模版识别(template recognition)
- 指RNA聚合酶识别启动子序列并与启动子DNA双链特异性结合的过程
- RNA聚合酶与启动子结合后,使启动子附近的DNA双链解旋并解链,形成转录泡以促使底物核糖核酸与模版DNA的碱基配对
- 转录泡向DNA的5‘端移动,NTP被添加到新生RNA链的3’- OH端。双螺旋不断解开,露出新的单链DNA模版,在解链区后面,DNA模版链与其原先配对的非模版链重新结合成为双螺旋
- 当RNA链延伸到转录终止位点时,RNA聚合酶不再形成新的磷酸二酯键,转录泡瓦解,DNA恢复成双链状态
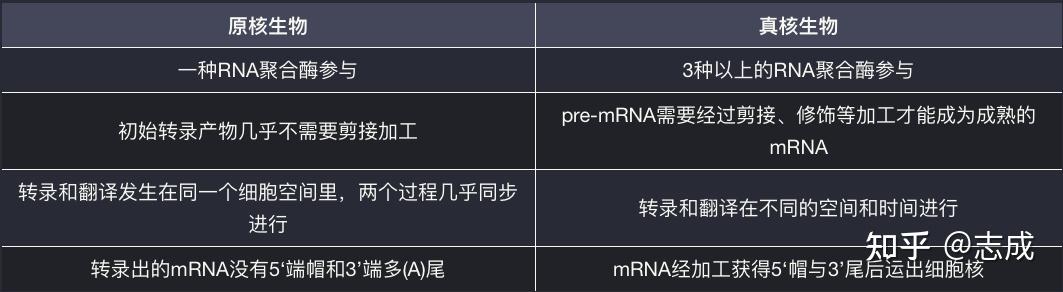
原核生物与真核生物的转录及产物特征比较
- 原核生物只有一种RNA聚合酶参与基因转录, 而真核生物有三种以上的RNA聚合酶来负责不同类型的基因转录
- 原核生物转录初始产物大多数是编码序列,与蛋白质的氨基酸序列呈线性关系。 而真核生物的初始转录产物含有内含子序列,mRNA只占初始转录产物的一小部分(需要剪接、修饰等加工后才能成为成熟的mRNA)
- 原核生物很少剪接,但很多是非编码RNA。原核生物缺少剪接体剪接途径(没有原核生物发生可变剪接的事例)
- 在原核生物中,转录核翻译不仅发生在同一个细胞空间里,而且这两个过程几乎同步进行
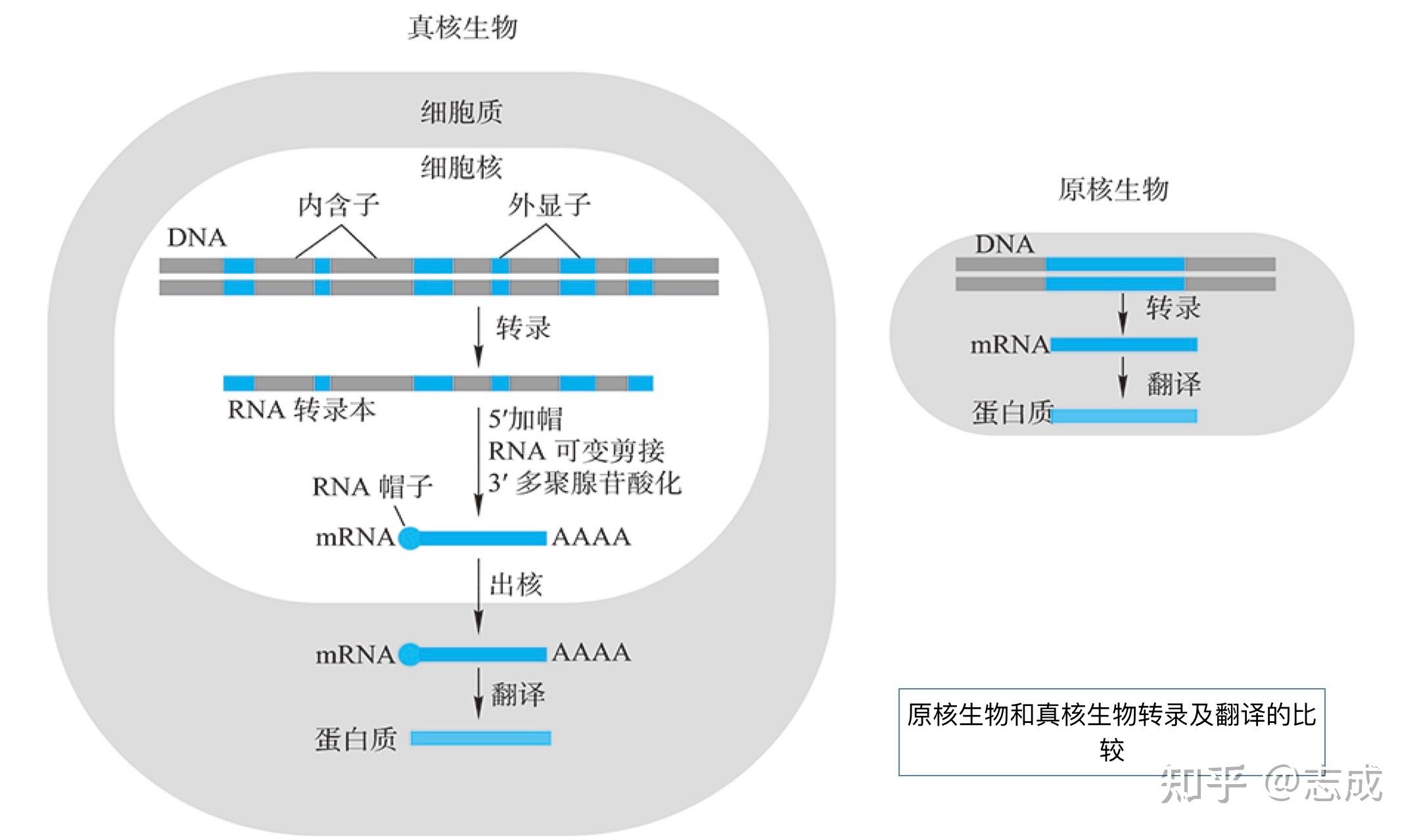
- 原核生物半衰期短
- 转录翻译同时进行,部分5‘端已经开始降解3’端还在转录
- 许多原核生物mRNA以多顺反子的形式存在
- 只编码一个蛋白质的mRNA称为单顺反子mRNA;编码多个蛋白质的mRNA称为多顺反子mRNA
- 细菌mRNA可以同时编码不同的蛋白质,多顺反子mRNA是一组相邻或相互重叠基因的转录产物,这样的一组基因可被称为一个操纵子(operon)。「原核生物操纵子表达产生多顺反子mRNA,真核生物操纵子表达产生但顺反子mRNA」
- 当两个顺反子相距较远时,前一顺反子与后一顺反子翻译的起始相互独立;当两个顺反子之间距离较近时,前一顺反子与后一顺反子翻译的起始相衔接,30S小亚基始终与mRNA结合,只有50S大亚基可能与mRNA分离
- 真核生物mRNA结构上的最大特征好是5’端帽子和3‘端多(A)结构;原核生物mRNA5‘端无帽子结构,3’端没有或只有较短的多(A)结构
- 原核生物起始密码子AUG上游7~12个核苷酸处有被称为SD序列(Shine-Dalgarno sequence)的保守区,该序列与16S rRNA 3‘端反向互补,被认为在核糖体与mRNA的结合过程中起作用
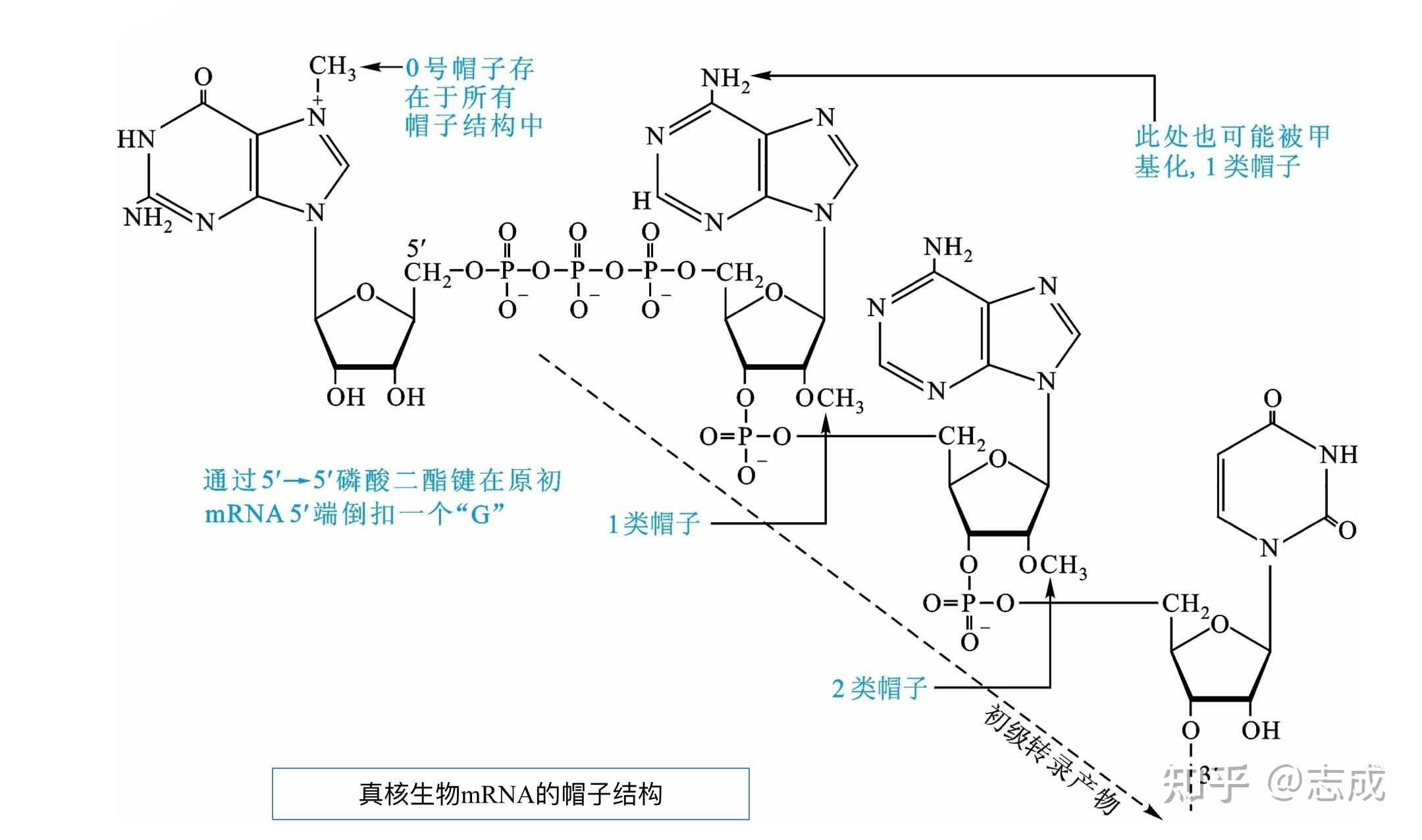
- 5‘帽子是一个在mRNA转录后加上去的甲基化鸟嘌呤核苷酸,鸟苷酸转移酶催化
- mRNA的帽子结构容易被甲基化
- 5‘端帽子主要功能:
- 调控细胞核输出。细胞核输出是由帽结合复合物(CBC)调控,它只会与加帽的RNA结合
- 防止被核算外切酶降解
- 促进翻译。5‘帽用于与核糖体及翻译起始因子结合
- 多(A)序列是在转录后加上的
- 加多(A)时要由内切酶切开mRNA 3’端特定部位,然后由多(A)合成酶催化多腺苷酸反应
- 多(A)是mRNA由细胞核进入细胞质所必须的形式,提高了mRNA在细胞质中的稳定性
原核生物RNA聚合酶及其转录
在细菌中,一种RNA聚合酶负责所有mRNA、rRNA和tRNA的合成
大肠杆菌RNA聚合酶是研究最清楚的RNA聚合酶
- 由2个α亚基、一个ß亚基、一个ω亚基、一个σ亚基组成
- 相对分子质量4.65 x 10**5
原核生物转录的起始需要全酶参与,由σ因子辨认起始点,延长过程仅需要核心酶的催化
σ因子
帮助转录起始,也称之为起始亚基
- σ因子的作用是负责模版链的选择和转录的起始,它是酶的别构效应物,使酶专一性识别模版上的启动子
- 在细胞内的σ因子的数量只有核心酶的30%
- σ因子可以极大的提高RNA聚合酶对启动子区DNA序列的亲和力
- 在某系细菌细胞内含能识别不同启动子的σ因子,以适应不同生长发育阶段的需求,调控不同基因转录的起始原核生物启动子结构
pribnow区:DNA上用于在细菌中进行转录的启动子位点的重要部分,是RNA聚合酶的紧密结合点,这个区的中央位于起点上游10bp处,又称-10区
绝大部分启动子都存在-10位的TATA区,-35位的TTGACA区,是RNA聚合酶与启动子的结合位点,能与σ因子相互识别而去具有很高的亲和力
在原核生物中-35区与-10区之间的距离通常是16~19碱基对,小于15碱基对或大于20碱基对都会降低启动子活性
原核生物RNA聚合酶对启动子的识别和结合
RNA聚合酶通过氢键互补的方式加以识别,当局部DNA构想或电荷密度改变影响了这些基团的相对方位时,启动子的功能会受到影响
原核生物RNA转录周期
- RNA转录起始
- RNA聚合酶全酶对启动子的识别,聚合酶与启动子可逆性结合形成封闭复合物,此时DNA仍处于双链状态
- 伴随DNA构象上的重大变化,封闭复合物转变为开放复合物,聚合酶全酶所结合的DNA序列中有一小段双链被解开
- 开放复合物与最初两个NTP相结合,并在这两个核苷酸之间形成磷酸二酯键后转变为包括RNA聚合酶、DNA和和RNA的三元复合物
- RNA链延伸
- 新生的RNA链长度达到9~10nt时,σ因子从RNA聚合酶全酶上脱落下来,核心酶沿模版DNA链延伸
- 延伸阶段,DNA和聚合酶分子都发生了构象变化,由核心酶、DNA和RNA所组成转录延伸复合物是转录循环中的重要环节
- 延伸RNA聚合酶同时具有合成和校对两种功能
- 焦磷酸编辑:通过添加入焦磷酸来去除错误插入的核糖核苷酸
- 水解编辑:由一些Gre因子激发「Gre因子是延伸刺激因子,帮助聚合酶度过较难转录的区域,同时去除含有错配的序列」<!--DOI: 10.1073/pnas.97.16.8916-->
- RNA转录终止
- RNA聚合酶遇到终止信号,与DNA模版脱离,并释放RNA
- 原核生物(大肠杆菌)终止分为依赖ρ因子,与不依赖ρ因子。
- ρ因子由6个相同的亚基组成,具有NTP酶和解旋酶活性,通过催化NTP的水解促使新生RNA链从三元转录复合物中解离出来,终止转录
- 内在终止子(固有终止子):不依赖ρ因子这类终止反应中,没有任何其他因素参与就能终止转录。通过DNA上的终止子控制(一般上游DNA存在一个富含GC碱基的反向重复序列,这段DNA转录产生的RNA容易形成发卡结构。在终止位点前有一段4~8个A-T碱基对序列,其转录产物的3‘端位寡聚U)
- 依赖ρ因子的终止:有些终止位点DNA缺乏共性,而且不能形成强的发夹结构,因而不能诱导转录的自发终止
真核生物RNA聚合酶及其转录
真核生物的RNA聚合酶高度分工,转录过程中往往需要包括转录因子在内的多种蛋白因子参与
真核生物RNA聚合酶
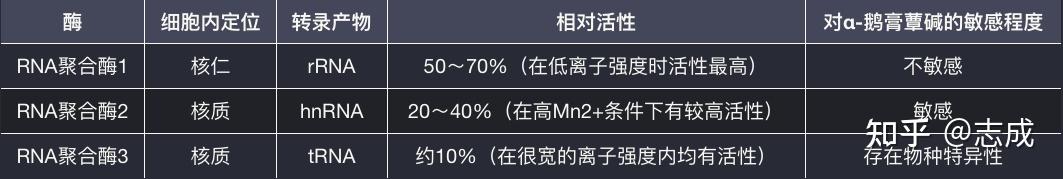
- 除细胞核外,真核生物线粒体和叶绿体中还纯在着不同的RNA聚合酶
- α-鹅膏蕈碱会不同程度的抑制RNA聚合酶活性
真核生物启动子对转录的影响
- RNA聚合酶2催化转录的DNA序列5‘上游区有一段富含TA的保守序列,由于该序列前四个碱基为TATA,所以又称为TATA区(TATA box)
- 在核心启动子上游100~200bp范围内,还存在一个转录调控区,有多个启动元件
- TATA box上游的保守序列称为:上游启动子元件(UPE),或 上游激活序列(UAS)
- TATA区的主要作用:使转录位点更精确
- 上游启动子元件CAAT区和GC区主要控制转录起始频率,其中CAAT区对转录起始频率的影响最大
转录起始复合物组装
- 真核生物RNA聚合酶不能直接识别基因的启动子区
- 需要转录调控因子这种辅助蛋白按特定顺序结合于启动子上,帮助RNA聚合酶特异性结合到靶基因的启动子上,并解开DNA双链
- 转录因子和RNA聚合酶2必须以特定顺序结合到启动子上形成转录前复合物(PIC)
增强子及其功能
- 增强子(强化子):人类基因组中一大类非常重要的顺式调控元件,能够参与染色质的空间折叠和基因的表达调控
- 在SV40的转录单元上发现它的转录起始位点上游约200bp处有两段72bp长的重复序列,它们不是启动子的一部分,但能增强或促进转录的起始,除去这两段序列会大大降低这些基因的转录水平,若保留其中一段或将其取出插至DNA分子的任何部位,都能正常转录。
- 增强子特点:
- 远距离效应:一般位于上游-200碱基对处,但可增强远处启动子的转录
- 无方向性:无论位于靶基因的上下游或内部都可发挥作用
- 顺式调节:只调节位于同一染色体上的靶基因,而对其他染色体上的基因没有作用
- 无物种和基因特异性:可以连接到异源基因上发挥作用
- 具有组织特异性:增强子的效应需特点的蛋白质因子参与
- 有相位性:其作用和DNA的构象有关
- 某些增强子可应答外部信号:如热休克基因在高温下才会表达,金属硫蛋白基因在镉和锌的纯在下才表达
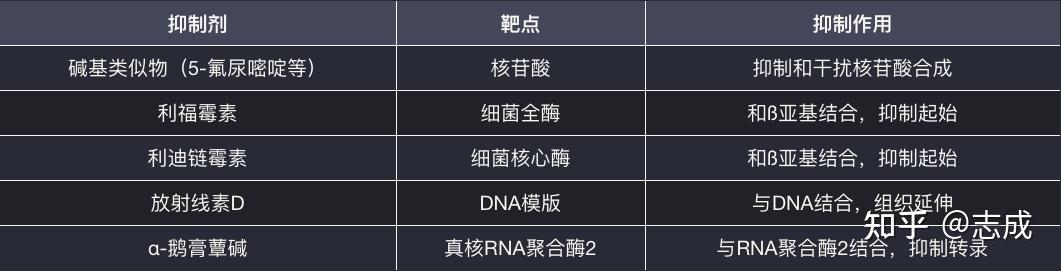
RNA转录的抑制
RNA转录抑制剂根据其作用的性质主要可以分为3大类:嘌呤和嘧啶类似物,作为核苷酸代谢拮抗剂而抑制前体RNA的合成;DNA模板功能抑制剂,通过与DNA结合而改变模版的功能;RNA聚合酶抑制物,与RNA聚合酶结合使其失去活力
- 嘌呤和嘧啶类似物
- 人工合成的碱基类似物:5-氟尿嘧啶、6-氮尿嘧啶、6-巯基嘌呤、8-氮鸟嘌呤等,能够抑制和干扰DNA或RNA 合成
- 这些碱基类似物或者作为代谢拮抗物直接抑制核苷酸合成有关的酶类,或者通过渗入核酸分子形成异常的核酸结构,从而影响核酸的进一步延伸
- DNA模版功能抑制剂
- 放线菌、烷化剂和嵌入染料能与DNA结合使其失去模版功能,进而抑制RNA转录
- 放线菌素D具有抗菌和抗癌作用,是DNA模版功能的抑制物,可与DNA形成非共价化合物,使其无法成为转录模版
- 烷化剂如氮芥、磺酸酯、氮丙啶等分子中带有能使DNA甲基化的活性烷基,同时作用于DNA的两条链,使其发生交联,无法成为转录模版
- 嵌入染料可插入双链DNA相邻碱基对之间,它们大小与碱基相当,插入后使DNA在复制中缺失或增加一个碱基,导致移码突变
- RNA聚合酶抑制物
- 某些抗生素或化学药物,如利福霉素、利迪链霉素和α-鹅膏蕈碱都是RNA聚合酶的抑制物
- 利福霉素能强烈能特异性抑制细菌RNA聚合酶活性
- α-鹅膏蕈碱主要抑制真核生物RNA聚合酶
常见的转录抑制剂
真核生物RNA的转录后加工
- 真核基因大多是断裂的,一个基因可由多个内含子和外显子间隔排列而成
- 真核基因表达往往伴随RNA剪接
真核生物tRNA转录后加工
真核生物tRNA内含子特点:
- 长度和序列没有共同性,一般16~46nt
- 位于反密码子下游
- 内含子和外显子的边界没有保守序列tRNA的加工主要包括下面三个过程:
1. 剪接连接外显子
2. 3‘端添加CCA 真核生物所有tRNA前体的3’端缺乏-CCAOH结构,需要在tRNA核苷酸转移酶的催化下在其3‘端添加CCA
3. 核苷酸修饰 tRNA分子中稀有核苷酸较多,其修饰较频繁真核生物rRNA转录后加工
- 大多数真核生物rRNA基因无内含子
- 刚转录出的rRNA前体与蛋白质结合形成核糖核蛋白前体颗粒,并在核仁中进行剪接形成成熟的rRNA分子
- 核仁小RNA(snoRNA)参与核糖核酸酶对特定立体结构的识别,从而确定切割位点
哺乳动物细胞内rRNA前体的剪切过程包括以下4个步骤:
1. 在5‘端切除非编码的序列,生成41S中间产物
2. 41S RNA再被切割为两段,一段为32S,含28S rRNA和5.8S rRNA,另一段为20S,含18S rRNA
3. 32S RNA进一步被切割为28S rRNA和5.8S rRNA
4. 20S RNA被剪切生成18S rRNA真核生物mRNA剪接
mRNA剪接主要有三种(不包括tRNA的加工过程):pre-mRNA剪接、1类和2类自剪接内含子
(1类和2类内含子本身具有催化活性,能通过自身折叠成一种特殊构像进行自我剪接,不需要形成剪接体)
由DNA转录产生的mRNA前体,即核内不均一RNA(hnRNA)经过5‘加帽,3’酶切多腺苷酸尾,再经过剪接后通过核孔进入细胞质Chambon法则:多数细胞核mRNA前体中内含子的5'边界序列为GU,3'边界序列为AG。 因此,GU表示供体衔接点的5'端,AG表示接纳体衔接点的3'端。 把这种保守序列模式称为GU-AG法则,又称为Chambon法则。
RNA加工及其生理功能

剪接
剪接(splicing):真核生物转录出的RNA在剪接体的催化作用下,除去内含子将外显子连接起来的过程
剪接体(spliceosome):主要在真核细胞的细胞核内发现的大型且复杂的分子机器。剪接体由五个小核核糖核酸(snRNA)和大约80种小核核糖蛋白(snRNP)组成,剪接体可以从pre-mRNA中去除内含子。
五种小核核糖核酸(snRNA)分别为:U1,U2,U4,U5,U6
snRNP在剪接中的功能:
- 识别5‘剪接位点和分支点
- 按需要把这两个位点集结到一起
- 催化或协助催化RNA的剪接和连接反应
- RNA序列决定了剪接的发生位点
- RNA剪接过程由两步转酯反应完成
RNA三种剪接类型

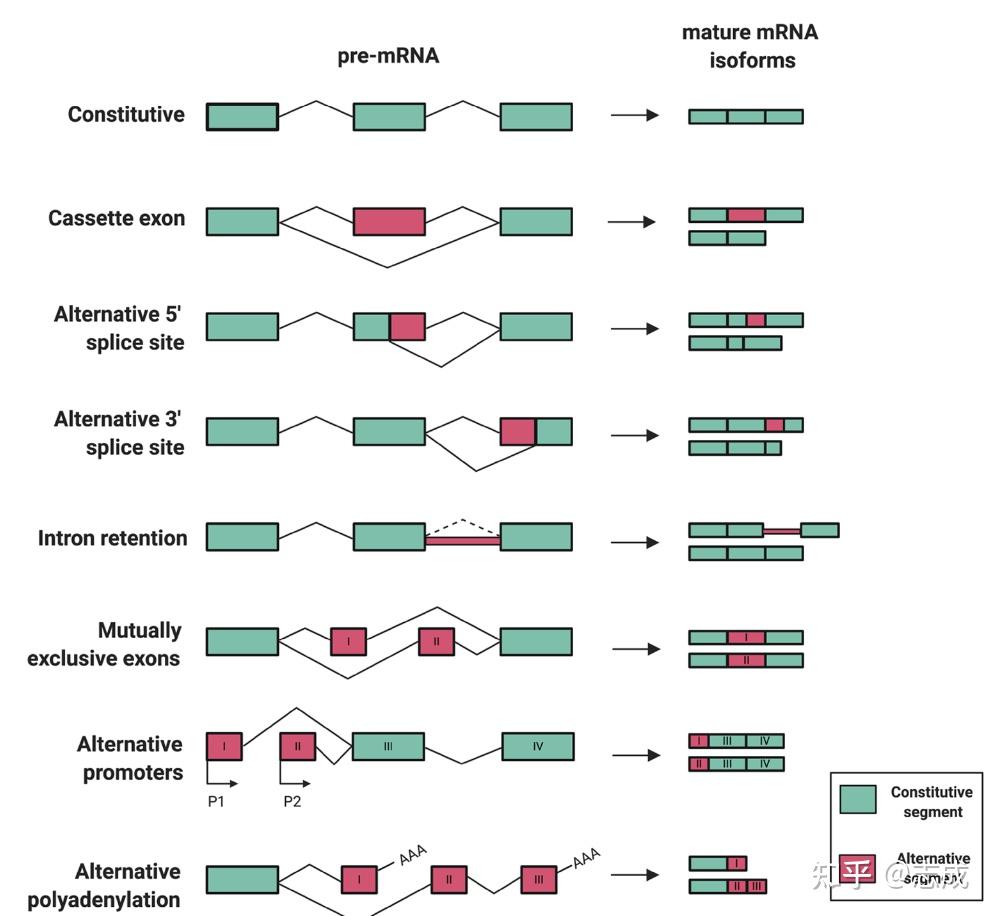
可变剪接
pre-mRNA可通过不同方式的剪接产生不同的mRNA异构体,即内含子与外显子位点可变
人类基因组中大约60%的基因能发生可变剪接
可变剪接类型(8种)
- 完全组成(constitute)
- 外显子跳跃(exon skip)/盒式外显子(cassette exon)
- 5‘位点可变(alternative 5’ splice site)
- 3‘位点可变(alternative 3’ splice site)
- 内含子保留( intron retention)
- 互斥外显子(mutually exclusive exons)
- 可变启动子(alternative promoters)
- 可变多聚腺苷酸化(alternative polyadenylation)<!--dio:10.1186/s40364-020-00249-6-->
RNA的编辑、再编码和化学修饰
RNA编辑
RNA编辑(RNA editing)是mRNA前体通过插入,删除或取代一些核苷酸残基,使DNA所编码的遗传信息发生变化,是细胞内改变mRNA序列和蛋白质编码信息的重要途径
- 介导RNA编辑的机制有两种:
- 位点特异性脱氨基作用和引导
- RNA指导的尿嘧啶插入或删除
- RNA编辑生物学意义:
- 矫正作用:有些基因在突变过程中丢失的遗传信息能通过RNA的编辑得以修复
- 调控翻译:构建或去除启动子和终止子,是基因表达的一种调控方式
- 扩充遗传信息:能使基因产物获得新的结构功能,有利于生物的进化
RNA再编码
- RNA再编码:RNA编码和读码方式的改变。mRNA在某些情况下可以改变原来的编码信息,以不同的方式进行翻译。
- 再编码方式:+1/-1移码、核糖体跳跃、终止子通读,等
- RNA再编码可以使一个mRNA产生多种互相关联但又不同的蛋白质,是蛋白质的一种调节机制
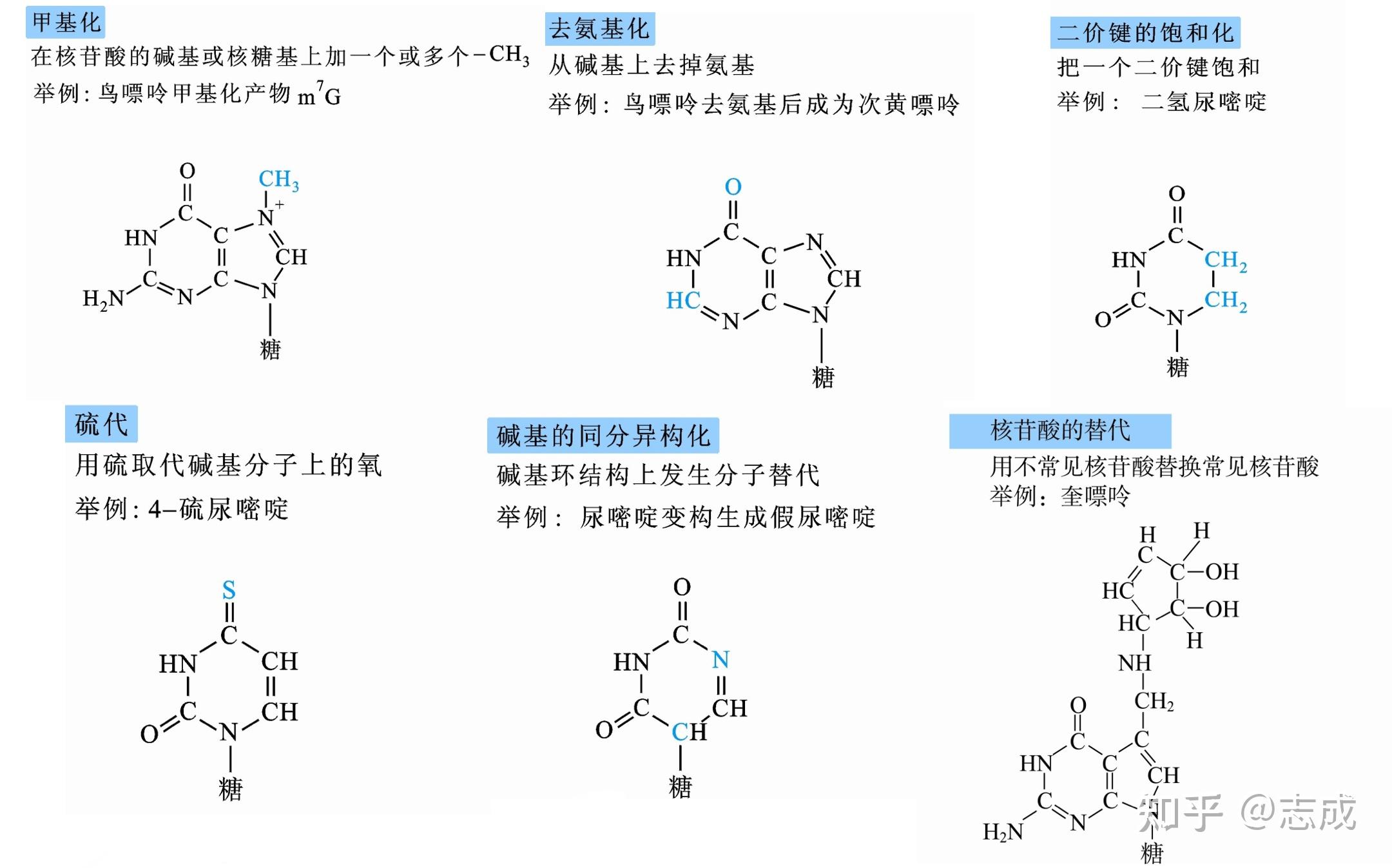
RNA化学修饰
mRNA转运
mRNA通过核孔(核孔复合体)离开细胞核进入细胞质过程是一个主动运输过程,由GTP水解提供能量,并受一些列蛋白质的精细调控
成熟的mRNA需要携带细胞核跨膜转运信号蛋白才能进入细胞质。离开细胞核之后,信号蛋白会解离下来,重新回到细胞核参与下一轮转运
核酶
核酶:一类具有催化功能的RNA分子,通过催化靶位点RNA链中磷酸二酯键的断裂,特异性剪切底物RNA分子,从而阻断基因表达
核酶可分为:剪切型(只剪不接)剪接型(如:1,2类内含子)
思考题
- 与mRNA编码序列相同的那条DNA链称为编码链(有义链);另一条根据碱基互补配对原则指导mRNA合成的DNA链称为模版链(反义链)
- 原核生物 mRNA的半衰期短。细菌基因的转录与翻译是紧密相联的,基因转录一旦开始,核糖体就结合到新生mRNA链的5'端,启动蛋白质合成,而此时该mRNA的3'端还远远没有转录完全。mRNA的降解紧随着蛋白质翻译过程发生。
- 许多原核生物 mRNA 可能以多顺反子的形式存在,而真核生物mRNA一般以单顺反子形式存在。
- 原核生物mRNA的5'端无帽子结构,3'端没有或只有较短的多(A)结构。原核生物起始密码子AUG 上游7~12个核苷酸处有一被称为SD 序列(Shine-Dalgarno sequence)的保守区,因为该序列与16S rRNA3' 端反向互补,所以被认为在核糖体与mRNA的结合过程中起作用。
- 转录的基本过程包括模板识别、转录起始、通过启动子及转录的延伸和终止
- RNA 转录:以DNA为模板,游离碱基为原料,在依赖于DNA的RNA聚合酶催化下,以4种NTPs(ATP、CTP、GTP、UTP)为原料,合成 RNA的过程。无论是原核还是真核细胞,RNA链的合成都具有以下几个特点:RNA是按5'→3'方向合成的,以DNA双链中的反义链(模板链)为模板,在RNA聚合酶催化下,以4种核苷三磷酸(NTPs)为原料,根据碱基配对原则(A—U、T—A、G—C),各核苷酸间通过形成磷酸二酯键相连,不需要引物参与,合成的RNA带有与DNA编码链(有义链)相同的序列(A—U)。
- 相同点:
- 都以DNA链作为模板
- 合成的方向均为5'→3'
- 聚合反应均是通过核苷酸之间形成的3',5'—磷酸二酯键,使核苷酸链延长
- 都遵循碱基互补配对原则
- 都需要酶的参与。
- 不同点:
- 与DNA聚合酶不同,RNA 聚合酶具有从头起始转录的能力,所以它在催化 RNA 合成时不需要引物
- RNA 聚合酶在添加几个核苷酸后,便将正在延长的链从模板上置换下来,RNA产物不与模板 DNA链保持碱基互补状态
- 转录具有选择性。RNA 转录则是选择性地复制基因组的特定部分,可以产生几个到上千个相同的拷贝
- 与DNA 复制的精确度相比,转录中每添加10000个核苷酸会发生一次错误,表明转录过程缺乏严谨的矫正机制
- 大肠杆菌的RNA聚合酶由那些组成成分?各个亚基的作用是什么?
- 大肠杆菌的RNA聚合酶是由2个a亚基、一个β亚基、一个ß'亚基和一个o亚基组成的核心酶,加上一个σ亚基后则成为聚合酶全酶。
- a亚基与核心酶的组装及启动子的识别有关,并参与RNA聚合酶和部分调节因子的相互作用; ß亚基和ß'亚基组成了聚合酶的催化中心,β亚基能与模版DNA、新生RNA链及核苷酸底物相结合。σ因子的作用在于帮助转录起始,因此也称为起始亚基,一旦转录开始,它就脱离了起始复合物,而由核心酶负责RNA链的延伸。
- 转录过程中的模版的识别阶段,聚合酶与启动子可逆性结合形成封闭性复合物;封闭性复合物形成后,此时,DNA 链仍然处于双链状态,伴随着DNA 构象的重大变化,封闭性复合物转化为开放复合物,聚合酶全酶所结合的DNA序列中有一小段双链被解开;开放复合物与最初的两个NTP相结合并在这两个核苷酸之间形成磷酸二脂键后即转变成包括 RNA 聚合酶、DNA和新生RNA的三元复合物。
- σ因子的作用是负责模版链的选择和转录的起始,它是酶的别构效应物,使酶专一性识别模版上的启动子;σ因子可以极大的提高 RNA聚合酶对启动子区 DNA序列的亲和力;σ因子还能使RNA 聚合酶与模版 DNA上非特异性位点的结合常数降低。
- 什么是Pribnow box?它的保守序列是什么?
- 1975年,Pribnow和Schaller 设计了一个实验,把RNA 聚合酶全 酶与模板DNA 结合后,用DNaseI水解 DNA,然后用酚抽提,沉淀纯化DNA 后得到一个被RNA 聚合酶保护的DNA片段,有41~44个核苷酸对。
- 在启动子被保护区内有一个由5个核苷酸组成的共同序列,是RNA聚合酶的紧密结合点,现在称为Pribnow 区(Pribnow box),这个区的中央大约位于起点上游10bp处,所以又称为—10区。它的保守序列是TATAAT
- 只有一种 RNA 聚合酶参与所有类型的原核生物基因转录,而真核生物有3种以上的RNA 聚合酶来负责不同类型的基因转录,合成不同类型的、在细胞核内有不同定位的RNA
- 转录产物有差别。原核生物的初始转录产物大多数是编码序列,与蛋白质的氨基酸序列呈线性关系;而真核生物的初始转录产物很大,含有内含子序列,成熟的mRNA只占初始转录产物的一小部分。
- 原核生物的初始转录几乎不需要剪接加工,就可直接作为成熟的mRNA进一步行使翻译模板的功能;真核生物转录产物需要经过剪接、修饰等转录后加工成熟过程才能成为成熟的mRNA。
- 在原核生物细胞中,转录和翻译不仅发生在同一个细胞空间里,而且这两个过程几乎是同步进行的,蛋白质合成往往在mRNA刚开始转录时就被引发。真核生物mRNA的合成和蛋白质的合成则发生在不同的空间,和时间范畴内。
- 大肠杆菌的终止子有哪两大类?请分别介绍一下它们的结构特点。
- 大肠杆菌的终止子可以分为不依赖于p因子和依赖于p因子两大类
- 不依赖于p因子的终止子结构特点:位于终止位点上游一般存在一个富含GC碱基的二重对称区,由这段 DNA 转录产生的RNA 容易形成发夹式结构;在终止位点前面有一端由4~8个A组成的序列,所以转录产物的3'端为寡聚U
- 依赖于p因子的终止子的结构特点:IR序列中的G/C对含量较少;发夹结构末端没有固定特征;依靠与p因子的共同作用而实现终止
- 真核生物的原始转录产物必须经过哪些加工过程才能成为成熟的mRNA?
- 5‘端连接“帽子”结构
- 3’端添加poly A“尾巴”
- hnRNA被剪接
- 分子内部的核苷酸甲基化修饰
- I类自剪接内含子:发生两次磷酸二酯键的转移(转酯反应)。在I类自剪接切除体系中,第一个转酯反应由一个游离的鸟苷或鸟苷酸(GMP、GDP或GTP)介导,鸟苷或鸟苷酸的3'—OH 作为亲核基团攻击内含子5端的磷酸二酯键,从上游切开RNA链。在第二个转酯反应中,上游外显子的自由3'—OH 作为亲核基团攻击内含子3'位核苷酸上的磷酸二酯键,使内含子被完全切开,上下游两个外显子通过新的磷酸二酯键相连。I类内含子释放出线性内含子,而不是一个套索结构。I类自剪接内含子通常比II类内含子小,有一个保守的二级结构,包括容纳鸟苷或鸟苷酸结合的口袋以及一段与5'剪接位点序列配对的“内在指导序列”,以确定鸟苷亲核攻击的精确位置
- II类自剪接内含子:这类内含子主要存在于真核生物的线粒体和叶绿体rRNA基因中。在II类内含子切除体系中,也发生两次转酯反应,但转酯反应无需游离鸟苷酸或鸟苷,而是由内含子自身靠近3'端的腺苷酸2'—OH作为亲核基团攻击内含子5端的磷酸二酯键,从上游切开 RNA 链后形成套索状结构。再由上游外显子的自由3'—OH作为亲核基团攻击内含子3'位核苷酸上的磷酸二酯键,使内含子被完全切开,上下游两个外显子通过新的磷酸二酯键相连。
- 什么是套索结构?哪些类型RNA的剪接会形成该结构?
- 套索结构师真核生物RNA前体加工过程中,切除内含子时,通过2‘,5’-磷酸二酯键形成的一种带尾巴的环形中间结构,主要在前体mRNA的剪接过程中会形成该结构
- RNA编辑(RNA editing)是mRNA前体加工方式之一,通过插入、删除或取代一些核苷酸残基,使DNA所编码的遗传信息发生变化,是生物细胞内改变mRNA序列和蛋白质编码信息的重要途径。在动物体内,介导RNA编辑的机制主要由两种:位点特异性脱氨基作用和引导RNA(Gudie RNA,gRNA)指导的尿嘧啶插入或删除
- 生物学意义:矫正作用,有些基因在突变的途中丢失的遗传信息可能通过RNA编辑得以恢复;调控翻译,通过编辑可以构建或去除其实密码子和终止密码子,是基因表达调控的一种方式,扩充遗传信息;能使基因产物获得新的结构和功能,有利于生物进化
- 核酶结构特点:具有自剪接能力的RNA大多都能形成锤头结构(hammerhead structure)该二级结构由三个茎构成,茎区是由互补碱基构成的局部双链结构,包围着一个由11~13个保守核苷酸构成的催化中心
- 生物学意义:核酶是继反转录现象之后对中心法则一个重要修正,说明RNA既是遗传物质又是酶;核酶的发现为生命起源的研究提供了新的思路
从RNA到蛋白质
翻译:以mRNA为模版,按照mRNA分子上的三个核苷酸决定一种氨基酸的规则(三联体密码)合成具有特定氨基酸顺序的蛋白质。包括翻译的起始、肽链的延伸、肽链的终止和释放
- 翻译起始:由核糖体与mRNA结合并与氨酰tRNA生成起始复合物
- 肽链延伸:由于核糖体沿mRNA5‘向3’端移动,开始从N端向C端端多肽链合成,这是蛋白质合成最快的阶段
- 肽链的终止和释放:核糖体从mRNA上解离,准备新一轮合成反应
细胞用来进行合成代谢的总能量的90%消耗在蛋白质合成过程中,而参与蛋白质合成的各种组分占到细胞干重的35%
核糖体(rRNA+蛋白):是蛋白质合成的场所,mRNA是蛋白质合成的模版,转移RNA(tRNA)是模版与氨基酸之间的结合体
翻译方向性:
- 蛋白质合成方向:N->C
- mRNA阅读方向:5'->3'
遗传密码
密码子(codon):mRNA上每3个核苷酸翻译成蛋白质多肽上的一个氨基酸,这三个核苷酸称为密码子
三联子密码及其破译
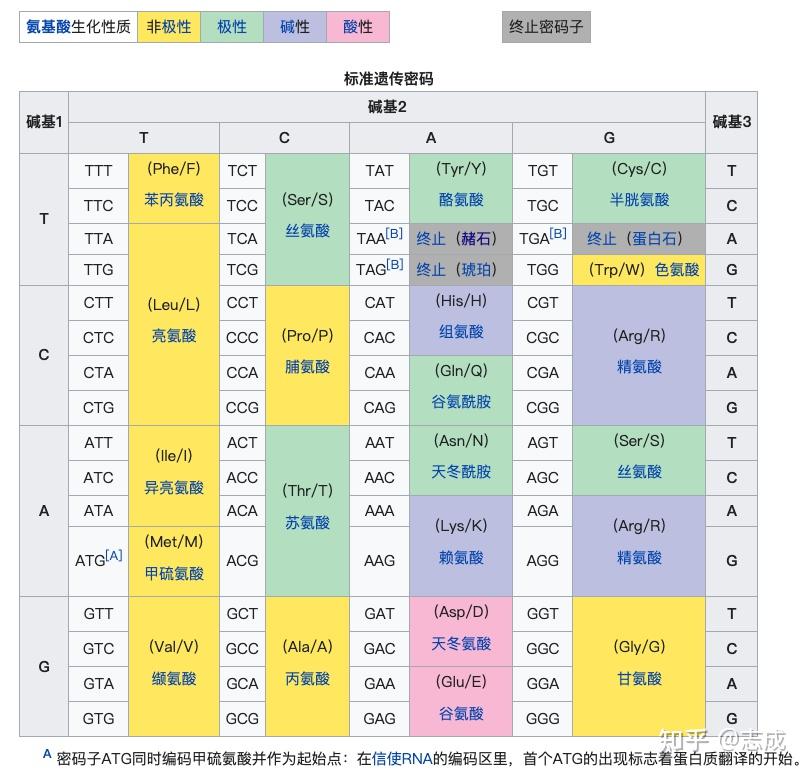
遗传密码的性质
- 连续性:翻译从5‘端起始密码子开始,到3’端终止密码子结束,无间断也无重叠
- 简并性:多个密码子编码同一个氨基酸,对应同一氨基酸的密码子称为同义密码子。简并密码子可减少变异对生物的影响,也可减少tRNA的种类
- 通用性:遗传密码对所有生物无论体内体外都适用,只有极少数例外
摆动假说:在密码子与反密码子配对时,第三个碱基允许有一定的自由度(G-U、I-U、I-A、I-C配对)
tRNA
tRNA为每个三联体密码子翻译成氨基酸提供了接合体,还是氨基酸运输到核糖体的载体。因此tRNA被称为第二遗传密码
tRNA的共同特征:
- 存在经过特殊修饰的碱基
- 3‘端都以CCA-OH结束,该位点是tRNA与相应氨基酸结合的位点
氨基酸在合成蛋白质之前必须通过AA-tRNA合成酶活化,在消耗ATP的情况下结合到tRNA上,生成和蛋白质结合的AA-tRNA
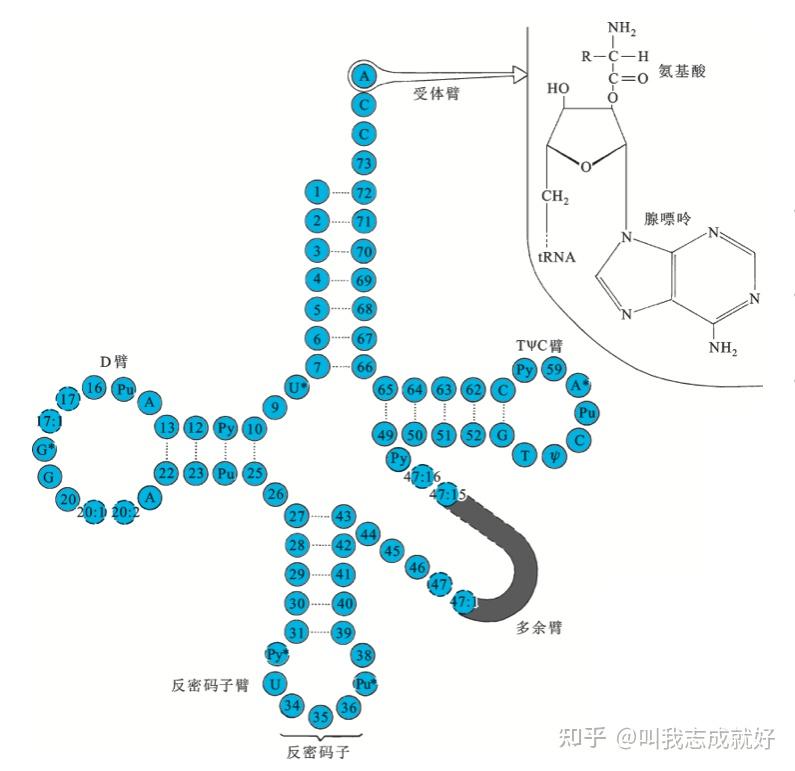
tRNA的三叶草二级结构
由于小片段碱基互补配对,三叶草形tRNA分子上有四条根据它们的结构或已知功能命名的手臂:
- 受体臂(acceptor arm):是氨基酸的结合位点。主要由链两端序列碱基配对形成的杆状结构和3‘端未配对的3~4个碱基所组成,其3’端最后三个碱基永远是CCA序列。最后一个碱基的3‘或2’自由基(-OH)可以被酰胺化(连接氨基酸)。其余手臂均由碱基配对产生的杆状结构和无法配对的套索结构所组成。
- TψC臂:根据三个核苷酸命名,ψ表示拟尿嘧啶,是tRNA分子所拥有的不常见核苷酸
- 反密码子臂:根据套索中央的三联反密码子命名。反密码子的两端由5‘端尿嘧啶和3’端嘌呤界定
- D臂:根据它含有二氢尿嘧啶命名
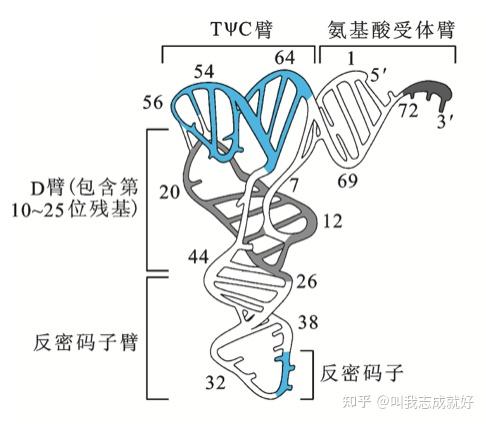
tRNA的L-形三级结构
tRNA的三级结构与AA-tRNA合成酶对tRNA的识别有关
tRNA种类
- 起始tRNA和延伸tRNA
- 能特意识别mRNA模版上起始密码子的tRNA称为起始tRNA,原核生物起始tRNA携带甲酰甲硫氨酸(fMet)真核生物携带甲硫氨酸(Met)
- 其他tRNA统称为延伸tRNA
- 同工tRNA
- 携带相同氨基酸的tRNA称为同工tRNA,同工tRNA用相同的氨酰tRNA合成酶
- 同工tRNA结构相似,以便被AA-tRNA合成酶识别
氨酰tRNA合成酶
氨酰tRNA聚合酶是一类催化氨基酸和tRNA3‘端连接的特异性酶
反应:AA + tRNA + ATP -> AA-tRNA + AMP + PPi
- 第一步:氨基酸活化生成 酶-氨基酰腺苷酸 复合物
- AA + ATP + 酶(E) -> E-AA-AMP + PPi
- 第二步:氨酰基转移到tRNA3‘端腺苷残基的2’或3‘羟基上(-OH)
- E-AA-AMP + tRNA -> AA-tRNA + E + AMP
核糖体
核糖体:指导蛋白质合成的大分子机器,由几十种蛋白质和机制rRNA组成的亚细胞颗粒,可游离于细胞内,也可于内质网结合,形成微粒体。
核糖体结构
沉降系数(Svedberg)「S,S值越大,沉降系数越大,它用形状大小共同决定,不是质量的衡量标准
核糖体由两个亚基构成:大亚基沉降系数50S,小亚基沉降系数30S
核糖体蛋白约占原核细胞总蛋白量大10%,站细胞内总RNA量的80%,真核细胞占比有所下降,但占比也很高。原核生物核糖体RNA与蛋白质的比值为2:1;真核生物为3:2
核糖体上有很多活性中心,每个活性中心都有一组特殊的核糖体蛋白(r-蛋白)构成
核糖体3个tRNA结合位点
- A位点:新到来的氨酰tRNA的结合位点
- P位点:肽酰tRNA结合位点
- E位点:延伸过程中的多肽链转移到氨酰tRNA上释放tRNA到位点,即去氨酰tRNA通过E位点脱出,被释放到核糖体外的细胞质中tRNA移动顺序:A -> P -> E
核糖体RNA
- 5S rRNA:有两个高度保守区域,一个含有保守序列CGAAC,是与tRNA分子TψC环相互作用识别的部位,另一个区域含有保守序列GCGCCGAAUGGUAGU,与23S rRNA的一段序列互补,是5S rRNA与50S核糖体大亚基相互作用的位点,在结构上有其重要性
- 5.8S rRNA:真核生物核糖体大亚基特有,含有能够与tRNA作用识别序列,可能与原核生物的5S rRNA具有相似功能
- 16S rRNA:结构十分保守,3‘端一段ACCUCCUUA的保守序列,与mRNA 5’端翻译起始区富含嘌呤的序列互补,3‘端处还有一段与23S rRNA互补的序列,在30S与50S亚基的结合中起作用
- 18S rRNA:3‘端与大肠杆菌16S rRNA有广泛同源性
- 23S rRNA:能催化肽键的形成,与处于A和P位点的tRNA的CCA末端之间的碱基配对,帮助氨酰tRNA的α氨基基团攻击结合于肽酰tRNA多肽上的羰基,并稳定入位后的氨酰tRNA
- 28S rRNA:目前不清楚其具体功能
核糖体功能
核糖体包括多个活性中心,即mRNA结合部位、结合AA-tRNA部位(A位点)、结合受体肽酰tRNA的部位(P位点)、肽基转移部位及形成肽键的部位(转肽酶中心)、负责肽链延伸的各种延伸因子的结合位点
- 核糖体小亚基负责对模版mRNA进行序列特异性识别,mRNA结合位点也在此亚基上
- 正常细胞可能通过调整特定核糖体的数量来控制蛋白质的表达量。这是蛋白质表达调控的新途径
蛋白质合成的生物学机制
蛋白质的生物合成包括氨基酸活化,肽链的起始、伸长、终止以及新合成多肽链的折叠和加工
氨基酸的活化
- 氨基酸必须在氨酰tRNA合成酶的作用下生成活化氨基酸AA-tRNA
至少纯在20种以上具有氨基酸专一性的氨酰tRNA合成酶,能识别并通过氨基酸的羧基与tRNA3‘端腺苷酸核糖基上3’-OH缩水形成二酯键,同一氨酰tRNA合成酶具有把相同氨基酸加到两个或更多带有不同反密码子tRNA分子上的功能 。
真核生物中,任何一个多肽合成都是从生成甲硫氨酸氨酰-tRNAifMrt开始的,因为甲硫氨酸的特殊性,所以体内存在两种tRNAMet。只有甲硫氨酰-tRNAifMrt才能与40S小亚基相结合,起始肽链合成
翻译起始
起始复合物的生成除了需要GTP提供能量外,还需要Mg2+、NH42+及3个起始因子(IF-1、IF-2、IF-3)起始因子与30S小亚基的结合较为松散,用1mol/L NH4Cl处理即可使之游离。
原核生物转录起始
细菌翻译起始需要如下7种成分
- 30S小亚基
- 模版mRNA
- fMet-tRNAfmet
- 3个翻译起始因子IF-1,IF-2,IF-3
- GTP
- 50S大亚基
- Mg2+
翻译起始可分为三步
- 30S小亚基首先与翻译起始因子IF-1,IF-3,结合,通过SD序列与mRNA模版结合
- 在IF-2和GTP的帮助下fMet-tRNAfMet进入小亚基的P位,tRNA上的反密码子与mRNA上的起始密码子配对
- 带有tRNA、mRNA、3个翻译起始因子的小亚基复合物与50S大亚基结合,GTP水解,释放翻译起始因子
30S亚基具有专一性识别和选择mRNA起始位点的性质,而IF-3能协助该亚基完成这种选择
30S亚基通过其16S rRNA的3‘端与mRNA 5’端起始密码子上游碱基配对结合
几乎所有原核生物mRNA上都有一个5‘-AGGAGGU-3’序列,这个富嘧啶区命名为SD序列,它与30S亚基上16S rRNA 3‘端的富嘧啶区序列5’-GAUCACCUCCUUA-3'相互补
只有fMet-tRNAfMet能与第一个P位点相结合,其他所有tRNA都必须通过A位点到达P位点,再由E位点离开核糖体
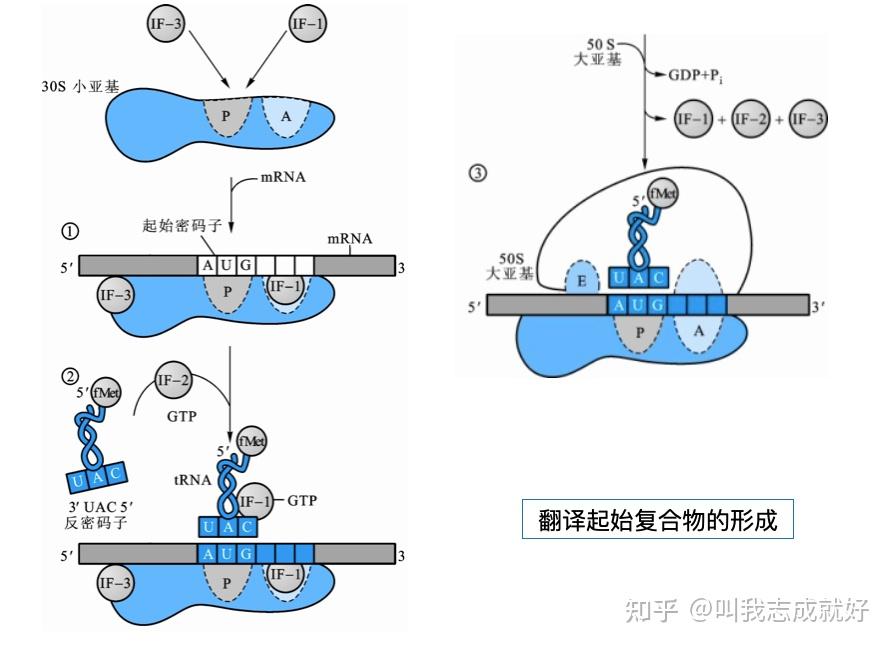
真核生物翻译起始
真核生物翻译起始机制与原核生物基本相同,其主要差异为:
- 核糖体较大,有较多起始因子参与
- 5’帽子和3‘多A参与形成翻译起始复合物
- Mer-tRNAMet不甲酰化
- 需要消除二级结构
肽链延伸
肽链延伸由许多循环组成,每加一个氨基酸就是一个循环,每个循环包括AA-tRNA与核糖体结合肽键生成和位移
后续AA-tRNA与核糖体结合
起始复合物形成之后,第二个AA-tRNA在延伸因子EF-Tu端作用下,生成AA-tRNA·EF-Tu·GTP复合物,然后结合到核糖体的A位上。这时GTP被水解释放,通过延伸因子EF-Ts再生GTP,形成EF-Tu·GTP,进入新一轮循环
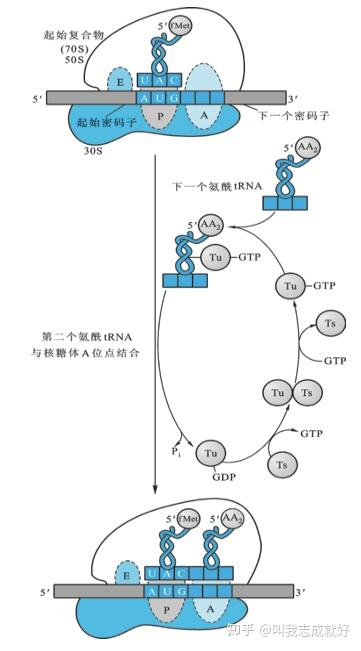
肽键生成
经过上一步反应后,在核糖体·mRNA·AA-tRNA复合物中,AA-tRNA占据A位,fMet-tRNAfMet占据P位。在肽基转移酶的催化下,A位上的AA-fMet-tRNAfMet占据P位,与fMet-tRNAfMet上的氨基酸生成肽键,起始tRNA在完成使命后离开核糖体P位点,A位点准备接受新的AA-tRNA,开始下一轮反应
移位
肽链延伸过程最后一步反应是移位,即核糖体向mRNA 3‘端方向移动一个密码子,核糖体通过EF-G介导的GTP水解所提供的能量向mRNA模版3’端移动一个密码子,使二肽酰tRNA2完全进入P位,去氨酰tRNA被挤入E位,mRNA上的第三位密码子则对应于A位。EF-G移位所必须的蛋白质因子,移位的能量来自另一分子GTP水解
肽链延伸是由许多个这样的反应组成,原核生物中每次反应共需3个延伸因子,EF-Tu、EF-Ts、EF-G,它们都具有GTP酶的活性,EF-Tu和EF-Ts能够促进AA-tRNA进入A位,EF-G则促进移位和卸载tRNA的释放
真核生物则需要EF-1(对应EF-Tu和EF-Ts)及EF-2(相当于EF-G)消耗两个GTP,向生长中的肽链加上一个氨基酸肽链终止
当终止密码子UAA、UAG、UGA出现在核糖体的A位时,没有相应的AA-tRNA与之结合结合,而释放因子(RF)能识别这些密码子并与之结合,水解P位点上多肽链与tNRA之间的二酯键。接着,新生的肽链和tRNA从核糖体上释放,核糖体大、小亚基解体,蛋白质合成结束
释放因子RF具有GTP酶活性,它催化GTP水解,使肽链与核糖体解离
两类释放因子
- I类释放因子:识别终止密码子,并能催化新合成的多肽链从P位点的tRNA中水解释放出来
- II类释放因子:在多肽链释放后刺激I类释放因子从核糖体中解离出来
原核细胞内存在3种不同的释放因子(RF1、RF2、RF3)RF1和RF2为I类释放因子。RF1识别uAG和UAA,RNA2识别UGA和UAA。
一旦RF与终止密码子相结合,诱导肽基转移酶把一个水分子加到延伸的肽链上。RF3为II类释放因子,与核糖体的解体有关
真核细胞的I类和II类释放因子分别只有一种,eRF1和eRF3.I类释放因子eRF1能识别3个终止密码子核糖体循环
- mRNA和起始tRNA结合在小亚基上,随后小亚基-mRNA复合物吸引大亚基结合,形成完整并结合mRNA的核糖体,蛋白质合成开始
- 核糖体从一个密码子移位到另一个密码子,活化tRNA进入核糖体的解码的肽基转移酶中心
- 核糖体遇到终止密码子,已合成的多肽链被释放出来,核糖体大、小亚基分离
- 已分离的亚基就可以结合到新的mRNA分子上,开始下一轮蛋白质合成的循环
- 体外反应体系中,核糖体的解离或结合取决于离子浓度,在大肠杆菌,Mg2+浓度在 10-3mol/L 以下时70S解离为亚基,浓度达 10-2 时则形成稳定的70S颗粒
蛋白质翻译过程总览
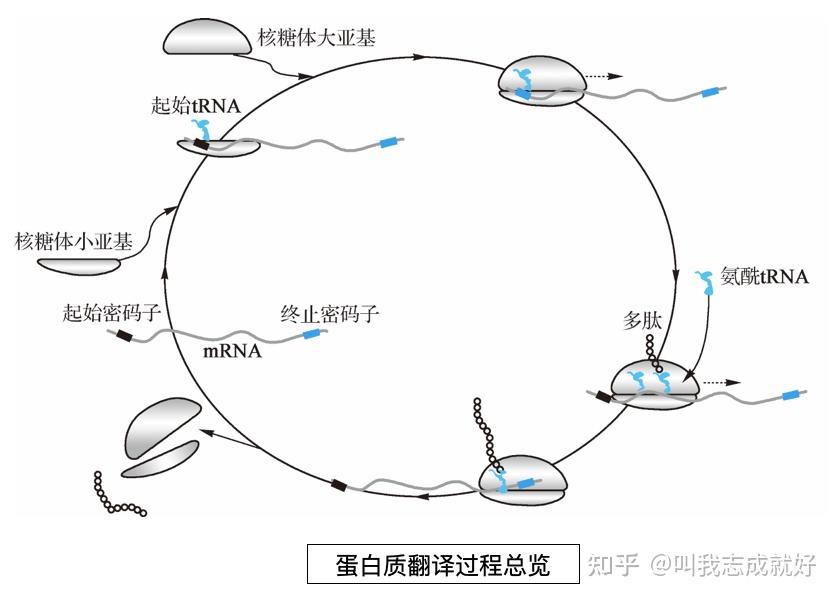
多核糖体与蛋白质合成
忽然抬头一次只能合成一条多肽,但每个mRNA分子却能同时被多个核糖体同时进行翻译,结合多个核糖体的mRNA称为多核糖体(polyribosome)
真核生物和细菌都利用多核糖体,但细菌的转录和翻译在同一空间进行,在转录开始不久就开始合成蛋白质,所以细菌中的蛋白质合成效率更高
蛋白质前体加工
新生的多肽链大多数没有功能,必须经过加工修饰才能转变为有活性的蛋白质
N段fMet或Met切除
- 细菌蛋白质氨基端端甲酰基能被脱甲酰化酶水解,不管是原核生物还是真核生物,N段的甲硫氨酸往往在多肽链合成完毕之前就被切除
- 有些动物病毒如脊髓灰质炎病毒的mRNA可翻译成很长的多肽链,含多种病毒蛋白,经蛋白酶在特定位置上水解后得到几个有功能的蛋白质分子
二硫键形成
- mRNA中没有胱氨酸的密码子,而不少蛋白质都含有二硫键,这时蛋白质合成后通过两个半胱氨酸氧化作用生成的
- 二硫键的正确形成对稳定蛋白的天然构象具有重要作用
特定氨基酸的修饰
- 磷酸化(phosphorylation):主要由多种蛋白激酶催化,发生在丝氨酸、苏氨酸、酪氨酸等3种氨基酸等侧链
- 糖基化(glycosylation):是真核细胞蛋白质的特征之一,大多数糖基化是由内质网中的糖基化酶催化进行,所有分泌蛋白和膜蛋白几乎都是糖基化蛋白质
- 甲基化(methylation):是由甲基转移酶催化,甲基化包括发生在Arg、His和Gln的侧基的N-甲基化以及Glu和Asp侧基的N-甲基化以及Glu和Asp侧基的O-甲基化
- 乙酰化(acethlation):发生在赖氨酸侧链上的ε-NH2,由乙酰基转移酶催化
- 泛素化和类泛素化修饰(ubiquitination & ubiquitin-like modifications):发生在赖氨酸残基侧链上,由E1、E2和E3一系列酶催化
切除新生肽链中的非功能片段
- 新合成的胰岛素前体是前胰岛素原,必须先切去信号肽变成胰岛素原,再切去B肽才变成有活性的胰岛素。不少多肽类激素和酶的前体都要经过加工才能变为活性分子,如:血纤维蛋白原、胰蛋白酶原经过加工切去部分肽段才能成为有活性的血纤维蛋白、胰蛋白酶
- 一般来说,由多个肽链及其他辅助成分构成的蛋白质,在多肽链合成后还需经过多肽链之间以及多肽链与辅基之间的聚合过程,才能成为有活性的蛋白质
蛋白质折叠
由核糖体核糖体合成的所有新生肽链必须通过正确的折叠才能形成动力学和热力学稳定的三维构像,从而表现出生物学活性或功能
- 对于单链多肽蛋白质,三级结构就已具有蛋白质的功能
- 对于寡聚蛋白质一般需要进一步组装成更复杂的四级结构,才能表现出天然蛋白的活性或功能
分子伴侣
是一列序列上没有相关性但有共同功能的保守性蛋白质,它们在细胞内能帮助其他多肽进行正确的折叠、组装、转运和降解
目前认为细胞内至少有两类分子伴侣家族:
- 热休克蛋白:是一类应激反应性蛋白,包括HSP70、HSP40、GrpE三个家族。广泛存在于原核及真核细胞中。三者协调作用,促使某些能自发折叠的蛋白质正确折叠形成天然构象
- 伴侣素:伴侣素包括HSP60和HSP10(原核细胞中的同源物分别为GroEL和GroES)它是为非自发性折叠蛋白提供折叠形成天然结构的微环境
分子伴侣在新生肽链折叠中主要通过防止或消除肽链的错误折叠,增加功能性蛋白质折叠率来发挥作用,而非加快折叠反应速度。分子伴侣本身并不参与最终产物的形成
蛋白质合成抑制剂
蛋白质生物合成抑制剂主要是一些抗生素,如嘌呤霉素、链霉素、四环霉素、氯霉素、红霉素等;此外,如5-甲基色胺酸、环己亚胺、白喉毒素、干扰素、蓖麻蛋白和其他核糖体灭活蛋白等都可以抑制蛋白质等合成
抗生素对蛋白质合成的作用
- 阻止mRNA与核糖体结合(氯霉素)
- 阻止AA-tRNA与核糖体结合(四环素类)
- 干扰AA-tRNA与核糖体结合而产生错读(链霉素、新霉素、卡那霉素等)
- 作为竞争性抑制剂抑制蛋白质合成
不同抗生素等靶标以及所产生的后果
| 抗生素 / 毒素 | 目标细胞 | 分子目标 | 后果 | | 氯霉素 | 原核细胞 | 50S亚基的肽酰转移酶中心 | 阻断A位点的氨酰tRNA为进行肽基转移反应的正确定位 | | 四环素 | 原核细胞 | 30S亚基A位点 | 已知氨酰tRNA结合到A位点 | | 潮霉素 | 原核和真核细胞 | 30S亚基A位点附近 | 阻挠A位点他RNA到P位点的移位 | | 嘌呤霉素 | 原核和真核细胞 | 大亚基的肽酰转移酶中心 | 链终止子;模仿A位点的氨酰tRNA的3‘端,作为新的多肽链的接受者 | | 红霉素 | 原核细胞 | 50S亚基的多肽出口通道 | 阻断成长中的多肽链从核糖体的出口,阻遏翻译 | | 青霉素 | 原核细胞 | 肽葡萄糖转肽酶 | 抑制细菌细胞壁的合成 | | 链霉素 | 原核和真核细胞 | 作用于30S亚基 | 干扰氨酰tRNA与核糖体结;导致mRNA错读 | | 卡那霉素 | 原核细胞 | 作用于30S核糖体亚基 | 干扰氨酰tRNA与核糖体的结合,使细菌蛋白质合成发生错误 | | 白喉毒素 | 真核细胞 | 化学修饰EF-Tu | 已知肽酰转移酶活性 | | 放线菌酮 | 真核细胞 | 60S亚基的肽酰转移酶中心 | 抑制转肽酶活性 | | 蓖麻毒素 | 原核和真核细胞 | 60S亚基的肽酰转移酶中心 | 阻挠翻译因子GTP活化 |
蛋白质转运机制
蛋白质转运可分为两大类:
- 翻译转运同步机制:蛋白质的合成和转运同时发生
- 翻译后转运机制:蛋白质从核糖体上释放后才发生转运
| 蛋白质性质 | 转运机制 | 主要类型 | | 分泌 | 蛋白质在结合核糖体上合成,并以翻译转运同步机制运输 | 免疫球蛋白、卵蛋白、水解酶、激酶等 | | 细胞器 | 蛋白质在游离核糖体上合成,以翻译后转运 | 核、叶绿体、线粒体、乙醛酸循环体、过氧化物酶体等 | | 发育 | 机制运输 | 细胞器中的蛋白质 | | 膜的形成 | 两种机制兼有 | 质膜、内质网、类囊体中的蛋白质 |
翻译运转同步机制
信号肽假说的基础:蛋白质定位的信息存在于该蛋白质自身结构中,并且通过与膜上特殊受体的相互作用得以表达
信号序列:在起始密码子后,编码疏水性氨基酸序列的RNA区域
信号序列在结合核糖体合成后便与膜上特定受体相互作用,产生通道,允许这段多肽在延长的同时穿过膜结构,这种方式是边翻译边跨膜运转
绝大部分被运入内质网内腔的蛋白质都带有一个信号肽,该序列常常位于蛋白质的氨基端,长度一般为13~36碱基,有如下三个特点:
- 一般带有10~15个疏水氨基酸
- 在靠近该序列N段常常有1个或数个带正电荷的氨基酸
- 在其C端靠近蛋白酶切位点处带有数个极性蛋白信号肽在蛋白质运输过程中发挥的作用
- 完整的信号肽是保证蛋白质运转的必要条件
- 仅有信号肽还不足以保证运转的发生
- 信号序列的切除并不是运转所必须的
- 并非所有运转蛋白都可降解信号肽
新生肽向内质网内腔转运过程
SRP(信号识别蛋白)和DP(停靠蛋白,又称SRP受体蛋白)介导了蛋白质的跨膜运转过程
- SRP能同时识别正在合成需要通过内质网膜进行运转的新生肽和自由核糖体,它与这列核糖体上新生蛋白的信号肽结合是多肽正确运转的前提,但同时也导致了该多肽合成的暂时终止(此时新生肽一般长约70个残基)
- SRP-信号肽-多核糖体复合物即被引向内质网膜并与SRP的受体-DP相结合
- 只有当SRP与DP相结合时,多肽合成才恢复进行,信号肽部分通过膜上的核糖体受体及蛋白运转复合物跨膜进入内质网内腔,新生肽链重新开始延伸
- 整个蛋白质跨膜以后,信号肽被水解,形成高级结构和成熟型蛋白质,并被运送到相应的细胞器
- SRP与DP的结合会导致受体聚集而形成膜孔道,使信号肽及其相连的新生肽得以通过。此时,SRP与DP相分离并恢复游离状态。待翻译过程结束后,核糖体的大、小亚基解离,受体解聚,通道消失,内质网膜也恢复完整的脂双层结构
- 进入内质网内腔后,蛋白质常以运转载体的形式被送入高尔基体形成转运小泡,分别运送到各自的亚细胞位点
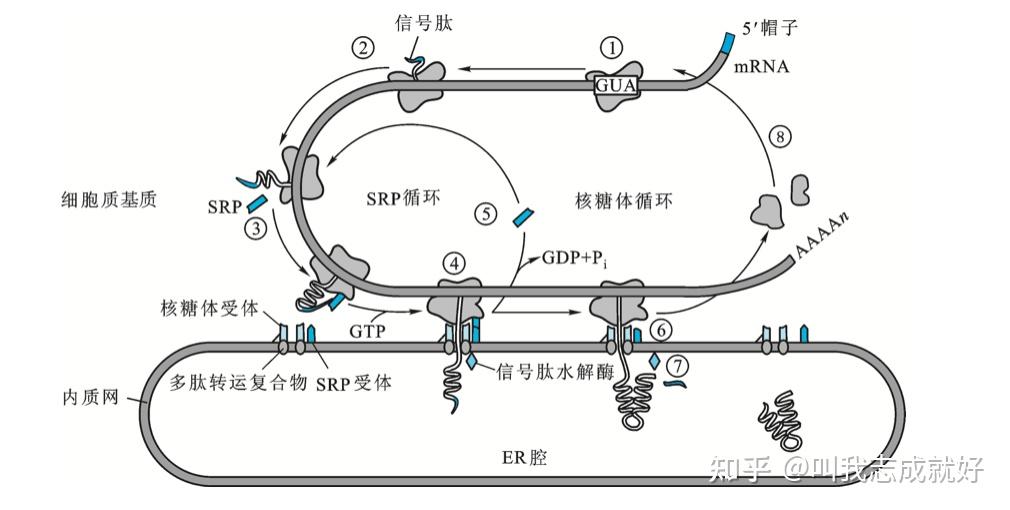
新生蛋白质通过同步运转途径进入内质网内腔的主要过程
1、核糖体组装、翻译起始
2、位于蛋白质N端端信号肽序列首先被翻译
3、SRP与核糖体、GTP以及带有信号肽的新生蛋白质相结合,暂时终止肽链延伸
4、核糖体-SRP复合物与膜上的受体相结合
5、GTP水解,释放SRP并进入新一轮循环
6、肽链重新开始延伸并不断向内腔运输
7、信号肽被切除
8、多肽合成结束,核糖体解离并恢复到翻译起始前状态翻译后运转机制
叶绿体和线粒体中许多蛋白质和酶使由细胞质提供,其中绝大多数以翻译后运转机制进入细胞内
线粒体蛋白质跨膜运转
大部分线粒体蛋白质都是由核DNA编码,在细胞质核糖体上合成,被释放至细胞质后,在跨膜运转到线粒体各部分
该过程特征:
- 通过线粒体膜的蛋白质在运转之前大多以前体形式存在,它由成熟蛋白质和位于N端的一段前导肽共同组成,当前体蛋白通过膜时,前导肽被一种或两种多肽酶所水解,释放成熟的蛋白质
- 蛋白质通过线粒体内膜的运转时一种需要能量的过程
- 蛋白质通过线粒体膜运转时,首先由外膜上的Tom受体复合蛋白识别与HSP70或MSF等分子伴侣相结合的待运转多肽,通过Tom和Tim组成的膜通道进入线粒体内腔
- 蛋白质跨膜运转时的能量来自线粒体HSP70引发的ATP水解和膜电位差
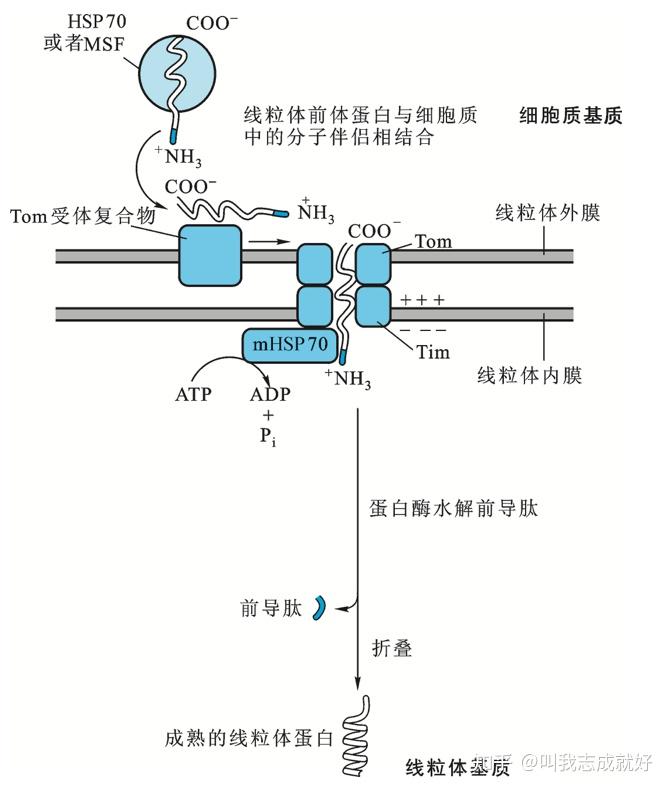
前导肽的作用与性质
拥有前导肽的线粒体蛋白质前体能够跨膜运转进入线粒体,在这一过程中前导肽被水解,前体转变为成熟蛋白,失去继续跨膜的能力
前导肽特性:
- 带正电的碱性氨基酸含量比较丰富,分散于不带电荷的氨基酸序列间
- 缺少带负电的酸性氨基酸
- 丝氨酸含量较高
- 有形成α-螺旋的能力
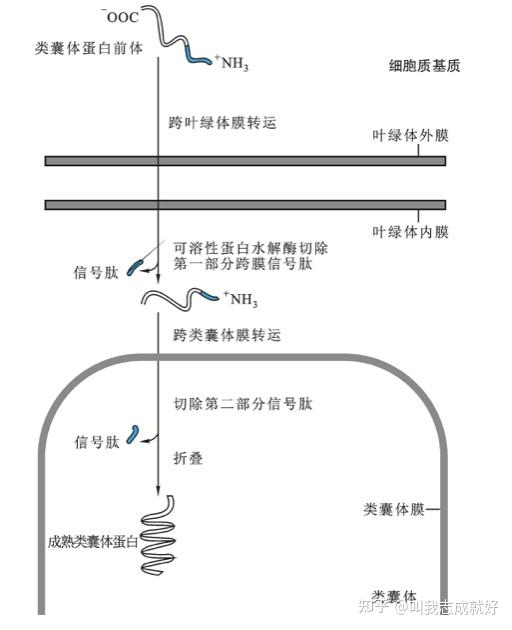
叶绿体蛋白质的跨膜运转
叶绿体多肽:胞质中的游离核糖体上合成后脱离核糖体并折叠成具有三级结构的蛋白质分子
叶绿体信号肽一般有两部分:一部分决定改蛋白质能否进入叶绿体基质;另一部分决定该蛋白质能否进入类囊体
叶绿体蛋白质运转过程的特点
- 活性蛋白水解酶位于叶绿体基质内
- 叶绿体膜能够特异的于叶绿体蛋白前体结合
- 叶绿体蛋白前体内的可降解序列会因为植物和蛋白质种类不同而表现出明显的差异
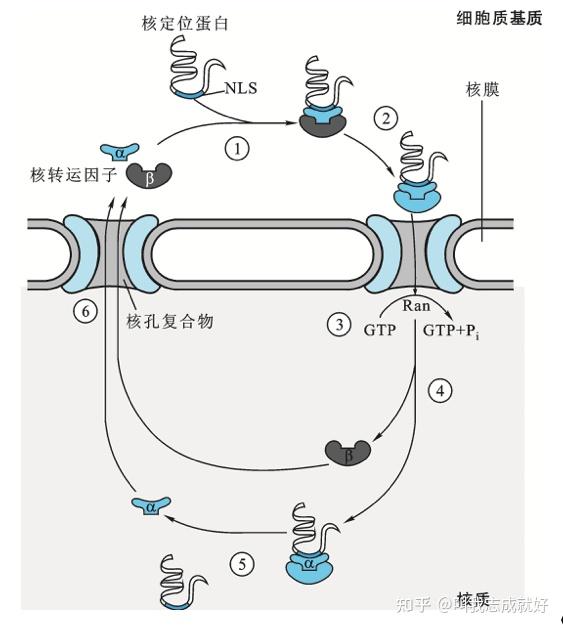
核定位蛋白的转运机制
所有核糖体蛋白都首先在细胞质中被合成,运转到细胞核内,在核仁中被装配成40S和60S核糖体亚基,然后运转回到细胞质中行使作为蛋白质合成机器到功能。RNA、DNA聚合酶、组蛋白、拓扑异构酶及大量转录、复制调控因子都必须从细胞质进入细胞核才能正常发挥功能
真核细胞核膜上的核孔复合体(nuclear pore complex,NPC)是细胞核内外进行物质交换的主要通道,相对分子质量较小的蛋白质可自由通过NPC或采取被动扩散的方式进出细胞核,而相对分子质量大于4*104的蛋白质需要通过主动运输进出细胞核。以这种方式进出细胞核的蛋白质需要在其氨基酸序列上带有特殊的核定位信号序列(NLS,nuclear localization signal)和出核信号序列(NES,nuclear export signal)才能被相应的核运转蛋白识别
入核信号与前导肽的区别:
1、由含水的核通道来鉴别
2、入核信号是蛋白质的永久性部分,在引导入核的过程中不被切除,有利于细胞分裂后核蛋白重新入核
蛋白质修饰、降解与稳定性研究
- 生物体内蛋白质的降解过程是一个有序的过程
- 在大肠杆菌中,蛋白质的降解是通过依赖ATP的蛋白酶(Lon)实现。当细胞中出现错误的蛋白质或半衰期很短的蛋白质时,该酶就被激活。Lon蛋白酶每切除一个肽键要消耗两分子ATP
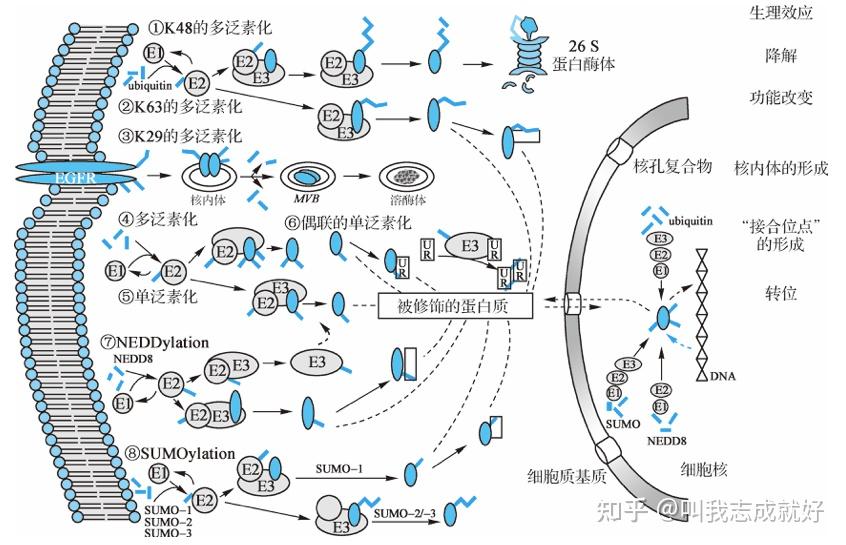
泛素化修饰介导蛋白质降解
在真核生物中,除了通过溶酶体以及自噬通路,蛋白质的降解主要依赖于泛素蛋白(ubiquitin)
泛素只有76个氨基酸残基,序列高度保守(从酵母核人细胞中的泛蛋白几乎完全相同)泛素化指在泛素激活酶、结合酶、连接酶等的作用下,泛素C端甘氨酸残基通过酰胺键与底物蛋白的赖氨酸残基的ε氨基结合,对靶蛋白进行特异性修饰的过程。在蛋白质分子的一个位点上可以结合单个或多个泛素分子。泛素化是一个可逆的过程,可以在去除泛素化酶(DUB)的作用下去除底物(S)上的泛素化修饰
泛素化/去泛素化修饰及其在蛋白质降解和细胞生理功能中的调节作用
泛素化修饰涉及泛素激活酶E1、泛素结合酶E2、泛素连接酶E3等3个酶等级联反应
- 在ATP提供能量的情况下,泛素激活酶E1黏附在泛素分子尾部的Cys残基上激活泛素
- E1酶将激活的泛素分子转移到泛素结合酶E2上
- E2酶和一些种类不同泛素连接酶E3酶共同识别靶蛋白,对其进行泛素化修饰
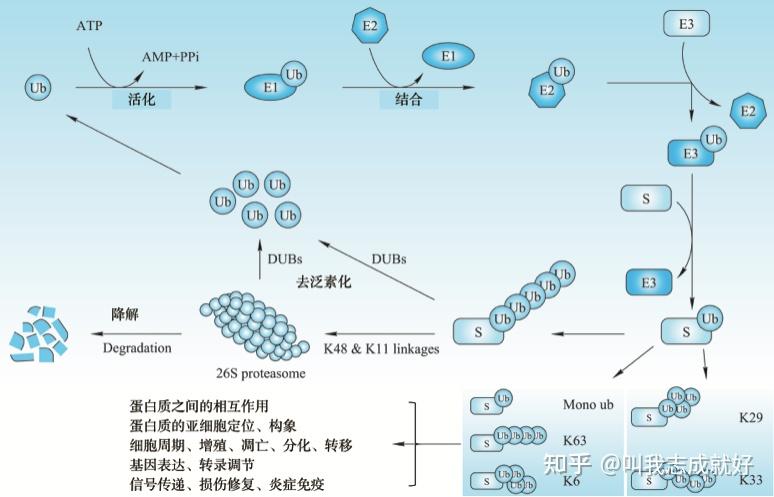
K11和K48位的多泛素化修饰使蛋白质通过26S蛋白酶体降解;K63、K29位等的泛素化修饰不是蛋白质发生降解,而是参与细胞众多生理过程的调节
蛋白质的SUMO化修饰
细胞内存在一些与泛素化修饰相类似的反应,称为类泛素化修饰如SUMOylation(小泛素化修饰,SUMO化修饰)和NEDDylation等
小泛素相关修饰物(small ubiquitin-related modifier,SUMO)是泛素类蛋白家族的重要成员之一,由98个氨基酸组成,进化上高度保守
SUMO阻碍泛素对底物蛋白的共价修饰,提高了底物蛋白的稳定性。
蛋白质的NEDD化学修饰
NEDD8能像泛素一样在体内固有酶簇作用下被共价键结合到底物蛋白上,参与蛋白质翻译后修饰,这一过程被称为NEDD化修饰。NEDD8含有81个氨基酸,是一类泛素蛋白修饰分子,与泛素分子的一致性为59%相似性高达80%其相似程度是众多类泛素分子中最高的。
蛋白质的泛素化和类泛素化修饰的生理效应
思考题
- 遗传密码的破译是20世纪60年代分子生物学最辉煌的成就,先后经历了50年代的数学推理阶段和1961—1965年的实验研究阶段。
- 1954年物理学家 George Gamow 根据在DNA中存在四种核苷酸,在蛋白质中存在20种氨基酸的对应关系,通过数学推理,得出三个核苷酸编码一个氨基酸。1961年 Brenner 和 Grick 根据 DNA 链与蛋白质链的共线性(colinearity),首先肯定了三个核苷酸的推理。随后用各种人工合成的核苷酸均聚物或共聚物模板在体外翻译蛋白质的方法确定遗传密码子。1964年Nirenberg和Leder用核糖体结合技术测定密码子中的核苷酸排列顺序,历经4年时间,最终确定了编码20种天然氨基酸的密码子,编出了遗传密码字典。70年代以来,分子生物学技术如 DNA、RNA 序列测定及氨基酸序列测定技术的进步,使遗传密码的存在得到验证。
- 遗传密码有哪些特性?说出遗传密码简并性的生物学意义。
- 遗传密码的特性有方向性、连续性、简并性、摆动性、通用性与特殊性。
- 方向性:遗传密码是三联子密码,即密码子(codon),1个密码子由3个核苷酸组成,它特异性地编码多肽链中的1个氨基酸;密码子是对mRNA分子的碱基序列而言的,它的阅读方向是与mRNA的合成方向或mRNA编码方向一致,即从5端至3端。
- 连续性:mRNA的读码方向从5端至3端方向,两个密码子之间无任何核苷酸隔开。mRNA链上碱基的插入、缺失和重叠,均造成移码突变(frame—shiftmutation)。
- 简并性(degeneracy):指一个氨基酸具有两个或两个以上的密码子,61个密码子编码20种氨基酸,多数氨基酸有2~4个密码子。同一氨基酸的不同密码子称为同义密码子(synonyms codon),密码虽有简并性,但它们使用的频率并不相等,有的密码子使用的机会较多,有的几乎不用。
- 摆动性,mRNA上的密码子与转移RNA(tRNA)上的反密码子配对时,大多数情况遵守碱基互补配对原则,但也可出现不严格配对,尤其是密码子的第三位碱基与反密码子的第一位碱基配对时常出现不严格碱基互补,这种现象称为摆动配对。1966年Crck根据立体化学原理提出摆动学说(wabble hypothesis), 解释了反密码子中某些稀有成分(如I)的配对以及许多氨基酸有2个以上密码子的问题。
- 通用性与特殊性,蛋白质生物合成的整套密码,从原核生物到人类都通用。但已发现少数例外,如动物细胞的线粒体、植物细胞的叶绿体中的密码子有特殊性。
- 密码子有起始密码子和终止密码子,蛋白质合成的起始和终止信号含在密码子中,无论在真核生物还是在原核生物中AUG(Met)都是用作起始密码子,但在少数情况下也用GUG。遗传密码表中有3个终止密码子(stop code),称为无义密码子(nonsense codons)或链终止密码子(chain-terminating codons)。 终止密码子没有相应的tRNA存在,只供释放因子识别来实现翻译的终止。
- 遗传密码简并性的生物学意义:
- 减少变异对生物的影响,对生物物种的稳定有一定意义。
- 简并性除了能降低突变所造成的损害外,还可减少所需的tRNA种类。密码子共有64种,但并不需64种tRNA。
- 有三种,即UAA、UGA和UAG。UAA叫赭石密码,UAG叫琥珀密码,UGA叫蛋白石密码。
- tRNA 是由73~93个核苷酸组成的单股 RNA,有利于与单股的模板mRNA 进行酮基和氨基反应,形成氢键。它含大量稀有碱基,如假尿嘧啶核苷(ψ),各种甲基化的嘌呤和嘧啶核苷,二氢尿嘧啶(hU或D)和胸腺嘧啶(T)核苷等。
- 所有的tRNA均有类似的三叶草结构,结构的共同特点如下:
- 一般由4臂4环组成,以76nt的tRNA分子为标准,超过76nt的tRNA增加的核苷酸位于17位20位和47位,均位于分子的单链环部分。
- 3端氨基酸接受臂:5端1~7位与3端66~72位形成7bp的氨基酸臂,3端有共同的CCA—OH序列,因为该序列是单股突伸出来,并且氨基酸总是接在该序列腺苷酸残基(A)上,所以CCA—OH序列称为氨基酸接受臂(amino acidacceptor arm)。CCA通常接在3端第4个可变核苷酸上。
- TψC环(TψCloop):TyC环是第一个环,由7个不配对的核苷酸残基组成,几乎总是含5'GTwC3'序列。该环涉及 tRNA 与核糖体表面的结合,有人认为GTwC序列可与5SrRNA的GAAC序列识别。
- 额外环或可变环(extro variable loop):位于44~48位,这个环的碱 基种类和数量高度可变,有80%的tRNA可变环由4~5nt组成,20%的由13~21nt组成,富有稀有碱基
- 反密码子环(anticodon loop)与反密码子臂(anticodon arm):第27~ 43位有5bp的反密码子臂和7nt的反密码子环组成。其中34~36位是与mRNA相互作用的反密码子。毗邻反密码子的3'端碱基往往为烷基化修饰嘌呤,其5'端为U,即:—U—反密码子—修饰的嘌呤。
- 二氢尿嘧啶环(dihydrouracil loop)/D环(D-loop):第10~25位形 成3~4bp的臂和8~14nt的环。由于环上有(2+1或2—1)个修饰的二氢尿嘧啶(D),故称为二氢尿嘧啶环或D环。相应的臂称为D臂。
- tRNA 分子中含有多少不等的修饰碱基,某些位置的核苷酸在不同的tRNA分子中很少变化,称不变碱基。
- 由于tRNA的氨基酸臂上存在特定的识别密码,可以为氨酰tRNA合成酶所识别,在该酶的催化下活化相应地氨基酸,形成氨酰tRNA(在细菌中,起始氨酰tRNA是甲酰甲硫氨酸tRNAMet;真核生物中,起始氨酰tRNA是甲硫氨酰tRNAi Met),结合GTP的起始因子IF2-GTP(或延伸因子EF-Tu-GTP)与该 活化氨基酸结合形成三元复合物,该氨酰tRNA上的反密码子通过碱基互补配对的原则识别mRNA上相应的密码子,与起始复合物的P(A)位点结合(只有第一个活化的氨基酸进入P位点,链延伸过程中,氨酰RNA均进入A位点),这样就将活化的氨基酸转运至mRNA模板上。
- SD序列(Shine-Dalgarno sequence)是存在于原核生物mRNA上起始 密码子AUG上游7~12个核苷酸处的一种4~7个核苷酸的保守片段,它与16SrRNA3'端反向互补。
- SD序列的功能是将mRNA的AUG起始密码子置于核糖体的适当位置以便起始翻译。SD序列与16SrRNA序列互补的程度,以及从起始密码子AUG到嘌呤片段的距离都强烈地影响翻译起始的效率。不同基因的 mRNA 有不同的SD序列,它们与16SRNA的结合能力也不同,从而控制着单位时间内翻译过程中起始复合物形成的数目,最终控制着翻译的速度。
- 核糖体至少有5个活性中心:
- mRNA结合位点:位于核糖体30S亚基上,在肽基转移位点附近,其功能是结合mRNA和IF因子。
- AA-tRNA结合位点(Aminoacyl-tRNA site,A位点):即氨酰基位点, 是与新掺入的氨酰tRNA(aminoacyl-tRNA)结合的位点,又叫受位(entry site), 主要位于大亚基,是接受氨酰tRNA的部位。
- 肽酰-tRNA结合位点:(peptidyl-RNA Site,P位点),又叫供位(donor site),或肽酰基位点,主要位于大亚基,是与延伸中的肽酰tRNA结合位点。
- 转肽酶活性中心:位于P位和A位的连接处,是形成肽键的部位。
- 负责肽链延伸的各种延伸因子的结合位点。
- 真核生物与原核生物起始步骤基本相同,也包括核糖体的解离,小亚基起始复合物的形成和肽链起始复合物的形成。其主要区别在于:
- 真核生物起始tRNA为tRNAi Met,tRNAi Met未甲酰化,而原核生物起 始tRNA为tRNAMet,其中甲酰基是在甲酰化酶催化下加到甲硫氨酰tRNA上的。
- 原核生物的起始因子有3种,而真核生物有较多的起始因子参与。
- 在原核细胞中,mRNA首先与小亚基结合,才有起始tRNA加入形成起始复合物。而真核细胞中,起始tRNA首先结合于小亚基,形成复合物后,再在多种因子参与下结合mRNA,才形成大的起始复合物。
- 小亚基起始复合物在mRNA上寻找起始密码子的方式不同。原核细胞内,依靠小亚基内16SrRNA3'端序列与SD序列互补结合,才定位于mRNA。而真核细胞内,依靠5'帽子结构的起始因子结合小亚基,然后以滑动搜索机制寻找起始AUG
- 链霉素是一种碱性三糖,能干扰 tRNA
- Met与核糖体的结合,从而阻止蛋白质合成的正确起始,也会导致mRNA的错读。主要抑制革兰氏阴性细菌蛋白质合成的三个阶段:
- 与30S核糖体结合,抑制起始复合物的形成,使氨酰tRNA从复合物中脱落;
- 在肽链延伸阶段,使氨酰tRNA与mRNA错配
- 在终止阶段,阻碍终止因子与mRNA结合,使已合成的多肽链无法释放,而且还抑制70S核糖体的解离
- 哪些抗生素只能特异性地作用于原核生物核糖体?哪些只作用于真核生物核糖体?哪些能同时抑制原核和真核生物核糖体?
- 抗生素对蛋白质合成的抑制作用可能是阻止mRNA与核糖体的结合,或阻止AA—tRNA与核糖体结合,或干扰AA—tRNA与核糖体结合而产生错读等。但不同的抗生素作用的对象并不完全相同:卡那霉素、青霉素、四环素和红霉素只与原核细胞核糖体发生作用,从而阻遏原核生物蛋白质的合成,抑制细菌生长;放线菌酮则只作用于真核生物核糖体;而氯霉素、链霉素、蓖麻霉素和嘌呤霉素既能与原核细胞核糖体结合,又能与真核生物核糖体结合,妨碍细胞内蛋白质合成,影响细胞生长
- 分子伴侣(molecular chaperone)是细胞中一类能够识别并结合到不完全折叠或装配的蛋白质上,以帮助这些多肽正确折叠、转运或防止它们聚集的蛋白质,其本身不参与终产物的形成
- 分子伴侣的功能:
- 在蛋白合成过程中,分子伴侣能识别与稳定多肽链的部分折叠的构象,参与新生肽链的折叠与装配
- 在蛋白跨膜运送过程中,也有分子伴侣的参与,分子伴侣Hsp70家族在蛋白移位中就能打开前体蛋白的折叠,这时跨膜蛋白疏水基团外露,分子伴侣能够识别并与之结合,保护疏水面,防止相互作用而凝聚,直至跨膜运送开始;跨膜运送后,分子伴侣又参与重折叠与组装过程,分子伴侣通过恢复细胞转录与翻译,参与生物机体的应激反应
- 分子伴侣能够使未正确折叠的蛋白质或被破坏的蛋白质加速降解,保证体内环境的稳定
- 此外分子伴侣还参与生物信号转导、细胞器和细胞核结构的发生、细胞骨架的组装、细胞周期与凋亡的调控以及机体免疫等生命过程
- 什么是信号肽?它在序列组成上有哪些特点,有何功能?
- 在起始密码子后,有一段编码疏水性氨基酸序列的RNA区域,被称为信号肽序列
- 信号肽的功能是负责把蛋白质引导定位到细胞内不同膜结构的亚细胞器内。
- 该序列常常位于蛋白质的氨基末端,长度一般在13~36个残基之间,它在序列组成上的特点有:
- 一般带有10~15个疏水氨基酸
- 常常在靠近该序列N—端疏水氨基酸区上游带有1个或数个带正电荷的氨基酸
- 在其C端靠近蛋白酶切割位点处常常带有数个极性氨基酸,离切割位点最近的那个氨基酸往往带有很短的侧链(Ala或Gly)
- 线粒体:通过线粒体膜的蛋白质在运转之前大多数以前体形式存在,它由成熟蛋白质和N端延伸出的一段20~80个氨基酸的导肽(leader peptide)共同组成;蛋白质通过线粒体内膜的运转是一种需能过程;蛋白质通过线粒体膜运转时,首先由外膜上的Tom受体复合蛋白识别,再与Hsp70或MSF等分子伴侣相结合,通过Tom和Tim 复合体组成的膜通道进入线粒体内腔。定位于基质的蛋白质带有基质导向序列,指导其通过Tom和Tim复合体通道进入基质;定位于内膜的蛋白质通常含有两部分导向序列,有多种转运途径:若蛋白质前体的基质导向序列后有疏水性的停止转运序列,则定位于线粒体内膜;若机制导向序列外,还含有数段可被Oxal识别的序列,则嵌入线粒体内膜;若蛋白质前体不含机制导向序列,而含有多个内部导向序列,则定位于内膜外侧
- 叶绿体:叶绿体多肽在胞质中的游离核糖体上合成后脱离核糖体并折叠成具有三级结构的蛋白质分子,多肽上某些特定位点结合于叶绿体膜上的特异受体位点。叶绿体定位信号肽一般有两部分:第一部分决定该蛋白质能否进入叶绿体基质,第二部分决定该蛋白质能否进入类囊体。叶绿体蛋白质的前体和存在于叶绿体膜上的特异性受体相结合,进入叶绿体基质,在位于叶绿体基质内的可溶性活性蛋白水解酶的作用下,切除第一部分跨膜信号肽,在第二部分信号肽的引导下,跨过类囊体膜,进入类囊体,切除第二部分信号肽而成为成熟的叶绿体蛋白质
- 蛋白质有哪些翻译后加工修饰,其作用机制和生物学功能是什么?
- 新生的多肽链大多数是没有功能的,必须经过加工修饰才能转变为有活性的蛋白质,翻译后的加工修饰主要包含:N端fMet或Met的切除、二硫键的形成、特定氨基酸的修饰、非功能片断的切除等等
- N端fMet或Met的切除:原核生物的肽链,其N—端不保留Met,其甲酰基被脱甲酰化酶水解,原核及真核细胞中端的 Met 往往在多肽链合成完毕之前就由氨肽酶水解而除去。新生蛋白质在去掉N端一部分残基后就变成有功能的蛋白质
- 二硫键的形成:蛋白质中的二硫键由两个半胱氨酸残基通过氧化作用而形成。二硫键的正确形成对维持蛋白质的天然构象起重要作用
- 特定氨基酸的修饰:生物体内发生的氨基酸侧链的修饰主要包括磷酸化、糖基化、甲基化、乙酰化等。磷酸化是由多种蛋白激酶催化,发生在Ser、Thr和Tyr等3种氨基酸的侧链—OH上的修饰。糖基化则是由内质网中的糖基化酶催化进行的。甲基化主要是由细胞质基质内的N—甲基转移酶催化完成,多发生在Arg、His和Gln的侧链基团的N—甲基化以及Glu和Asp侧链基团的O—甲基化;乙酰化是由N—乙酰转移酶催化多肽链的N端,发生在Lys侧链上的ε—NH2。蛋白质前体经过特定的化学修饰后才能成为成熟的蛋白质而参与正常的生理活动
- 新生肽中非功能片断的切除:不少多肽类激素和酶的前体需要经过加工,切除不必要的肽段,才能成为有活性的分子。例如,新合成的胰岛素前体是前胰岛素原,必须先切除信号肽变成胰岛素原,再切除C肽,才能成为有活性的胰岛素
- 核定位序列(nuclear localization sequence,NLS)是蛋白质中的一种常 见的结构域,通常为一簇或几簇短的碱性氨基酸序列,暴露于折叠后的核蛋白表面,它能与入核孔复合体相互作用,将蛋白质运进细胞核内
- 核定位序列的主要功能是将分散在细胞内的核蛋白重新引导运入核内。蛋白质向核内运输过程需要一系列循环于核内和细胞质的蛋白因子,包括核运转因子(Importin)α、β和一个低相对分子质量GTP酶(Ran)参与,由上述三个蛋白组成的复合物停靠在核孔处,依靠 Ran GTP酶水解GTP提供的能量进入细胞核,α和β亚基解离,核蛋白与α亚基解离,α和β分别通过核孔复合体回到细胞质中,起始新一轮蛋白质运转
- 细菌同样能通过定位于蛋白质 N—端的信号肽将新合成的多肽运转到其内膜、外膜、双层膜之间或细胞外等不同部位
原核基因表达调控
组成型合成蛋白质:细胞代谢过程和生长发育过程中必须的蛋白质,合成速率不受环境影响
调节型合成蛋白质:其他参与糖代谢的酶和氨基酸、核苷酸合成系统的酶类,其合成速度和总量都随着环境的变化而改变,这些细胞内合成速率受环境影响而变化的蛋白质
原核基因表达调控总论
从DNA到蛋白质的过程称为基因表达,对该过程的调节称为基因表达调控
基因的表达调控主要表现在:
- 转录水平上的调控(transcriptional regulation)
- 转录后水平上的调控(post-transcriptional regulation)
转录后水平上的调控体现在:
- mRNA加工成熟水平上的调控(differential processing of RNA transcript)
- 翻译水平上的调控(differential )
原核生物中,营养状况和环境因素对基因表达的影响较大
真核生物中,激素水平和发育阶段是调控基因表达的最主要因素原核基因表达调控分类
细菌中的转录调控体系
- 负控诱导系统:阻遏蛋白不与效应物(诱导物)结合时,结构基因不转录
- 负控阻遏系统:阻遏蛋白与效应物结合时,结构基因不转录。
- 正控诱导系统:效应物分子(诱导物)的存在使激活蛋白处于活性状态
- 正控阻遏系统:效应物分子的存在使激活蛋白处于非活性状态
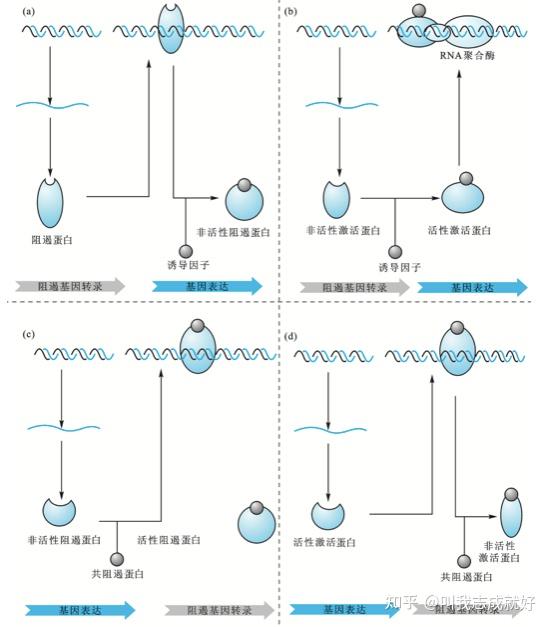
(a)负控诱导系统
(b)正控诱导系统
(c)负控阻遏系统
(d)正控阻遏系统原核基因表达调控的主要特点
操纵子的调控
大多原核基因表达调控是通过操纵子机制来实现的
操纵子:是原核生物在分子水平上基因表达调控的单位,由启动子、操纵基因及其控制的一组功能上相关的结构基因所构成。操纵基因调节基因产物的控制。操纵子可视为原核生物的转录单位,它可以逐个的从原核生物基因组中分离出来,对其结构功能加以研究
乳糖操纵子
细菌产生了一种调节机制,即在缺乏底物时就阻断相应酶类的合成途径,但在特殊的代谢物或化合物的作用下,由原来的状态转变为工作状态,一旦有底物出现,又立即合成这些酶类
- 大肠杆菌在含有葡萄糖的培养基中生长良好,在只含乳糖的培养基中开始生长较差,直到合成了利用乳糖一系列酶,具备了利用乳糖作为碳源的能力才开始生长。
- 细菌获得这一能力的原因是因为在诱导物乳糖作为碳源的诱导下开动了乳糖操纵子。表达它所编码的3个酶:
- ß-半乳糖苷酶:使乳糖水解为半乳糖和葡萄糖
- ß-半乳糖苷透过酶:使乳糖进入细菌细胞内
- ß-半乳糖苷乙酰基转移酶:使ß-半乳糖地6位碳原子乙酰化
转录起始阶段的调控
在转录起始阶段,σ因子负责模版链的选择和转录的起始,使酶专一性识别模版上的启动子,不同的σ因子决定特异编码基因的转录激活也决定不同的RNA基因转录,参与启动子的识别、结合以及转录起始复合物的异构化,在细胞发育和对环境的应答反应中起主导作用。
转录终止阶段的调控
转录终止阶段的调控一般包括抗终止作用和弱化作用
- 抗终止因子:能阻止转录终止的蛋白质。在终止子上游具有抗终止子信号,一部分RNA聚合酶能够与抗终止因子结合,跨越终止子序列,顺利通过具有茎-环结构等终止子,使转录继续进行。
- 弱化子:当操纵子被阻遏,RNA合成被终止时,起终止转录信号作用等那一段核苷酸。弱化作用在原核生物中很普遍。如:大肠杆菌中的色氨酸操纵子、苯丙氨酸操纵子、苏氨酸操纵子、异亮氨酸操纵子等都含有弱化子
转录后调控
转录后调控是在转录生成mRNA后,再在翻译或翻译后水平上“微调”,被认为是对转录水平调控的有效补充
原核生物转录后调控主要包括:mRNA自身结构对翻译的调节、反义RNA对翻译的调控及对翻译阻遏等现象
乳糖操纵子与负控诱导系统
大肠杆菌乳糖操纵子(lactose operon)包括3个结构基因:Z、Y、A,以及启动子、控制子、阻遏子 等
转录时,RNA聚合酶首先于启动区(promoter,P)结合通过操纵子区(operator,O)向右转录。转录从O区中间开始,按Z -> Y -> A 方向进行,每次转录出来一条mRNA上都带有这3个基因。转录的调控在启动区和操纵区同时进行。
3个结构基因各编码一种酶:
Z编码ß-半乳糖苷酶
Y编码ß-半乳糖苷通过酶
A编码ß-半乳糖苷乙酰基转移酶酶的诱导———lac体受调控的证据
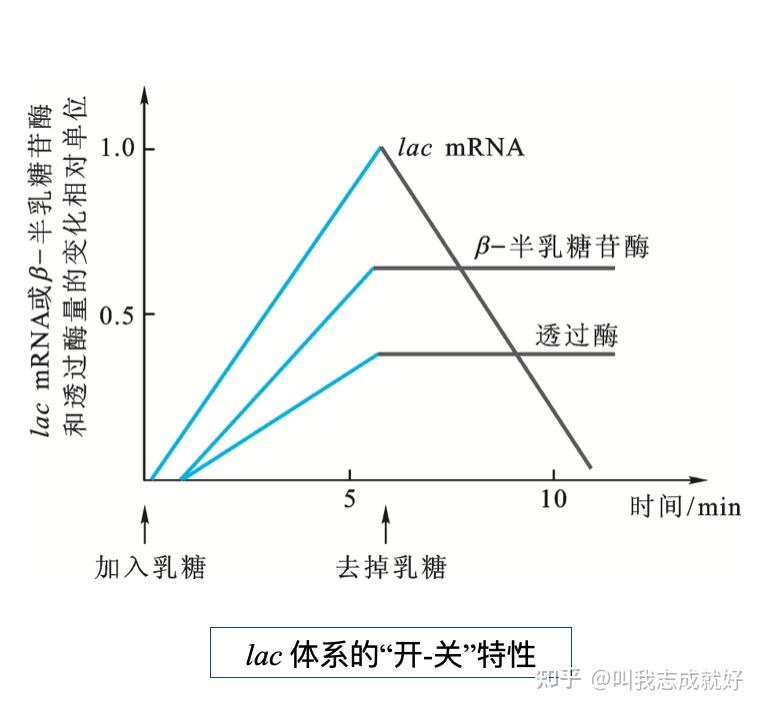
由底物诱导合成利用该底物的酶,这种现象称为酶的诱导
当有乳糖供应时,在无葡萄糖培养基中生长的lac+细菌将同时合成ß-半乳糖苷酶和透过酶。进一步用32P标记的mRNA与模版DNA进行定量分子杂交,表明培养基中加入乳糖1~2min后,编码ß-半乳糖苷酶和透过酶的lac mRNA量就迅速增加。去掉乳糖后,lac mRNA量立即下降到几乎无法检测,表明乳糖能激发lac mRNA的合成
安慰诱导物(gratuitous inducer):结构上类似于乳糖,是乳糖操纵子非常有效的诱导物。可诱导lac操纵子表达,但不能被ß-半乳糖苷酶水解
实验室常用安慰诱导剂(乳糖类似物):异丙基巯基半乳糖苷(IPTG)、巯甲基半乳糖苷(TMG)、O-硝基半乳糖苷(ONPG、酶分析中发色底物)
操纵子模型及其影响因子
乳糖操纵子的控制模型:
- Z、Y、A基因的产物由同一条多顺反子的mRNA分子所编码
- 该mRNA分子的启动区(P)位于阻遏基因(I)与操纵区(O)之间,不能单独起始半乳糖苷酶和通过酶基因的高效表达
- 操纵区市DNA上的一小段序列(26bp),是阻遏物的结合位点
- 当阻遏物与操纵区相结合时,lac mRNA的转录起始收到抑制
- 诱导物通过与阻遏物结合,改变它的三维构象,使之不能与操纵区相结合,从而激发lac mRNA的合成。就是说,有诱导物存在时,操纵区没有被阻遏物占据,所以启动子能顺利起始mRNA的转录lac操纵子的本底水平表达
- 乳糖(葡萄糖-1,4-半乳糖)并不与阻遏物结合,真正的诱导物时乳糖的异构体——异构乳糖(葡萄糖-1,6-半乳糖),而后者是在ß-半乳糖苷酶的催化下由乳糖形成的
- 在非诱导状态下有少量的lac mRNA合成(每个世代中有1~5个mRNA分子)这种合成被称之为本底水平的合成
大肠杆菌对乳糖的反应
- 当底物添加乳糖时,本底水平透过酶使少量乳糖分子进入细胞转变为异构乳糖
- 异构乳糖结合阻遏物使之离开操纵区,开始lac mRNA合成导致乳糖大量涌入细胞
- 一旦培养基和细胞中的所有乳糖被消耗完毕,由于阻遏物仍不断合成,有活性的阻遏物浓度将超过异构乳糖浓度,使细胞重新建立起阻遏状态,导致lac mRNA合成被抑制
- 如果在原有的乳糖被撤去之后的一个世代加入乳糖,这时乳糖可以立刻开始降解,因为此时细胞内仍有一定浓度的通过酶和ß-半乳糖苷酶
- 大量进入细胞的乳糖大多被降解成葡萄糖和半乳糖,但还有许多乳糖被转变为异构乳糖参与调节
阻遏物lacI基因产物及功能
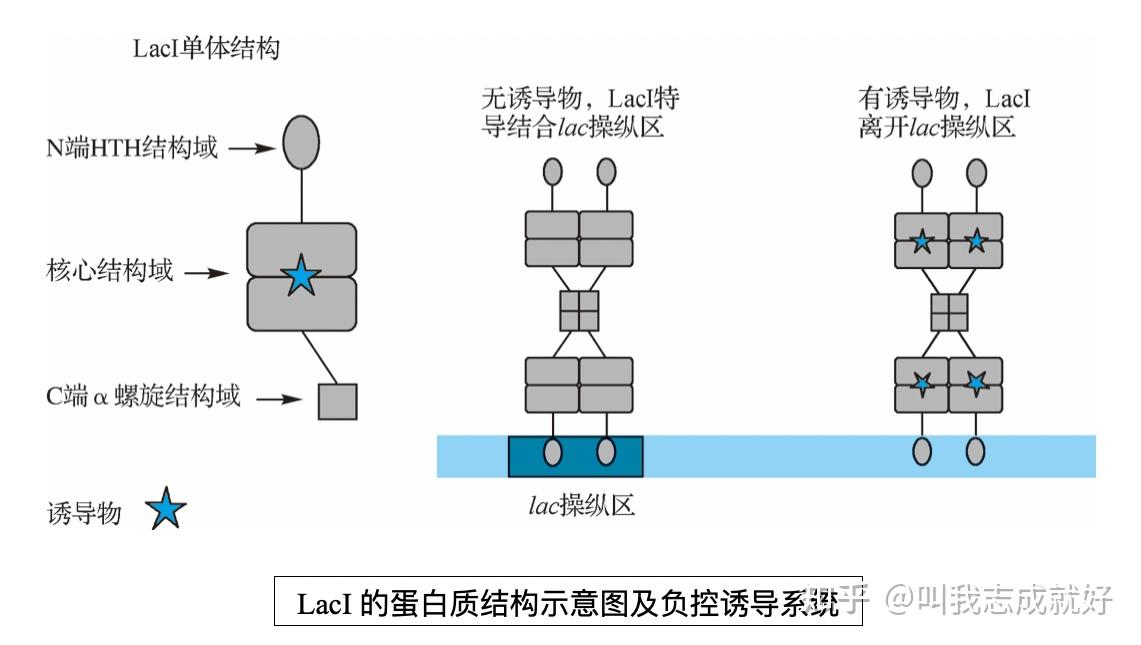
- lac操纵子阻遏物mRNA在弱启动子控制下合成
- 阻遏蛋白LacI的N段是HTH(helix-turn-helix)DNA结合结构域,中间核心结构域可以和诱导物结合,C端是一个α-螺旋,参与阻遏蛋白的聚合
- 阻遏蛋白单体通过核心结构的相互作用形成二聚体,再进一步通过C端的α-螺旋聚合形成四聚体形式
- 细胞中不存在诱导物(异构乳糖),阻遏物通过二聚体的两个HTH结构域特异性地结合在lac操纵区中一段21bp的DNA序列上,阻止RNA聚合酶与lac操纵子启动子区的结合,抑制lac mRNA的转录
- 一旦细胞中乳糖水平提高异构乳糖数量增加,有效结合到阻遏蛋白结构域,引起阻遏蛋白的构象改变,与DNA结合的特异性降低,阻遏蛋白不再特异性结合lac操纵子而是随机与DNA任意位置结合。lac操纵子的转录起始区域暴露并被RNA聚合酶结合,激活lac mRNA转录
- 当乳糖耗尽,诱导物异构乳糖减少,失去诱导物的阻遏蛋白会重新特异性结合lac操纵区,阻止基因转录
- 当lacI基因由弱启动因子突变为强启动因子,细胞内就不可能产生足够的诱导物来克服阻遏状态,因此在这些突变体中,整个lac操纵子就不可诱导
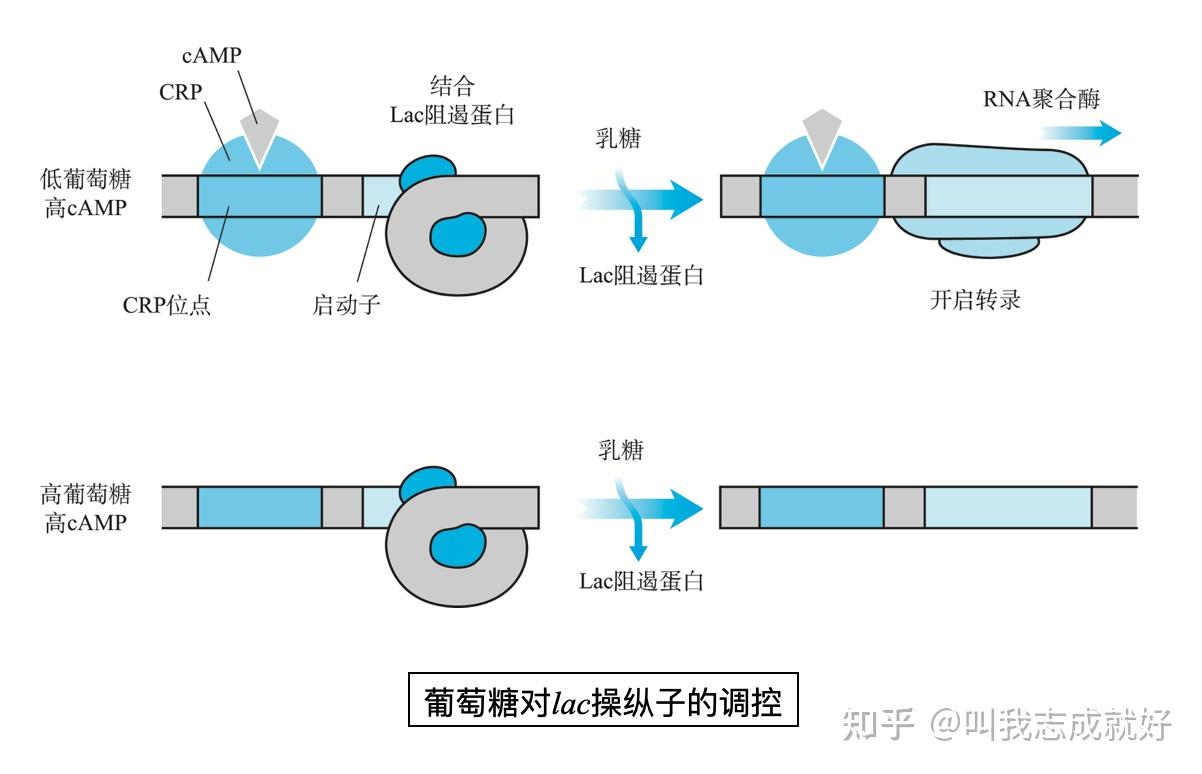
cAMP与代谢物激活蛋白-乳糖操纵子的正调控
- 分解物阻遏/代谢物阻遏(catabolite repression):当大肠杆菌以乳糖为唯一碳源时,lac操纵子可被乳糖诱导而表达,可是在培养基中同时加入葡萄糖时,细菌优先利用葡萄糖,只有葡萄糖耗尽时,乳糖才能诱导基因表达
- 葡萄糖效应:当葡萄糖和其他糖类一起作为细菌的碳源时,葡萄糖总是优先被利用,葡萄糖的存在阻止了其他糖类利用的现象
- 原因:细菌在含有葡萄的培养基上生长时,葡萄糖可降低细菌体内的cAMP水平,在大肠杆菌中,cAMP的浓度收到葡萄糖代谢的调节,在含葡萄糖的培养基中cAMP的浓度低;但在培养基中只有甘油或乳糖,cAMP的浓度会很高,推测糖酵解途径中位于葡萄糖-6-磷酸与甘油酯键的某些代谢产物是腺苷酸环化酶活性抑制剂
- 降解物敏感型操纵子:例如,半乳糖、麦芽糖、阿拉伯糖、山梨醇等在降解过程中有葡萄糖存在时,操纵子就不表达。称为降解物敏感型操纵子(catabolite sensitive operon)
大肠杆菌中的代谢产物激活蛋白(CAP,catabolite activator protein)能结合cAMP,又被称为环腺苷酸受体蛋白(CRP,cAMP receptor protein),由Crp编码
- CRP和cAMP都是合成lac mRNA所必须的,凡Crp及腺苷酸环化酶基因突变的细菌都不能合成lac mRNA
- cAMP与CAP结合形成二聚体共同发挥作用,只有cAMP存在时,CAP才具有活性
- RNA聚合酶α亚基的C端结构域(αCTD)可以结合CAP位点,并与CAP位点附近的DNA结合。通过与αCTD的相互作用,cAMP-CRP复合物帮助RNA聚合酶结合到启动子区域,激活lac mRNA的转录葡萄糖对lac操纵子的影响
- 当葡萄糖和乳糖同时存在时,lac启动子表达受阻,没有β-半乳糖苷酶活性,当葡萄糖消耗完之后,cAMP浓度增加,β-半乳糖苷酶活性增加,西伯啊又恢复分裂
lac操纵子DNA的调控区域———P、O区
- P区(启动子区)一般从I基因结束到mRNA转录起始位点下游5~10bp
- O区(阻遏物结合区)位于-7~+28位,该区域的碱基序列具有对称性,其对称轴在+11位碱基对
lac操纵子中的其他问题
- lacA基因存在于lac操纵子中,编码了β-半乳糖苷酰基转移酶,实验发现它抑制了β-半乳糖苷酶产物的有害衍生物在细胞内积累
- 在异构被完全诱导的细胞中,β-半乳糖苷酶、透过酶、乙酰转移酶的拷贝数比例为 1:0.5:0.2
- 操纵子在自然条件下可能融合。lac启动子是一个很强的启动子,通过它可以使较弱的启动子的转录增强,从而增加蛋白质的合成量
色胺酸操纵子与负阻控阻遏系统
trp体系参与生物合成而不是降解,它不受葡萄糖或cAMP-CRP的调控
色氨酸操纵子负责色氨酸的生物合成,当培养基中有足够的色氨酸时,这个操纵子自动关闭,缺乏色氨酸时操纵子被打开,起结构基因表达,为可阻遏的操纵子模型
色氨酸的合成主要分五步完成,每个环节需要一种酶,这五种酶的基因紧密连锁在一起,被转录在一条多顺反子mRNA上
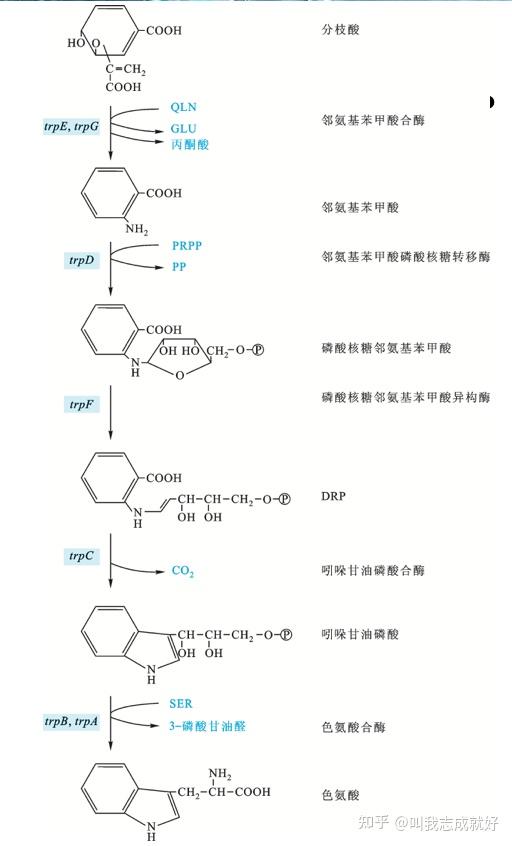
上图左侧蓝色标注为编码右侧所对应的酶的基因,其中trpA和trpB则本别编码色氨酸合酶的α和β亚基
大肠杆菌中的trp操纵子:
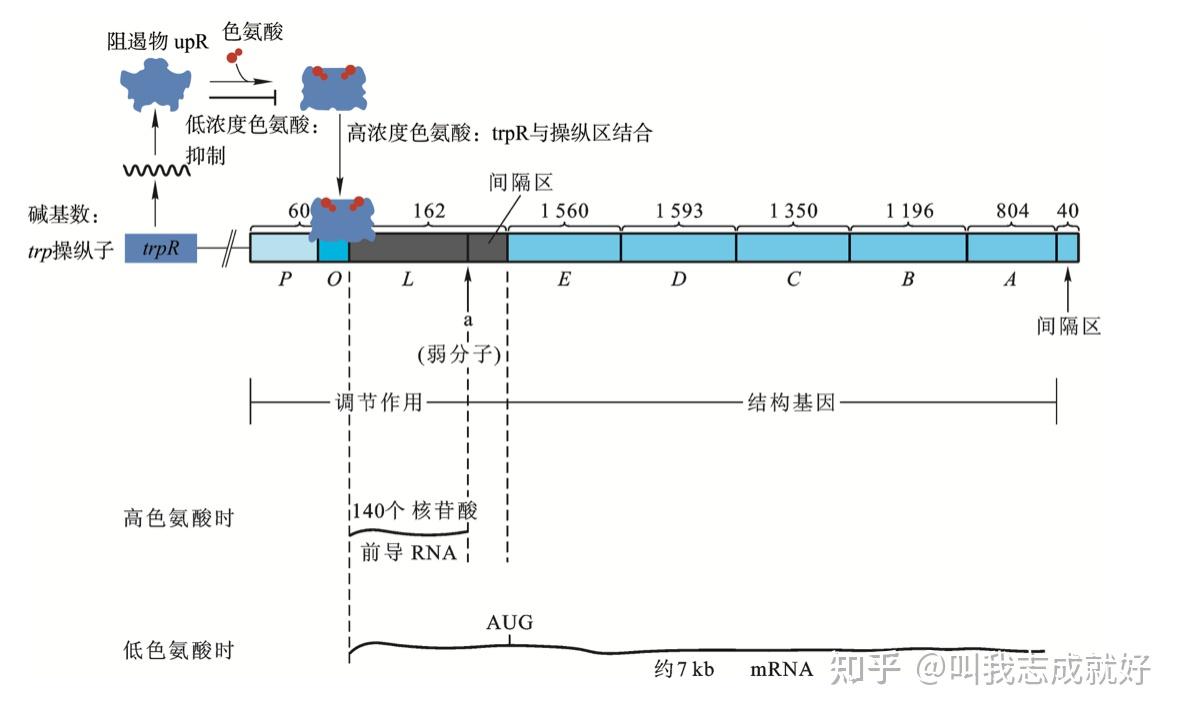
trp操纵子的阻遏系统
- trpR基因突变常引起trp mRNA的组合型生成,该基因产物因此被称为辅阻遏蛋白(aporepressor)
- 当培养基中有色氨酸时,此阻遏蛋白才会与操纵区结合
- 这个系统中效应物分子是色氨酸,是由trp操纵子所编码的生物合成途径的末端终产物
- 当培养基中色氨酸含量较高时,色氨酸与游离的辅阻遏蛋白结合,并使之与操纵区DNA紧密结合;当培养基中色氨酸供应不足时,辅阻遏物失去色氨酸并从操纵区上解离,trp操纵子去阻遏
- 辅阻遏蛋白与色氨酸相结合形成有活性的阻遏物,与操纵区结合并关闭trp mRNA转录
trp操纵子的弱化作用
- 弱化子:弱化子通过影响前导序列mRNA的结构而起作用,而起调节作用的是某种氨酰-tRNA浓度
- 在trp mRNA5‘端trpE基因的起始密码前有一个长162bp的mRNA片段被称为前导区。(若前导区123~150位碱基序列缺失,则trp基因表达可提高6~10倍)当mRNA开始转录,除非培养基中完全没有色氨酸,转录总在这个区域停止。产生一个仅有140个核苷酸的RNA分子,终止trp基因转录。
- 由于转录终止发生在这个区域,且会被调节。这个区域就被称为弱化子;该区域mRNA通过自我配对可形成茎-环结构,有典型的终止子特点
- 前导肽
- 实验表明,弱化作用需要负载色氨酸tRNA,意味着前导序列部分被翻译了
- 分析得出,应该产生一个含有14个氨基酸的多肽,被称为前导肽
阻遏作用的信号是细胞内色氨酸的多少,弱化作用的信号则是细胞内载有色氨酸的tRNA的多少
其他操纵子
二组分调控系统核信号转导
较多情况下,外部信号并不是直接传递给调节蛋白,而是首先通过传感器(sensor)接受信号,然后以不同方式传到调节部位,这个过程就是信号转导(signal transduction)<!--之前的诱导、阻遏转录调控系统均是通过环境中的小分子效应物(诱导物/阻遏物)直接调节蛋白结合进行转录调控-->
- 目前已知的最简单的细胞信号系统称为二组分调控系统(two-components systms)
- 二组分调控系统由两个不同蛋白质组成:位于细胞质膜上的传感蛋白(sensor)和 位于细胞质中的应答调节蛋白(response regulator protein)。
- 因传感蛋白具有激活酶活性,所以又称传感激酶。传感激酶常在与膜外环境的信号反应过程中被磷酸化,再将其磷酸基团转移到应答蛋白。磷酸化的应答蛋白即成为阻遏蛋白或激活蛋白,通过对操纵子的阻遏或激活作用调控下游基因表达
细菌中参与信号转导的二组分调控系统
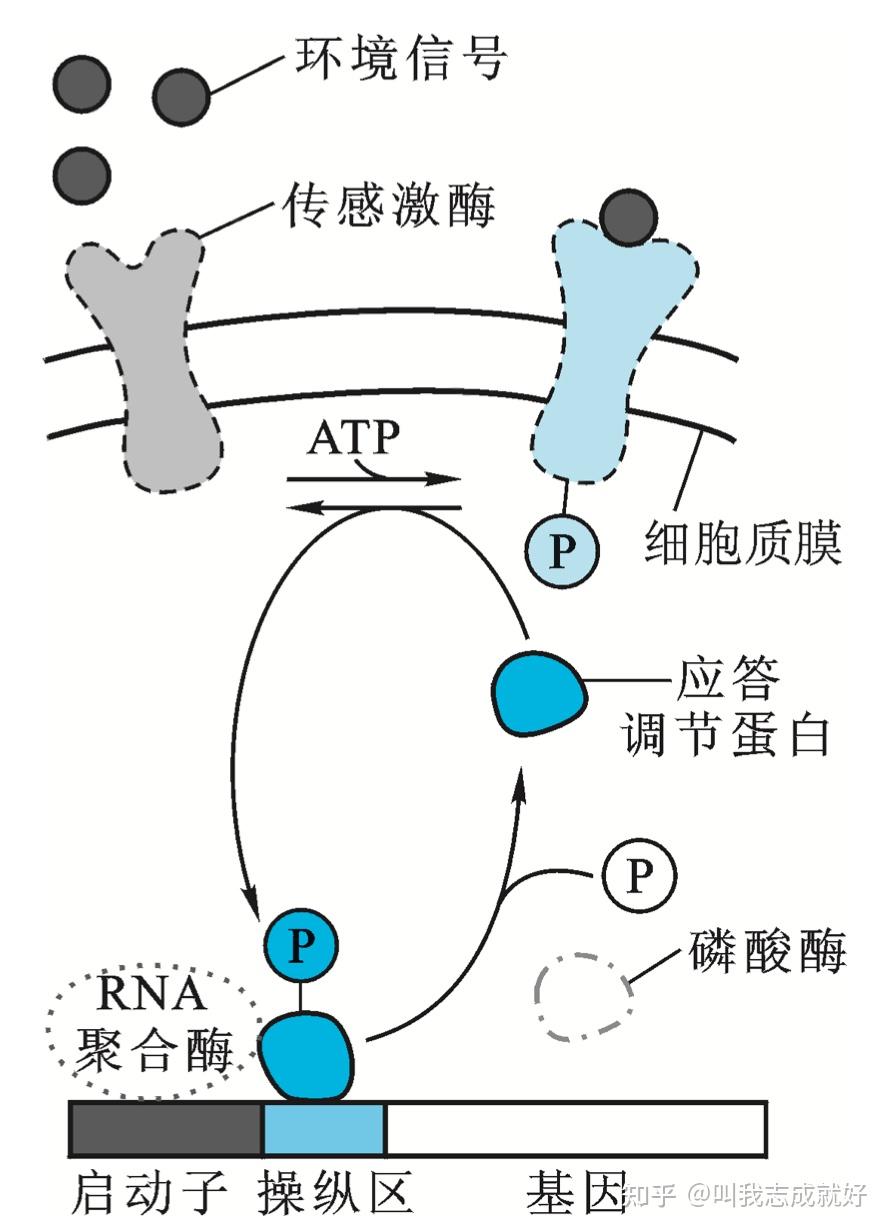
转录水平的其他调控方式
σ因子的调控作用
- 对大肠杆菌基因组序列进行分析后发现至少存在7种σ因子,并根据其相对分子质量的大小或编码基因进行命名。其中σ70参与最基本的生理功能基因的转录调控,如碳代谢、生物合成等。除参与氮代谢的σ54以外,其他五种σ因子在结构上具有同源性,所以统称σ70家族。
组蛋白类似蛋白的调节作用
- 细菌中存在一些非特异性的DNA蛋白,用来维持DNA的高级结构,被称为组蛋白类似蛋白(histone-like proteins)
- 细菌中的H-NS蛋白,就以非特异性的方式结合DNA,维持其高级结构
转录调控因子的作用
- 转录调控因子:能够与基因的启动子区相结合,对基因的转录起激活或抑制作用的DNA结合蛋白
- 许多基因的启动子区有多个转录调控因子的结合位点,这些转录调控因子的共同作用才能使RNA聚合酶顺利地结合在DNA上进行转录
抗终止因子的调节作用
- 抗终止因子:能够在特定位点阻止转录终止的一类蛋白质
- 当这些蛋白存在时,RNA聚合酶能够越过终止子,继续转录DNA。这种基因表达调控机制主要见于噬菌体和少数细菌中
转录后调控
mRNA自身结构元件对翻译的调节
- 原核生物的翻译要靠核糖体30S亚基识别mRNA上的起始密码子,以此决定它的开放读码框,AUG的识别由fMet-tRNA中含有的碱基配对信息(3‘-UAC-5')
- 遗传信息翻译成多肽链起始于mRNA上的核糖体结合位点(ribosome binding site,RBS)一般是起始密码子AUG上游的包括SD序列在内的一段非翻译区,该序列与核糖体16SrRNA的3‘端互补配对,促使核糖体mRNA上,有利于翻译起始
- mRNA的二级结构也是翻译起始调控的重要因素。因为核糖体的30S亚基必须与mRNA结合,要求mRNA 5‘端有一定的空间结构。核苷酸的变化改变形成mRNA 5’端二级结构的自由能,影响了核糖体30S亚基mRNA的结合,从而造成了蛋白质合成效率上的差异
- 核糖开关通常位于原核生物mRNA的5‘UTR区域,与其他调控元件不同,核糖开关能感受细胞内诸如代谢物浓度、离子浓度、温度的变化从而改变自身的二级结构和调控功能,从而改变基因的表达状态
小RNA的调节作用
- 细菌响应环境压力的改变,会产生一些长度在50~500nt之间的非编码小RNA分子(small non-coding RNA)即sRNA。通过改变靶mRNA的稳定性,影响蛋白质-RNA的结合或者mRNA的翻译来调节基因表达
- 原核生物sRNA以反式编码sRNA为主,且大部分都需要RNA分子伴侣Hfq蛋白的协助来发挥作用,主要是通过不严格的碱基互补配对与靶mRNA结合,抑制或促进靶mRNA的翻译,加速或减缓靶mRNA的降解
思考题
- 根据调控机制的不同可分为负转录调控和正转录调控。
- 在负转录调控系统中,调节基因的产物是阻遏蛋白。阻止基因的转录
- 负控诱导:阻遏蛋白与效应物结合时,基因转录。
- 负控阻遏:阻遏蛋白与效应物结合时,基因不转录。
- 在正转录调控系统中,调节基因的产物是激活蛋白。
- 正控诱导:有效应物时,激活蛋白处于活性状态,基因转录。
- 正控阻遏:有效应物时,激活蛋白处于无活性状态,基因不转录
- Jacob和Monod通过大量实验及分析提出操纵子学说,其内容如下:Z、Y、A基因产物由同一条多顺反子mRNA编码,该mRNA的启动区(P)位于阻遏基因(1)与操纵区(O)之间,不能单独起始半乳糖苷酶和透过酶基因的表达。操纵区是DNA上的一小段序列(仅为26bp),是阻遏物的结合位点。当阻遏物与操纵区相结合时,lac mRNA的转录起始受到抑制;诱导物通过与阻遏物结合,改变其三维构象,使之不能与操纵区相结合,诱发 lac mRNA的合成
- 乳糖操纵子模型中依次排列着启动子、操纵基因和三个结构基因,它们分别编码 β—半乳糖苷酶、半乳糖苷透性酶和β—硫半乳糖苷转乙酰基酶,三个基因受同一个操纵基因控制
- 当没有乳糖存在时,lac操纵子处于阻遏状态。阻遏蛋白阻碍RNA聚合酶与启动子P的结合,阻止启动基因上的RNA聚合酶进行转录,这是一种负调节作用。
- 当有乳糖存在时,乳糖与阻遏蛋白结合,使之发生变构而失去活性,因而不能与操纵基因结合,导致RNA聚合酶进行转录,产生上述三种酶,使大肠杆菌能利用乳糖。
- 培养基中有葡萄糖存在,葡萄糖的降解产物能降低细胞内 cAMP 含量,影响CAP与启动基因结合,也影响RNA聚合酶与启动基因结合,因此,β—半乳糖苷酶等三个酶不能产生。这是一种正调控作用。
- 葡萄糖效应是指在有葡萄糖存在的情况下,即使在细菌培养基中加入乳糖、半乳糖、阿拉伯糖或麦芽糖等诱导物,与其相对应的操纵子也不会启动,产生出代谢这些糖的酶。这种葡萄糖的存在阻止了其他糖类利用的现象,称为葡萄糖效应,也称为降解物阻抑(catabolite repression)
- 弱化作用(attenuation)是一种翻译调控机制。在该机制中,核糖体沿着mRNA分子的移动的速率决定转录是进行还是终止。在大肠杆菌色氨酸操纵子中,细菌的转录和翻译几乎同步进行,RNA 聚合酶在转录前导序列时,核糖体和相应的tRNA 紧随其后翻译前导肽。当介质中Trp 浓度很低时,tRNAtP相应短缺,核糖体移至重叠区两个Trp密码子时,因缺少相应tRNAP而停滞不前,使1区不能和2区配对,所以2区和3区配对,结果不能形成3—4区配对的终止子结构,因此RNA聚合酶能继续转录下去,操纵子得以表达。当介质中Trp浓度高时,核糖体与足量的tRNAP紧随聚合酶后迅速合成前导肽,并在位于1区和2区之间的终止密码子处停止,不影响1区和2区的配对,所以3区可以和4区配对,形成终止子结构,使RNA聚合酶在此终止,从而阻止操纵子酶基因的转录和翻译。当所有氨基酸都不足时,核糖体翻译移动的速度就更慢,甚至不能占据1的序列,结果有利于1、2和3、4发夹结构的形成,于是RNA聚合酶停止转录
- 抗终止因子是能够在特定位点阻止转录终止的一类蛋白质。当这些蛋白质存在时,RNA 聚合酶能够越过终止子,继续转录 DNA。抗终止因子在RNA聚合酶到达终止子之前与之结合,因为在终止子上游存在抗终止作用的信号序列,只有与抗终止因子相结合的 RNA 聚合酶才能顺利通过具有茎—环结构的终止子,使转录继续进行。参与大肠杆菌抗终止作用的蛋白是 Nus蛋白。NusA 和us因子不能同时结合到RNA 聚合酶上。只要 RNA 聚合酶结合在 DNA上,NusA就不会从 RNA 聚合酶上解离,而σ因子可以取代游离 RNA 聚合酶上的NusA,因此,在转录起始和终止的过程中 RNA 聚合酶分别受到σ因子和NusA 的调控。转录起始不久,σ因子从RNA 聚合酶上解离下来,NusA 蛋白就结合到核心RNA 聚合酶上。NusA 的结合增加了 RNA 聚合酶在终止子发夹结构处暂停的过程,从而促进抗终止作用的发生。
- 反义RNA(antisense RNA)是指与mRNA互补的RNA分子。这种反 义RNA通过序列互补与特定的mRNA结合,抑制mRNA的翻译。其调控机制有:(1)与前mRNA结合,影响mRNA的成熟和在胞浆内转运;(2)与相应的靶RNA结合激活 RNase,加速靶RNA的降解;(3)直接与起始密码子AUG结合而阻止翻译的启动;(4)互补作用于SD编码区的反义RNA可阻止核糖体与mRNA的结合。
- 基因在转录水平的调控是生物最经济的调控方式,但转录生成 mRNA以后,再在翻译或翻译后水平进行“微调”,是对转录调控的补充。它使基因表达的调控更加适应生物本身的需求和外界条件的变化。主要有:
- mRNA 自身结构元件对翻译起始的调控:起始密码子AUG上游的一段非翻译区的结合强度取决于SD序列的结构及其与起始密码AUG之间的距离,SD与AUG之间距离一般以4~10个核苷酸为佳,9个是最佳的。此外,mRNA的二级结构影响核糖体与mRNA的结合,也会造成蛋白质合成效率上的差异。
- mRNA稳定性对转录水平的影响:降解mRNA的酶都是3'→5'外切核酸酶,但mRNA的二级结构具有阻遏这些酶的作用。IR(反向重复顺序)的存在可以防止3'→5'外切核酸酶的降解作用,有利于转录产物的积累。
- 蛋白质的调控作用:有些 mRNA 编码的蛋白质,本身也可以对相应mRNA的翻译过程产生调节作用,这是一种自身翻译调控作用。如自体调控物r—蛋白与rRNA上结合位点结合的程度比其他mRNA上结合位点的程度强,所以当存在游离rRNA时,最新合成的r—蛋白与rRNA结合开始装配核糖体,此时没有游离的r—蛋白与mRNA的结合,mRNA的翻译继续。一旦rRNA合成减慢或停止,游离r—蛋白富集,就能与他们的mRNA 结合,阻止其继续翻译,即:只要相对于RNA有多余的r—蛋白,r—蛋白的合成就会被阻止。因此,蛋白质合成的自体调控保证了核糖体蛋白质与RNA在数量上的平衡。
- 反义RNA的调节作用:反义 RNA 通过互补的碱基与特定的 mRNA结合(结合位点通常是mRNA上的SD序列、起始密码子AUG和部分N端的密码子)来抑制mRNA的翻译。
- 稀有密码子对翻译的影响:细胞内对应于稀有密码子的tRNA较少,不易获得,这样就延长了核糖体在mRNA上滑动的时间,降低了翻译的速度;高频率使用这些密码子的基因翻译过程容易受阻,影响了蛋白质的总量。
- 重叠基因(overlapping gene)对翻译的影响:正常情况下,色氨酸操纵子5个基因产物是等量的,这是由于其相邻两基因之间有重叠现象,翻译出现偶联。偶联翻译可能是保证两个基因产物在数量上相等的重要手段。
- 翻译的阻遏:在大肠杆菌RNA噬菌体Qβ中发现复制酶可以作为翻译阻遏物来调控蛋白质的合成。纯化的复制酶可以和外壳蛋白的翻译起始区结合,阻止了核糖体与起始区的结合,不能重新起始翻译。但已经起始的翻译仍能继续下去,直至完毕。
- 魔斑核苷酸水平对翻译的影响:魔斑核苷酸是指 ppGpp和pppGpp分 子,当细胞缺乏氨基酸时产生魔斑核苷酸,可在很大范围内做出系列应急反应,如抑制核糖体和其他大分子合成,活化某些氨基酸操纵子的转录表达,抑制与氨基酸转运无关的转运系统,活化蛋白水解酶等,以节省或开发能源,以渡过难关。
- 严谨反应是细菌适应逆境的重要机制之一,当细胞感知外界可利用氨基酸缺乏时,能快速启动受 ppGpp 控制的生长速率调节机制。当细菌处于氨基酸全面匮乏时,会采取一种应急反应以求生存,即停止包括各种RNA(特别是rRNA)在内的几乎全部生物化学反应过程,只保持维持生命最低限量的需要。实施这一应急反应的信号,是鸟苷四磷酸(ppGpp)和鸟苷五磷酸(pppGpp),产生这二 种物质的诱导物是空载tRNA。
- 氨基酸缺乏时,出现大量空载tRNA,空载tRNA会激活焦磷酸转移酶,使ppGpp和pppGpp 大量合成,其浓度可增加10倍以上。ppGpp的出现会关闭许多基因,也会打开一些合成氨基酸的基因,以应付这种紧急情况。关于 ppGpp和pppGpp的作用原理,目前认为有二种可能:1、与RNA 聚合酶结合,使后者构型发生改变,从而识别不同的启动子,改变基因转录的效率,如关闭或减弱一些基因转录、增加一些基因转录。2、ppGpp与启动子结合,使后者不再与RNA 聚合酶结合,导致基因被关闭。
- σ因子是原核生物RNA聚合酶的一个亚基,是转录起始所必需的因子,主要影响RNA聚合酶对转录起始位点的正确识别。常见的σ因子为σ70,此外还有分子量不同,功能不同的其他σ因子。
- σ因子对识别DNA链上的转录信号是不可缺少的,它是核心酶和启动子之间的桥梁。σ因子与RNA 聚合酶核心酶的结合是原核生物RNA合成起始的关键步骤。σ因子与RNA聚合酶核心酶结合的亲和力会影响特定基因表达量的大小,从而对生命活动进行调节。在转录起始阶段,σ因子识别特异启动子序列;不同的σ因子决定特异编码基因的转录激活,也决定不同RNA(mRNA、rRNA和tRNA)基因的转录。σ因子在转录延长时脱落。
真核基因表达调控
真核生物基因组特点:结构庞大;单顺反子;重复序列;可移动序列;基因不连续性(断裂基因);有染色体结构;基因表达调控时间和空间的分隔
真核基因表达调控相关概念和一般定律
真核基因表达的基本概念
- 一个细胞或病毒所携带的全部遗传信息或整套基因即基因组(genome),它包括每一条染色体所有亚细胞器的DNA序列信息
- 基因(gene)是指能产生一条肽链或功能RNA所必须的DNA片段。真核基因包括编码区和其上下游区域,以及在编码片段间(外显子)的间断切割序列(含内含子)
- 基因经过转录、翻译,产生具有特异生物学功能的蛋白质分子或RNA分子的过程称为基因表达(gene expression)
- 基因表达是受内源及外源信号调控的,这个调控过程称为基因表达调控(gene regulation or regulation of gene expression)
真核基因的断裂结构
外显子与内含子
- 大多真核基因都是有蛋白质编码序列和非蛋白质编码序列两部分组成。编码序列称为外显子(exon)非编码序列称为内含子(intron)
- 结构基因中,各个外显子常常被长度不等的内含子所隔离,形成镶嵌排列的断裂方式。因此,真核基因被称为断裂基因(interrupted gene)
- 断裂基因的结构形式为某些重要的蛋白质的编码区域提供了进行重组的潜在位点,使这些DNA序列有充分的机会进行重复和重复和组合,有利于真核基因的进化
- 高等真核生物,核DNA序列中外显子的部分不到10%
- 如果要用原核细胞表达真核基因,必须首先构建切除内含子的重组基因,才有可能得到所研究的蛋白质
外显子-内含子连接区
- 外显子-内含子连接区(exon-intorn junction)具有高度保守性和特异性碱基序列
- 外显子-内含子连接区就是指外显子和内含子的交接或边界序列
- 边界序列有两个重要特征:
- 内含子两端序列之间没有广泛的同源性。内含子两端序列不能互补,说明在剪接加工前,内含子上下游序列不可能通过配对形成发夹结构
- 外显子-内含子连接区序列高度保守,可能与剪接机制密切相关,是RNA剪接的信号序列
- GT-AG法则:几乎每个内含子5‘端起始都是GT,3’端都是AG。即5’ GT···AG 3'
- 5‘端接头序列称为左剪接位点/供体位点(donor site),3'端接头序列称为右剪接位点/受体位点(acceptor site)。
外显子与内含子的可变调控
- 组成型剪接:一个基因的转录产物通过组成型剪接只能产生一种成熟的mRNA,编码一个多肽
- 选择性剪接:同一个基因的转录产物由于不同的剪接方式形成不同mRNA的过程称为选择性剪接
- 真核生物的原始转录产物通过不同的剪接方式,产生不同的mRNA。或转录时选择不同的启动子选择不同的多(A)位点而使出击转录物具有不同的二级结构,因而影响剪接过程,最终产生不同的mRNA分子
基因家族
- 真核细胞中许多相关的基因常按功能成套组合,被称为基因家族
- 同一个家族中的成员有时紧密排列在一起,成为一个基因簇
- 更多时候,它们分散在同一染色体的不同部位,甚至位于不同的染色体上,具有各自不同的表达调控模式
简单基因家族
- 简单基因家族一般以串联方式前后连接
- 例如:大肠杆菌中,16S、23S、5S rRNA基因联合成一个转录单位,各种rRNA分子都是从这个转录单位上剪切下来。真核生物中,前rRNA转录产物的沉降系数为45S(约14000个核苷酸),包括18S、28S、5.8S 3个主要rRNA分子。前rRNA分子中至少有100出被甲基化(主要是核糖的2-OH甲基化)初级转录产物被特异性RNA酶切割降解,产生成熟的rRNA分子。这个过程需要snoRNAs的参与。而5S rRNA作为一个独立的转录单位,由RNA聚合酶III(而不是RNA聚合酶I)完成转录
复杂多基因家族
- 复杂多基因家族一般由几个相关家族构成,基因家族之间由间隔序列隔开,并作为独立的转录单位
- 在一个特定的细胞中,并不是所有串联的单位都得到转录。其中的每一个基因分别被转录成单顺反子RNA,这些RNA都没有内含子,而且各基因在同一条DNA链上按同一方向转录,每个基因的转录与翻译速度都收到调节
发育调控的复杂多基因家族
- 在生物个体发育的不同阶段,出现几种不同形式的α和β亚基。属于发育调控的复杂多基因家族表达
真核基因表达的方式和特点
基因表达方式
- 组成性表达:即管家基因(housekeeping gene)的表达
- 某些基因在个体的所有细胞中持续表达,是细胞结构和代谢过程中所必须的基因。这些基因通常称为管家基因,其表达模式又称为组成性基因表达
- 管家基因是细胞结构和代谢过程中所必须的基因,通常能够保持较高的表达量。可作为RT-PCR的内参
- 选择性表达:即可诱导基因(inducible gene)或可阻遏基因(repressible)的表达
- 在特定环境信号刺激下,基因被激活,基因表达产物增加,称为可诱导基因;如果基因被环境信号所抑制,称为可阻遏基因
基因表达调控是调节选择性表达基因的转录和翻译的速率,导致其蛋白水平发生改变并影响功能
基因表达的时空特异性
- 基因表达的时间特异性(temporal specificity)即按功能需要,某一特定基因的表达严格按特定的时间顺序发生
- 多细胞生物基因表达的时间特异性又称阶段特异性(stage specificity)
- 基因表达的空间特异性(spatial specificity)是指在个体生长过程中,某种基因产物按不同组织空间顺序出现
- 基因表达伴随时间顺序所表现出的这种分布差异,实际上是由细胞在不同器官的分布所决定的。所以,空间特异性又称细胞或组织特异性
真核基因表达的转录水平调控
真核细胞与原核细胞在基因转录、翻译及DNA的空间结构方面存在以下几个方面的差异:
- 在真核细胞中,一条成熟的mRNA链只能翻译出一条多肽链,很少出现多基因操纵子形式
- 真核细胞DNA与组蛋白和大量非组蛋白结合,只有一小部分DNA是裸露的
- 高等真核细胞DNA中大部分不转录,且基因中含有内含子
- 真核生物能够有序的根据生长发育阶段的需要进行DNA片段重排,还能在需要时增加细胞内某些基因的拷贝数,这种能力在原核生物中非常罕见
- 真核生物基因转录的调节区大而多,可能离核心启动子几百上千bp。这些调节区域蛋白质,但并不直接影响启动子区对RNA聚合酶的接受程度,而是通过控制基因5‘端上游区DNA构型来影响它与RNA聚合酶多结合能力
- 真核生物的RNA在细胞核中合成,只有经转运穿过核膜,到达细胞质中,才能被翻译为蛋白质
- 许多真核生物基因只有经过复杂的成熟和剪接过程,才能被翻译为蛋白质
真核基因的一般结构特征
- 一个完整的真核基因,不但包括编码区(coding region)还包括5‘和3’端长度不等的特异性序列,它们虽然不编码氨基酸,却在基因表达过程中起着重要作用
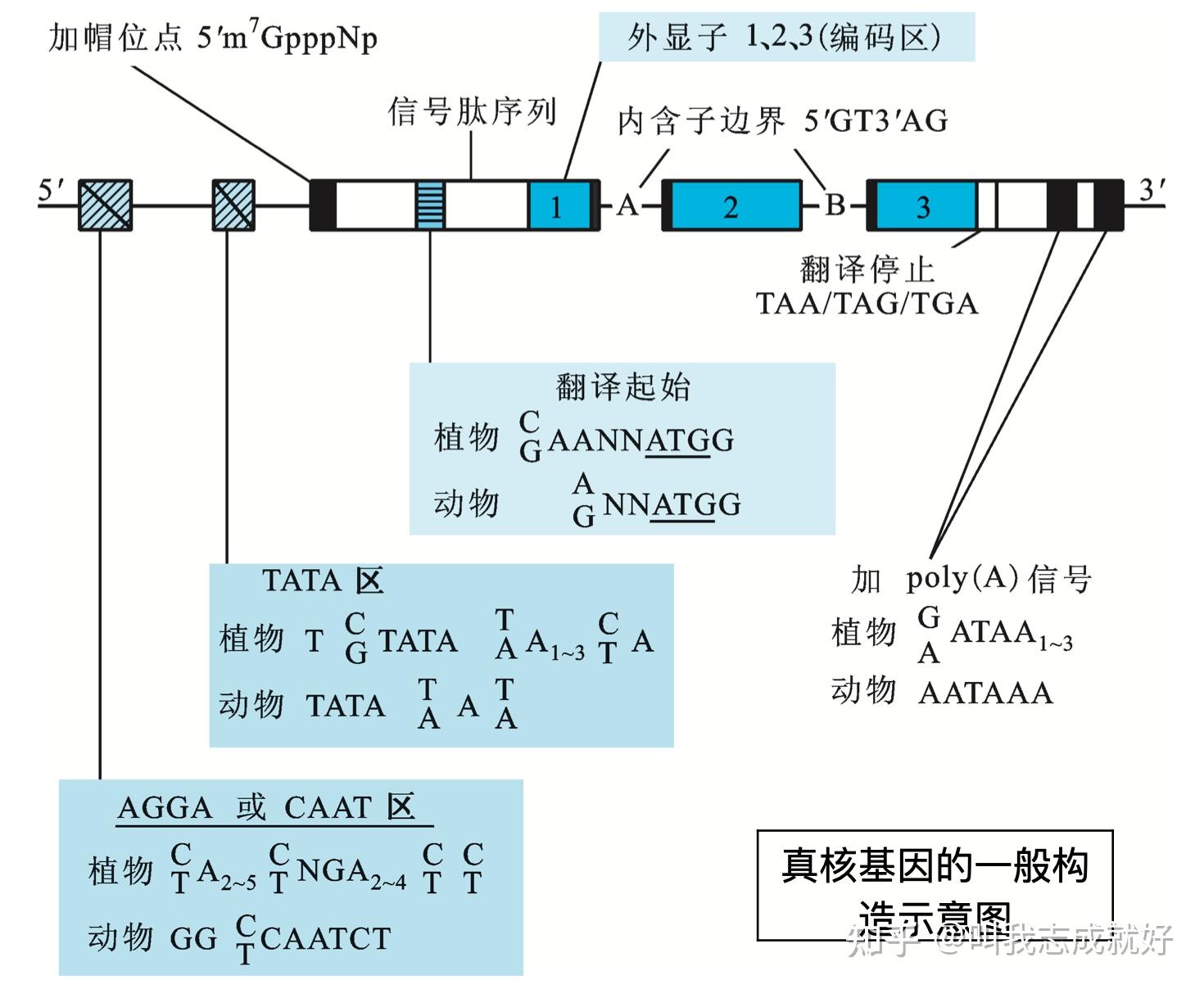
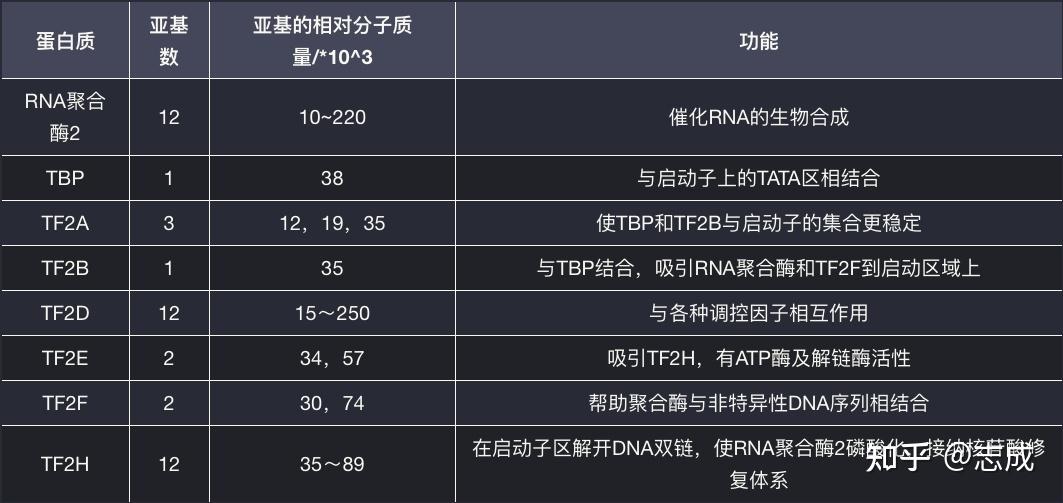
基因转录调节的基本要素包括顺式作用元件(cis-acting elements)、反式作用因子(trans-acting factors)、RNA聚合酶(RNA polymerase)
- 顺势作用元件:指启动子和基因的调节序列。主要包括启动子(promoter)、增强子(enhancer)、沉默子(silencer)等
- 反式作用因子:能够结合在顺势作用元件上调控基因表达的蛋白或RNA
启动子
真核基因启动子由核心启动子和上游启动子两个部分组成,是在基因转录起始位点(+1)及其5‘端上游100~200bp以内的一组具有独立功能的DNA序列,每个元件长度为7~20bp,是决定RNA聚合酶II转录起始位点和转录频率的关键元件
- 核心启动子(core promoter):是指保证RNA聚合酶II转录正常所必须的、最少的DNA序列,包括转录起始位点及转录起始位点上游-25~-30bp处的TATA盒。核心启动子单独起作用时,只能确定转录起始位点并产生基础水平的转录
- 上游启动子元件(upstream promoter element,UPE):包括通常位于-70bp附近的CAAT盒(CCAAT)和GC盒(GGGCGG)等,能通过TFIID复合物调节转录起始的频率,提高转录效率
沉默子
真核生物中负性调节元件,当其结合特异性蛋白因子时,对基因转录起阻遏作用
基因座控制区
基因座控制区(locus contorl region,LCR)是染色体DNA上一种顺势作用元件,含多种反式作用因子的结合序列,使启动子处于无组蛋白状态,增强基因表达
绝缘子
绝缘子(insulator)长约几百个核苷酸对,通常位于启动子同顺式调控元件(增强子)或反式调控因子之间的一种调控序列。绝缘子本身对基因的表达既没有正效应,也没有负效应,其作用能阻止正调控或负调控信号在染色体上的传递,阻断包括增强子、沉默子和LCR的作用,使染色体活性限制在一定结构域内
转录模版
包括从转录起始位点到RNA聚合酶II转录终止处的全部DNA序列
RNA聚合酶II
RNA聚合酶II是一类能够直接或间接与启动子核心序列TATA盒特异性结合,并启动转录的调节蛋白。RNA聚合酶II在转录因子帮助下,形成转录起始复合物
增强子及其对转录的影响
增强子是指能使与它连锁的基因转录频率明显增加的DNA序列
增强子特性
- 增强效应十分明显。一般能使基因转录频率增加10~200倍,有的能达到上千倍
- 增强效应与其位置和取向无关。不论增强子以什么方向排列(3'->5' / 5'->3')甚至与靶基因相聚3000碱基对或在靶基因下游,均表现出增强效应
- 大多为重复序列,一般长约50bp,适合与某些蛋白因子结合。其内部常含有一个核心序列:(G)TGGA/TA/TA/T(G),该序列是产生增强效应时所必须的
- 其增强序列效应有严密的组织和细胞特异性,说明增强子只有特定的蛋白质(转录因子)相互作用才能发挥功能
- 没有基因专一性,可以在不同的基因组合上表现增强效应
- 许多增强子还受外部信号的调控
增强子可能的3种作用机制
- 影响模版附近的DNA双螺旋结构,导致DNA双螺旋弯折或在反式作用因子的参与下,以蛋白质之间的相互作用为媒介形成增强子与启动子之间“成环”连接,活化基因转录
- 将模版固定在细胞核内特定位置,如连接在核基质上,有利于DNA拓扑异构酶改变DNA双螺旋结构的张力,促进RNA聚合酶II在DNA连接上的结合和滑动
- 增强子可以作为反式作用因子或RNA聚合酶II进入染色质结构的“入口”
反式作用因子
- 反式作用因子指能够结合在顺势作用元件上调控基因表达的蛋白质或RNA
- 根据功能可分为三类:
- 基本转录因子:具有识别启动子元件功能
- 转录调节因子:能识别增强子或沉默子
- 共调节因子:不需要通过DNA-蛋白质相互作用就参与转录调控
- 实验中将基本转录因子和转录调节因子统称为:转录因子(transcription factor,TF)。包括:转录激活因子 和 转录阻遏因子。这类调节蛋白能识别并结合转录起始位点的上游序列或远端增强子元件,通过DNA-蛋白质相互作用而调节转录活性,并决定不同基因的时间、空间特异性表达
- 共调节因子本身无DNA活性,主要通过蛋白质-蛋白质相互作用影响转录因子的分子构象,从而调节转录活性。实验中常与转录激活因子有协同的那一类共调节因子称为共激活因子,将与转录阻遏因子有协同作用那一类共调节因子称为共阻遏因子。
- 所有共振激活因子都能识别靶位点(启动子、增强子)而靶位点的特异性则由DNA结合域的特定序列决定。DNA结构域结合在特定的序列上,从而将激活因子上的转录激活域带到基础转录区域附近
一般认为,如果某个蛋白质是体外转录系统中起始RNA合成所必须的,它就是抓路复合物的一部分。
根据各个蛋白质成分在转录中的作用,能将整个复合物分为3个部分:
- 参与所有或某些转录阶段的RNA聚合酶亚基(不具有基因特异性)
- 与转录的起始或终止因子有关的辅助因子(不具有基因特异性)
- 与特异调控序列结合的转录因子(它们中有些被认为是转录复合物的一部分,因为所有或大部分基因的启动区都含有这一特异序列,更多的则是基因或启动子特异性结合调控蛋白,它们是某个(类)基因转录所必须的)DNA 识别或结合域
螺旋-转折-螺旋(helix-turn-helix,H-T-H)结构
这一类蛋白质分子中至少有两个α-螺旋,中间由短侧链氨基酸残基形成“转折”,近羧基端端α螺旋中氨基酸残基的替换会影响蛋白质在DNA双螺旋大沟中的结合。与DNA相互作用时,同源域蛋白的第一、第二两个螺旋往往靠在外侧,第三个螺旋域DNA大沟结合,通过其N端端多余臂与DNA的小沟相结合
同源域:指编码60个保守氨基酸序列的DNA片段,它广泛存在于真核生物基因组内,同源转换的基因与生物有机体的生长、发育和分化密切相关。许多含有同源转换区的基因具有转录调控功能,同源转换区氨基酸序列很可能参与形成了DNA结合区
锌指(zinc finger)结构
- 锌指结构:一种常出现在DNA结合蛋白中的一种结构基元。 是由一个含有大约30个氨基酸的环和一个与环上的4个Cys或2个Cys和2个His配位的Zn2+构成,形成的结构像手指状
- 锌指结构家族蛋白大体可分为锌指、锌扭(twist)、锌簇(cluster)结构,其特有的半胱氨酸和组氨酸残基之间氨基酸残基数基本恒定,有锌参与时才具备转录调控活性
- 重复的锌指结构都是将一个α螺旋与一个反向平行β片层的基部以锌原子为中心,通过与一对半胱氨酸和一对组氨酸之间形成配位键相连接,锌指环上突出的赖氨酸、精氨酸参与DNA结合。由于结合在大沟中重复出现的α螺旋几乎连成一线,这类蛋白质与DNA的结合很牢固,特异性也很高。类固醇激素受体家族含有连续的两个锌指结构,其中两个锌原子将两个α螺旋装配称类似H-T-H的结构,再以同源或异源性二聚体的方式将两个α螺旋结合在相邻的两个大沟中
锌指结构中每一个α螺旋可以特异性地识别3~4个碱基,利用不同的锌指结构识别特异性DNA序列的特点以及核酸酶能够切段靶D NA的原理,科研工作者获得了一类被称为锌指核酸酶(zinc-finger nucleases,ZFN)的新限制性内切核酸酶。
转录活化结构域
反式作用因子唯一的结构基础是具有转录活化域
反式作用因子的功能具有多样性,起转录活化域也有很多种,通常依赖于DNA结合结构域以外的30~100个氨基酸残基。不同的转录活化域所具有的特征结构:
- 带负电负电荷的螺旋结构
- 富含谷氨酸钠的结构
- 富含脯氨酸的结构
真核基因表达的染色质修饰和表冠遗传调控
真核生物DNA水平上的基因表达调控
“开放”型活性染色质结构对转录的影响
- 真核基因的活跃转录是在常染色质上进行的。转录发生之前,常染色质会在特定的区域被解旋松弛,形成自由的DNA。这种变化可能包括核小体结构的消除或改变、DNA本身局部结构的变化甚至从右旋型变为左旋型(Z-DNA)等,这些变化可导致结构基因暴露,促进转录因子与启动子区DNA结合,诱发基因转录.
- 紧密的染色质结构组织基因表达
- 核小体的结构消除或改变,会使DNA结构由右旋变为左旋,导致结构基因暴露,使转录因子与启动区结合,诱发转录,这些都表明核小体结构会影响基因转录
- 活跃状态的基因比非活跃状态的DNA更容易被DNase I 所降解。原因是活跃表达的基因所在染色质上包含一个或数个DNase I敏感位点,常出现在转录基因的5‘端启动区,多在调控蛋白结合位点附近,该处DNA裸露,容易被核酸酶降解
基因扩增(gene amplification)
- 基因扩增是指某些基因的拷贝数专一性大量增加的现象,它使细胞在短期内产生大量的基因产物以满足生长发育的需要,是基因活性调控的一种方式
基因重排与变换
- 基因重排:将一个基因从离启动子较远位置移动到距离启动子附近的位点从而启动转录
DNA甲基化与基因活性的调控
DNA甲基化(DNA methylation)为DNA化学修饰的一种形式,能在不改变DNA序列的前提下,改变遗传表现。是表冠遗传密码(epigenetic code)的一部分,是一种外遗传机制。DNA甲基化过程会使甲基添加到DNA分子上
- DNA甲基化是最早发现的修饰途径之一,可能存在于所有高等生物中并与基因表达调控密切相关
- DNA甲基化能关闭某些基因的活性,去甲基化则诱导了基因的重新活化和表达
- DNA甲基化能引起染色质结构、DNA构象、DNA 稳定性及DNA与蛋白质相互作用方式的改变从而 控制基因表达
- 在染色体水平上,DNA甲基化在着丝粒附近水平最高;在基因水平上,DNA甲基化高水平区域涵盖了多数的转座子、假基因和小RNA编码区
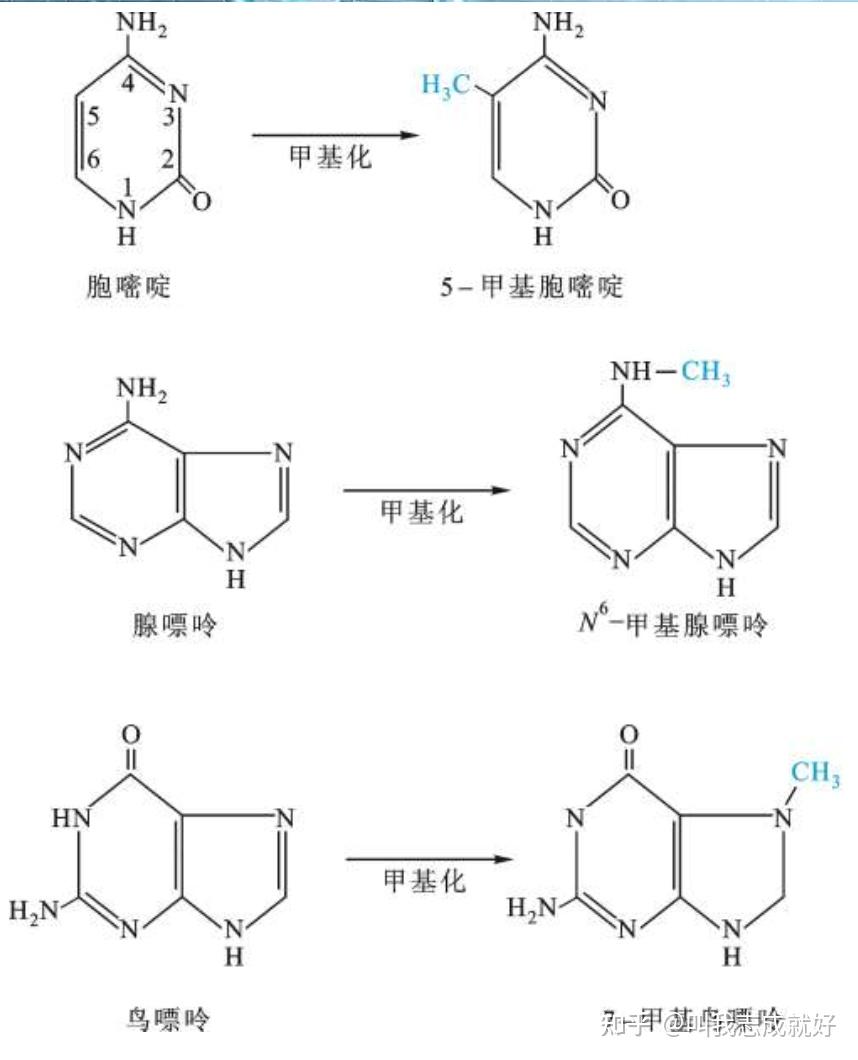
- DNA 甲基化主要形成5- 甲基胞嘧啶(5-mC)和少量的N6-甲基腺嘌呤(N6-mA)及 7-甲基鸟嘌呤(7-mG)
DNA甲基化抑制基因转录的机制
- DNA甲基化导致某些区域DNA构象变化,从而影 响了蛋白质与DNA的相互作用,抑制了转录因子与启动区DNA的结合效率
在真核生物中,5-甲基胞嘧啶主要出现在CpG序列、CpXpG、CCA/TGG和GATC中。因为高等生物CpG二核苷酸序列中的C通常是甲基化的,极易自发脱氨,生成胸腺嘧啶,所以CpG二核苷酸序列出现的频率远远低于按核苷酸组成计算出的频率
这些CpG二核苷酸通常成串出现在DNA上,这段序 列被称为CpG岛。CpG二核苷酸中C的甲基化导致 了1/3以上由于碱基转换引起的遗传病
- 当组蛋白H1与含CCGG序列的甲基化或非甲基化DNA分别形成复合体时,DNA的构型存在着很大的差别,甲基化达到一定程度时会发生从常规的B-DNA 向Z-DNA 的过渡,由于Z-DNA结构收缩, 螺旋加深,使许多蛋白质因子赖以结合的原件缩入大沟而不利于转录起始, 导致基因失活
- 基因的5′ 端和3′ 端往往富含甲基化位点,而启动区DNA分子上的甲基化密度与基因转录受抑制的程度密切相关
- 序列特异性甲基化结合蛋白(MBD/MeCP)可与启动子区的甲基化CpG岛结合,阻止转录因子与启动子作用,从而阻抑基因转录过程
组蛋白乙酰化对真核基因表达的影响
组蛋白的修饰(乙酰化、磷酸化、甲基化、泛素化和糖基化等)引起的结构变化能影响基因的开关,也调控着基因的转录,影响着基因的表达,是目前表观遗传学(Epigenetic)研究的重要部分。也被称为组蛋白密码
组蛋白基本组成
组成染色质的基本结构单元核小体(nucleosome)由组蛋白(histone)八聚体(由两个包含H2A、H2B、H3和H4的四聚体组成)和缠绕两圈的DNA组成
组蛋白是碱性蛋白质,带正电荷,可与DNA链上带负电荷的磷酸基相结合,从而遮蔽了DNA分子, 妨碍了转录
核心组蛋白的乙酰化和去乙酰化
乙酰化(Acetylation):将一个乙酰官能基加入到一个有机化合物中的化学反应。 反之将乙酰基移除的反应称为去乙酰化(Deacetylation)。 蛋白质的乙酰化是一种转录后修饰作用
- 组蛋白的乙酰化过程由组蛋白乙酰转移酶催化,目前已发现了4种组蛋白乙酰基转移酶和5种去乙酰化酶。核心组蛋白朝向外部的N端部分被称为“尾巴”, 可被组蛋白乙酰基转移酶和去乙酰转移酶修饰,加上或去掉乙酰基团。
组蛋白乙酰基转移酶
- 组蛋白乙酰基转移酶(histone acetyltransferase,HAT)主要有两类:一类与转录有关,另一类与核小体组装以及染色质的结构有关
组蛋白乙酰化及去乙酰化对基因表达的影响
- 组蛋白N端“尾巴”上赖氨酸残基的乙酰化中和了组蛋白尾巴的正电荷,失去了与DNA的结合能力,从而提高了基因转录的活性
- 组蛋白乙酰化作用能阻止核小体装配,使染色质 处于比较松弛状态
- 组蛋白H3和H4的Arg、Lys的ε-NH2是修饰的主要 位点。乙酰化也使相邻核小体的结合受阻,同时 也促进泛素与组蛋白H2A的结合,导致组蛋白选 择性降解
组蛋白甲基化对于真核基因表达的调控
组蛋白甲基化功能
异染色质(heterochromatin)是指在细胞周期中具有固缩特性的染色体,其转录收到限制。
- 非组成型异染色质化,多发生在不同生长发 育时期一些需要被沉默的基因区域。动物中最常见的一种形式是雌性随机失活一条X染色体
- 组成型异染色质化,通常发生在染色质中心粒、 端粒区域,常由HP1蛋白介导
- 表冠修饰的遗传,表观修饰是可遗传的,当母 细胞分裂出子细胞时,母细胞染色质具有的特定 表观修饰会在子代细胞DNA 的相同位置重现
- 常表达染色质,该区域比异染色质区有更宽松 的修饰环境,也存在一些较普遍的标记,如基因的增强子区常有H3K4me1修饰。
组蛋白甲基转移酶
- 组蛋白上赖氨酸和精氨酸残基可以被甲基化修饰。 因此组蛋白甲基转移酶分成两类:组蛋白赖氨酸甲基转移酶 (histone lysine methyltransferase,HKMT)和蛋白质精氨酸甲基转移酶(protein arginine methyltransferase,PRMT)
- 精氨酸甲基转移酶(PRMT)分成一型和二型,一型催化单甲基和非对称双甲基化,二型催化单甲基和对称双甲基化
RNA水平修饰对基因表达的影响
- 真核生物的RNA上存在100多个化学修饰,然而只有极少数的修饰方式广泛存在于mRNA上。其中,N6-甲基腺苷化修饰(N6-methyladenosine,m6A)是mRNA上较为常见的一种RNA修饰方式。可以在转录后水平调控基因表达,影响多个重要的生理调控过程
- N6-甲基腺苷化修饰(m6A)指的是mRNA中腺嘌呤第6位氮原子上的甲基化修饰
m6A修饰甲基化酶
- 早期发现RNA m6A甲基转移酶全酶复合物至少由MT-A和MT-B两个亚基组成
- METTL3(methyl transferase-like 3)蛋白是最早被发现的m6A甲基转移酶复合物成分之一
m6A修饰去甲基化酶
- FTO和ALKBH5是调控m6A去甲基化修饰的两个重要的酶。FTO和ALKBH5属于AlkB家族,具备保守的铁离子结合基序以及一个酮戊二酸盐互作区域
m6A修饰调控基因表达的机制及对RNA代谢的影响
- m6A修饰是通过改变RNA的二级结构,使得RNA 结合蛋白能够能接近RNA序列,从而干扰修饰的进行,进一步调控基因表达
- m6A修饰对mRNA剪接的影响
- m6A修饰和mRNA剪接过程相关,甲基化可能会干扰剪接因子和mRNA间的相互作用
- m6A修饰位点可能是某些RNA结合蛋白的锚定位点或使A-U配对不稳定从而影响了RNA 的二级结构
- m6A对翻译过程的影响
- 大多数的m6A修饰发生在外显子区域,剪切完成 后m6A修饰仍然保留在成熟的mRNA上。因此,m6A修饰也会影响mRNA转录物的翻译
非编码RNA对真核基因表达的调控
干扰小RNA(siRNA)
- 基因表达共抑制现象(co-suppression):是真核转录后基因沉默的经典形式。不论引入靶基因的正义链(sense)还是反义链 (antisense),都可能导致内源靶基因表达量下降
- siRNA的产生过程主要包括着3个核心步骤:
- Dicer切割:Dicer是一类RNaseIII蛋白可用来切出长为21~23nt的siRNA,主要包括 一对RNaseIII结构域、双链RNA结合域、解旋酶结构 域和PAZ结构域。PAZ结构域可以结合双链RNA的两个3′不配对核苷酸。两个RNaseIII结构域形成分子内二聚体结构, 各催化剪切一条链,产生双链断裂。
- R2D2 的装配:siRNA的装载需要双链RNA结合蛋白R2D2,R2R2可以结合双链小RNA热稳定性高的一端,即引导链3′端一侧。Dicer 和 R2D2形成异源二聚体,Dicer/R2D2/siRNA三者形成RISC装载复合物。R2D2招募Argonaute蛋白,开始组装RISC
- RISC的装配和成熟:Argonaute与Dicer可以发生蛋白质-蛋白质相互作用,Argonaute首先与Dicer交 换,结合到siRNA双链的一端,然后与R2D2 交换,将整个双链小RNA 都转载到Argonaute中。此时,Argonaute将乘客链降解,形成有功能的沉默复合物。
- 通常成熟的真核mRNA与5′帽子结合蛋白和3′多腺苷酸结合蛋白等结合,使RDRP(RNA聚合酶)无法靠近mRNA。当缺少RNA结合蛋白时,RDRP结合mRNA并以其为模版,扩增出双链RNA,经Dicer切割产生 siRNA,降解内源RNA。
siRNA的生物学意义:
- 在转录水平、转录后水平参与基因的表达调控
- 维持基因组的稳定
- 保护基因组免受外源核酸侵入miRNA
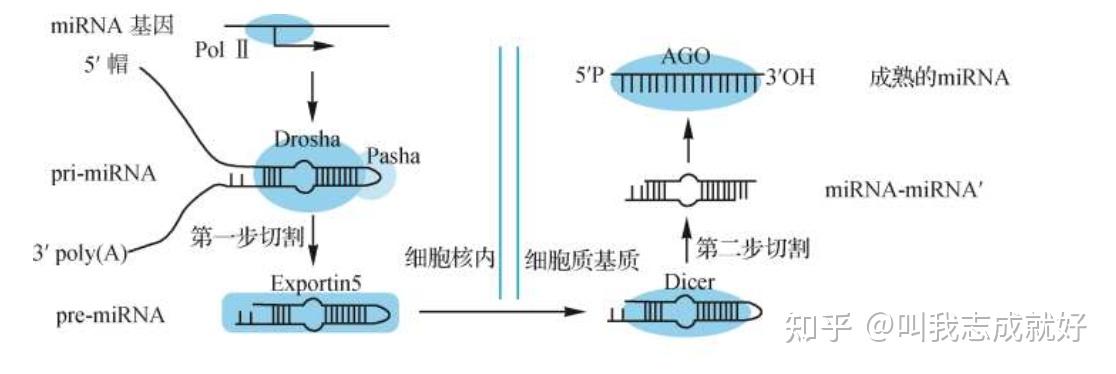
miRNA的生物合成
- 先由RNA聚合酶II产生的较长的初级转录物pri-miRNA,中间有一段不完美配对的茎-环结构
- 经过第一步切割产生 pre-miRNA,再经第二步切割产生双链miRNA,双链解链形成成熟的长21个核苷酸左右的单链 miRNA。
- 动物中miRNA前体的两次切割都由RNaseIII内切核酸酶以及双链RNA结合蛋白完成
- Drosha是一种RNaseIII,将pri-miRNA的3′端和5′ 端切割产生长约70个核苷酸、5′ 端带磷酸基团, 3′ 端为羟基的miRNA前体(pre-miRNA),保留茎- 环结构区,并且切割端具有2~3个核苷酸的3′不 配对碱基。
- 切割后的前体pre-miRNA经Exportin5/RanGTP运 出细胞核进入胞质中
- 胞质中的RNaseIII为Dicer,切割pre-miRNA茎- 环结构环的一端形成成熟的长约21个核苷酸的双链 miRNA ,即miRNA-miRNA* ,其中的miRNA链是真正行使功能的成熟miRNA链
- 植物中没有Drosha的同源基因,pri-miRNA的两步切割由Dicer的同源基因Dicer-Like1(DCL1)完成。植物双链miRNA两个3′端的自由羟基被甲基转移酶HEN1甲基化,以羟甲基的形式存在。甲基化的3′端被保护不受降解,有助于形成成熟的RISC。DCL1在细胞核内,pri-miRNA经DCL1两步切割,两端形成双链miRNA,由Exportin5的同源基因 HASTY 运输出细胞核
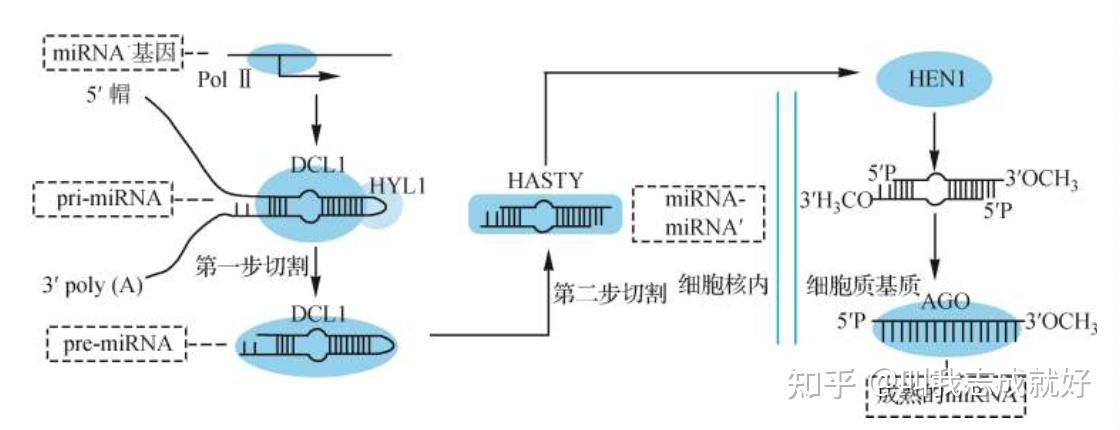
miRNA 的功能
- 和siRNA一样装载成RISC后使互补配对的mRNA降解
- miRNA可抑 制mRNA的翻译,降低靶基因的蛋白质水平但不 影响其mRNA的水平
长链非编码RNA
- 长链非编码RNA(lncRNA)指长度大于200bp的非编码RNA。主要包括:
- 正义lncRNA:其基因位点通过共享相同的启动子和某个蛋白编码基因有重叠
- 反义lncRNA:其基因位点以反向的方式插入在某个已知的蛋白编码基因中
- 基因内lncRNA:其基因位于某个蛋白编码基因的内含子区
- 基因间lncRNA:其编码lncRNA的基因位点位于两个蛋白编码的基因中
- 增强子lncRNA:其编码lncRNA的基因位点位于某一蛋白编码基因的增强子区域
- 环状lncRNA:指通过共价键形成闭合的环lncRNA ,来自可变剪切的编码蛋白基因
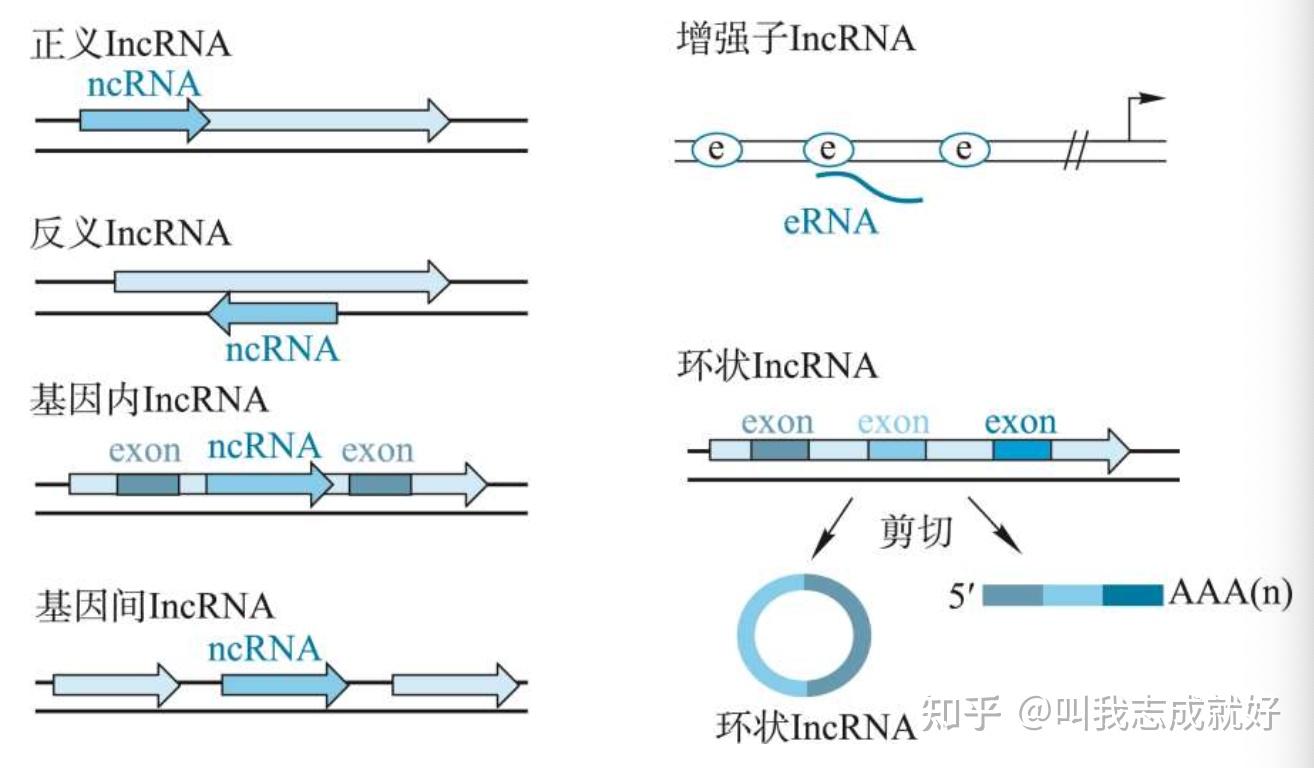
长链非编码RNA的作用机制
- lncRNA作为信号分子行使功能
- lncRNA可以作为信号分子、诱饵分子、引导分子 以及骨架分子等对基因表达进行调控
- lncRNA的转录具有时空表达特异性,以整合不同的发育信号、细胞内容物及响应不同的外界刺激等。
- lncRNAs能参与调控转录起始、延伸或终止等阶段。这些情况下,调控元件的染色质状态只被相关的lncRNAs表达影响。作为信号分子的lncRNA可进一步用来标记时空、发育阶段以及调控基因表达
- 一些lncRNAs能通过与染色体互作以及招募染色质修复装置等进一步参与介导大量基因的转录沉默
- lncRNA作为诱饵分子行使功能
- 启动子或增强子的转录对lncRNA的转录调控具有重要作用
- 作为诱饵分子的lncRNA转录并结合在蛋白质靶点 上,作为一种“分子过滤器”,进一步诱导RNA结合蛋白与之结合。这些蛋白质可以是转录因子、染色质修复子或者其他类型的调控因子等
- lncRNA 作为引导分子行使功能
- lncRNA可通过顺式(邻近的基因)或反式(远处的基因)的方式介导基因表达的改变
- lncRNA能以共转录或作为小RNA的互补靶标最终以顺式作用方式进一步介导染色质的改变
- 当lncRNA作为RNA-DNA异源双链核酸分子如 RNA:DNA:DNA三重复合物或特定染色质表面的RNA识别特征时,则会结合在靶DNA上以反式调控的方式介导染色质发生改变
- lncRNA 作为骨架分子行使功能
- lncRNA能作为一个中心平台招募相关生物学过程中的分子组分进一步调控基因表达
- 这一类型的lncRNA具有不同的功能区域,并结合不同的效应分子,是较为复杂的一类lncRNA
真核基因其他水平上的表达调控
蛋白质磷酸化对基因转录的调控
蛋白质的磷酸化与去磷酸化过程是生物体内普遍存在的调节方式,几乎涉及所有的生理及病理过程
- 细胞表面受体与配体分子的特异性结合,能诱导受体蛋白构象变化,使胞外信号顺利通过质膜进入细胞内,受体分子活化细胞功能的途径有两条:
- 受体本身或受体结合蛋白具有内源酪氨酸激酶活性,胞内信号通过酪氨酸激酶途径得到传递
- 配体与细胞表面受体结合,通过G蛋白介导的效应系统产生介质,活化丝氨酸/苏氨酸或酪氨酸激酶,从而传递信号
- 酪氨酸激酶受体侧向扩散使受体寡聚化,是活化信号转导时受体-受体间自身磷酸化所必需的
受cAMP水平调控的A激酶
- A激酶(PKA):依赖于cAMP 的蛋白激酶。它能把ATP分子末端磷酸基团加到特定蛋白质的丝氨酸或苏氨酸残基上
- 许多转录因子都可以通过cAMP介导的蛋白质磷酸化过程而被激活,因为这类基因的5′ 端启动区大都拥有一个或数个cAMP应答元件(cAMP- response element,CRE)其基本序列为:TGACGTCA
C激酶与PIP2、IP3、DAG
- C激酶是一个7.7×104的蛋白质,主要实施对丝氨酸、苏氨酸的磷酸化,它具有一个催化结构域和一个调节结构域
- 磷酸肌醇级联放大的细胞内信使是磷脂酰肌醇-4,5-二磷酸(PIP2)的两个酶解产物:肌醇1, 4, 5-三磷酸(IP3)和二酰基甘油(DAG)
- IP3和DAG是该途径的主要活性分子,G 蛋白通过活化的受体调控磷酸肌醇酶系统的活性。该激酶活性是依赖于Ca2+的,所以称为C激酶(PKC)IP3引起细胞质Ca2+浓度升高,导致C激酶从胞质转运到靠近原生质膜内侧处,并被DAG和Ca2+的双重影响所激活,DAG大大提高了C激酶对于Ca2+的亲和力,使得C激酶被生理水平的Ca2+活化
思考题
- 真核细胞中许多相关的基因按功能成套组合被称为基因家族。同一家族的成员有时紧密排列在一起,成为一个基因簇;更多时候,分散在同一染色体不同部位,甚至位于不同染色体上,具有各自不同的表达调控模式。
- 简单多基因家族:如各种rRNA和部分tRNA,通过对转录产物进行碱基修饰、特异性酶切、降解部分非必需序列后形成成熟产物。如:细菌中所有rRNA和部分 tRNA都来自沉降系数为30S(约6500个核苷酸)的前rRNA。初级转录产物首先被特异性甲基化,然后分别经RNaseIII、RNase P和RNase E 在特定位点切开,生成17S rRNA、tRNA、35SrRNA和5SrRNA前体分子,最后由 特定核酸酶降解部分非必需序列,得到成熟的16S rRNA、tRNA,23S rRNA和5S rRNA。在真核生物中,前rRNA转录产物的沉降系数为45S(约有14000nt),包括18S、28S和5.8S3个主要rRNA分子。前rRNA分子中至少有100 处被甲基化(主要是核糖的2—OH甲基化),初级转录产物也被特异性RNA酶切割降解,产生成熟rRNA分子。这个过程需要 snoRNAs的参与。5S rRNA作为一个独立的转录单位,由RNA 聚合酶III(而不是聚合酶I)完成转录
- 复杂多基因家族:如海胆组蛋白家族,基因家族之间由间隔序列隔开,每个基因能够作为单独的转录单位进行转录。以海胆的组蛋白复杂多基因家族为例:5个分别编码不同组蛋白的基因处于一个约为6000bp的片段中,分别被间隔序列所隔开。这5个基因组成的串联单位在整个海胆基因组中可能重复多达1000次。串联单位中的每一个基因分别被转录成单顺反子 RNA,这些RNA 都没有内含子,而且各基因在同一条 DNA 链上按同一方向转录,每个基因的转录与翻译速度都受到调节。因为组蛋白只有在适合于染色体复制的情况下才大量合成,而且所合成的H2A、H2B、H3和H4摩尔数相等,H1的量恰好是前者的一半。这是染色体组蛋白的实际比例。研究还表明,在一个特定的细胞中,并不是所有串联的单位都得到转录。胚胎发育的不同阶段或不同组织中,有不同的串联单位被转录,暗示可能存在具有不同专一性的组蛋白亚类和发育调控机制
- 发育调控的复杂多基因家族:如珠蛋白基因家族。在不同的发育阶段,通过表达不同的亚基发挥作用。血红蛋白是所有动物体内输送分子氧的主要载体,由a2β2组成的四聚体加上一个血红素辅基(结合铁原子)后形成功能性血红蛋白。已知所有动物物种中血红蛋白基因的基本结构都相同。人 α珠蛋白基因簇位于16号染色体短臂上,约占30kb,其中ζ为胚胎期基因,珠蛋白基因簇位于11号染色体短臂上,占50~60kb,其中ε为胚胎期基因,Gγ和Aγ为胎 儿型基因,δ和β为成人期基因。胚胎期类α-珠蛋白,最先以ζ2型出现,以后逐渐被ζ1型所取代。在胎儿期有两类等分子数β型链,即Gγ型和Aγ型链(在肽链的同一位点上,一条链含有甘氨酸,另一条含有丙氨酸)。因此,胚胎型血红蛋白中含有两个ζ2型α链和两个ε2型β链(即2ζ2ε2)。新生儿出生后,98%的血红蛋白中含有两个α2亚单位和两个β亚单位,2%的血红蛋白含两个α2亚单位和两个δ亚单位。在每个基因家族中,基因排列的顺序就是它们在发育阶段的表达顺序。
- 编码序列称为外显子(exon),非编码序列称为内含子(intron)。大多数真核基因都是由外显子和内含子两部分交替排列而成的。在一个结构基因中,编码某一蛋白质不同区域的各个外显子并不连续排列在一起,而常常被长度不等的内含子所隔离,形成镶嵌排列的断裂方式。
- 外显子—内含子连接区就是指外显子和内含子的交界或称边界序列,它有两个重要特征:
- 内含子的两端序列之间没有广泛的同源性,因此内含子两端序列不能互补,说明在剪接加工之前,内含子上游序列和下游序列不可能通过碱基配对形成发夹二级结构
- 外显子-内含子连接区序列是高度保守的,该序列可能与剪接机制密切相关,是RNA 剪接的信号序列
- 序列分析表明,几乎每个内含子5端起始的两个碱基都是GT,而3'端最后两个碱基总是 AG,由于这两个碱基的高度保守性和广泛性,有人把它称为GT—AG 法则,即:5'GT···AG3'。此外,内含子靠近3端的分支点在切除内含子过程中页头重要作用。
- 外显子与内含子的可变调控:
- 真核基因的原始转录产物可通过识别不同的剪接位点,产生不同的mRNA 剪接异构体,翻译成不同的蛋白质
- 有些基因选择了不同的启动子,或者选择了不同的多聚位点而使原始转录物具有不同的二级结构,产生不同的mRNA分子。
- DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。
- DNA 甲基化抑制基因转录的直接机制:DNA 甲基化导致某些区域DNA 构象变化,从而影响了蛋白质与 DNA的相互作用,抑制了转录因子与启动区 DNA的结合效率。
- 甲基化抑制转录的间接机制:CpG甲基化,通过改变染色质的构象或者通过与甲基化CpG结合的蛋白因子间接影响转录因子与DNA的结合。
- DNA 甲基化与X染色体失活:失活的染色体上绝大多数基因都处于关闭状态,DNA序列都呈高度甲基化。
- 真核生物的转录元件包括:转录模板、顺式作用元件(cis—actingelements)、反式作用因子(trans-acting factors)、RNA 聚合酶(RNA polymerase)。
- 转录模板包括从转录起始位点到 RNA 聚合酶II转录终止处的全部 DNA序列。顺式作用元件指启动子(promoters)和基因的调节序列。按功能特性分为启动子、增强子、沉默子、基因座控制区和绝缘子,其中启动子、增强子和基因座控制区为正性调控作用的元件,沉默子、绝缘子为负性调控作用的元件。反式作用因子是指能够结合在顺式作用元件上调控基因表达的蛋白质或者RNA。反式作用因子分为以下3类:具有识别启动子元件功能的基本转录因子、能识别增强子或沉默子的转录调节因子,以及不需要通过 DNA-蛋白质相互作用就参与转录调控的共调节因子(transcriptional regulator/co-factor)。反式作用因子通 常有两种独立的活性结构域:DNA识别结构域(DNA-binding domain)和转录活化结构域(transcriptional activation domain)。RNA 聚合酶是催化基因转录最主要的酶。原核生物只有一种RNA 聚合酶,真核生物有3种RNA 聚合酶,催化转录不同 RNA产物。真核生物3种RNA 聚合酶中,只有聚合酶II能够转录信使 RNA 前体,并在加工成熟后按照三联子密码的原理翻译成蛋白质产物
- 增强子的功能受DNA双螺旋空间构象的影响。增强子可能有如下3种作用机制:
- 影响模板附近DNA双螺旋结构,导致DNA 双螺旋弯折或在反式作用因子的参与下,通过蛋白质之间的相互作用形成增强子与启动子之间“成环”连接,活化基因转录。
- 将模板固定在细胞核内特定位置,如连接在核基质上,有利于 DNA拓扑异构酶改变DNA双螺旋结构的张力,促进RNA聚合酶II在DNA链上的结合和滑动。
- 增强子区可以作为反式作用因子或 RNA 聚合酶II进入染色质结构的“入口”。
- 反式作用因子有两种独立的活性结构域:DNA 识别结构域(DNA-bindingdomain)和转录活化结构域(transcriptional activation domain)
- DNA识别或结合域能够直接或间接地识别或结合在各类顺式作用元件核心序列上,参与调控靶基因转录效率。常见的结构有:①螺旋—转角—螺旋结构;②锌指结构;③碱性—亮氨酸拉链结构;④碱性—螺旋—环—螺旋结构;⑤同源异形结构域。DNA 识别结构域是反式作用因子结构中用来同顺式作用元件结合的结构区域,主要起结合DNA的作用
- 转录活化结构域是反式作用因子结构中用来同其他蛋白因子结合,参与募集启动子结合蛋白形成转录起始复合体,控制基因转录活化的区域。转录活化结构域有多种,通常是DNA识别结构域以外的20~100个氨基酸残基组成。不同的转录活化结构域有下列特征:①带有负电荷的酸性α螺旋结构域;②富含谷氨酰胺的结构域;③富含脯氨酸的结构域。酸性α螺旋结构域通过非特异性的相互作用与转录起始复合物上的TFIID等因子结合,生成稳定的转录复合物而促进转录;富含谷氨酰胺的结构域与GC盒结合调节转录;富含脯氨酸的结构域主要识别CCAAT盒。反式作用因子分为以下3类:具有识别启动子元件功能的基本转录因子、能识别增强子或沉默子的转录调节因子,以及不需要通过 DNA—蛋白质相互作用就参与转录调控的共调节因子(transcriptional regulator/ co-factor)。
- T-DNA插入到植物染色体上的什么位置是随机的。如果T-DNA插入某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。可以用TAIL-PCR方法检测鉴定T-DNA插入位点和突变体。农杆菌Ti质粒转化植物细胞后,获得的后代采用 CTAB 法提取基因组,用TAIL-PCR 扩增获得突变体T-DNA插入位点的侧翼序列,用DNAstar软件分析取得的测序资料,分析T-DNA边界剪切位点,通过与拟南芥基因组数据库进行比对,即可确定T—DNA的插入位点。
- 可以采用基因图位克隆的方法确定影响某表型的相关基因
- 首先通过诱变获得表型并建立遗传分离群体;然后开展以下工作:
- 找到与目标基因紧密连锁的分子标记
- 用遗传作图和物理作图将目标基因定位在染色体的特定位置
- 构建含有大插入片段的基因组文库(BAC库或YAC)
- 用与目标基因连锁的分子标记为探针筛选基因组文库
- 利用获得阳性克隆构建目的基因区域的跨叠群
- 通过染色体步行、登陆或跳跃获得含有目标基因的大片段克隆
- 通过亚克隆获得含有目的基因的小片段隆
- 进行功能互补实验(是最直接、最终鉴定基因的方法),通过转化突变体观察突变体表型是否恢复正常或发生预期的表型变化
- 如何通过实验的方法分析CTD上S2和S5不同磷酸化pattern的功能?
- CTD是RNA聚合酶II最大亚基羧基端结构域,它是由以7个氨基酸(Tyr-Ser-Pro-Thr-Ser-Pro-Ser)为重复单位的高度保守的重复序列组成,磷酸化是CTD结构的一个非常重要的特点。Ser—2和Ser—5是氨基酸发生磷酸化的两个活跃位点。正是由于CTD结构中具有了这些可发生磷酸化的位点,所以才有了RNA 聚合酶II的两种不同类型 RNAPIIA和RNAPIIO型。结构上的不同也直接影响了它们各自的功能:RNAPIIA与mRNA转录起始的阶段有关,而RNAPIIO则同转录的延伸过程有关。可以通过构建针对于S2和S5的磷酸化过程相关酶(TFIIH、CDTK-I、Ser5P PPase)的特异性缺失突变体,检测mRNA转录 过程以及mRNA转录产物的改变,进而检测不同的S2和S5磷酸化模式的功能
- 如何鉴定activation tagging的转基因植物中是哪个基因的表达上调而导致所观测的表型?
- activation tagging 即基因激活标签技术,是指含有35s增强子或启动子的rDNA或转座子,activation tagging 若插入基因内,可导致插入突变,使基因失活,而当其插入基因上游或下游时,则可能激活正常情况下不表达或表达极弱的基因的技术操作过程
- 鉴定方法:
- TAIL—PCR克隆下游序列,之后进行比对找出对应基因
- Western blotting 检测,观察是否相应的蛋白质表达有所增高
- 构建相应的35S—promoter待检测基因的激活标签载体转入植株,观察表型,分析待检测基因的表达
- 蛋白质的磷酸化与去磷酸化过程是生物体内普遍存在的调节方式,几乎涉及所有的生理及病理过程。蛋白质的磷酸化就是在蛋白质激酶的催化下,把ATP或GTP上γ位的磷酸基转移到蛋白质氨基酸残基上的过程,其逆过程则为去磷酸化,磷酸化的作用位点为蛋白上的Ser、Thr、Tyr
- 通过cAMP介导的蛋白质磷酸化过程激活转录因子。这类基因的5'端启动区大都拥有一个或数个cAMP应答元件(cAMP-response element,CRE), 其基本序列为 TGACGTCA。在胞内介导胞外信号时具有专一应答特点。膜上的受体 R与外源配基(ligand)相结合,引起受体构象变化,并与GTP 结合蛋白相结合,R与G耦合激活了与膜相关的腺苷酸环化酶(AC),导致胞内cAMP浓度上升,活化PKA,释放催化亚基并进入核内,实施底物磷酸化。被磷酸化的底物,如CREB、CREM等,可作为转录激活因子诱发基因转录
- C 激酶与 PIP2、IP3 和DAG。IP3 引起细胞质Ca2+浓度升高,导致 C 激酶从胞质转运到靠近原生质膜内侧处,并被 DAG和Ca2+的双重影响所激 活。C 激酶主要实施对丝氨酸、苏氨酸的磷酸化,能对外界刺激做出更迅速的反应
- CaM激酶及 MAP 激酶。Ca2+的细胞学功能主要通过钙调蛋白激酶(CaM—kinase)来实现,它们也是一类丝氨酸/苏氨酸激酶,但仅应答于细胞内Ca2+水平。MAP 激酶(mitogen-activated proteinkinase, MAP-kinase,又称为 extracellular-signal-regulated kinase,ERKS)活性受许多外源细胞生长、分化因 子的诱导,也受到酪氨酸蛋白激酶及G 蛋白受体系统的调控。MAP 激酶的活性取决于该蛋白质中仅有一个氨基酸之隔的酪氨酸、丝氨酸残基是否都被磷酸化。能同时催化这两个氨基酸残基磷酸化的酶称为 MAP—激酶—激酶,它的反应底物是 MAP 激酶。MAP—激酶 —激酶本身能被 MAP—激酶—激酶—激酶所磷酸化激活,后者能同时被 C 激酶或酪氨酸激酶家族的Ras蛋白等激活,从而在信息传导中发挥功能。此外,Jun、E1K—1等为转录因子,其磷酸化状态的改变能够影响其后介导的基因转录起始与否
- 蛋白质磷酸化与细胞分裂调控。细胞通过 p53 及p21 蛋白控制CDK(cyclin-dependent protein kinase)活性,调控细胞分裂的进程。如果p21蛋白过量,大量周期蛋白(cyclin)E—CDK2 复合物与p21 蛋白相结合,使CDK2丧失磷酸化pRb蛋白的功能。没有被磷酸化的pRb蛋白与转录因子 E2F 相结合并使后者不能激活一系列与DNA 合成有关的酶,导致细胞不能由G1 期进入S期,细胞分裂受阻。如果细胞中 p53 基因活性降低,p21 蛋白含量急剧下降,周期蛋白 E-CDK2复合物就能有效地将pRb蛋白磷酸化。此时,pRb蛋白不能与E2F 相结合,使后者发挥转录调控因子的作用,激活许多与DNA 合成有关的基因表达,使细胞从G1期进入S期,引发细胞分裂
- 核心组蛋白 H2A、H2B、H3、H4通过组蛋白N端“尾巴”上赖氨酸残基的乙酰化中和了组蛋白尾巴的正电荷,降低了它与DNA的亲和性,导致核小体结构更加松散,使得转录调节蛋白更容易与染色质基因组的这一部分相接触;组蛋白乙酰化作用还能阻止核小体装配,使染色质处于比较松弛状态,有利于提高基因的转录活性
- 组蛋白去乙酰化则与基因活性的阻遏有关。组蛋白去乙酰化酶(HDAC)Rpd3复合体专一性结合于某个或某类基因启动子区附近的组蛋白位点使之去乙酰化,导致染色质结构发生不利于基因转录的变化,核小体能相互靠近,在转录共抑制子的协同作用下,抑制基因的转录。组蛋白低乙酰化或去乙酰化伴随着转录沉默或转录抑制
- 激素对靶基因的影响。许多类固醇激素以及一般代谢性激素的调控作用都是通过起始基因转录而实现的。靶细胞具有专一性的细胞质受体,可与激素形成复合物,导致三维结构甚至化学性质发生变化。经修饰的受体与激素复合物通过核膜进入细胞核内,并与染色质的特定区域结合,导致基因的起始或关闭
- 糖皮质激素通过核穿梭(nuclear shuttling)激活下游信号通路。该激素与相应受体结合,改变其构象,使之进入细胞核内,结合在能够促进转录的相应增强子上,从而促进下游基因的转录
- 激素可诱导转录作用。将雌激素注入鸡体内,输卵管组织便开始合成卵清蛋白 mRNA。只要有雌激素或类雌激素(如二乙基己烯雌酚)存在,合成便能继续下去。一旦停止供应激素,合成速度便下降直至完全消失
- 关于通过形成激素—受体复合物调控基因表达有3种较为流行的假说:
- 受体流动假说:当激素与受体结合时,激素—受体复合物可在膜内流动并与腺苷酸环化酶结合,激活环化酶,引发后续效应。
- 中介物假说:以膜脂或加入的磷脂物质为中介,将受体与腺苷酸环化酶偶联在一起,激活环化酶的效应
- 邻位互调假说:GTP能够影响激素与受体结合,当激素与GTP协同作用,可使腺苷酸环化酶不同构象之间发生互变,从而调节其活性
- 分子伴侣广泛存在于原核生物和真核生物中,是在生物大分子的折叠、组装、转运及降解等过程中起协助作用,参与协助抗原的呈递和遗传物质的复制、转录及构象的确立,但自身并不发生任何变化的一大类蛋白质分子。可以分为核质蛋白家族、Hsp70家族、Hsp60家族、TCP-1、Hsp90家族、Hsp100家族、分 子内伴侣、周质分子伴侣、RNA分子伴侣等
- 它们影响基因表达的机制:通过与某个(类)专一蛋白因子结合,从而控制基因特异性表达。如许多生物在最适温度范围以上,能受热诱导合成一系列热休克蛋白(heat shock protein)产生
- 在没有受热或其他环境胁迫时,热激因子(heat shock factor,HSF)主要以单体的形式存在于细胞质和核内。单体HSF没有DNA结合能力,Hsp70可能参与了维持HSF的单体形式。受到热激或其他环境胁迫时,细胞内变性蛋白增多,它们都与HSF竞争结合Hsp70,从而释放HSF,使之形成三体并输入核内。HSF一旦形成三体,便拥有与HSE特异结合、促进基因转录的功能。这种能力可能还受磷酸化水平的影响,因为热激以后,HSF不但形成三体,还会迅速被磷酸化。HSF与HSE的特异性结合,引起包括Hsp70在内的许多热激应答,基因表达大量产生Hsp70蛋白。随着热激温度消失,细胞内出现大量游离的Hsp70蛋白,它们与HSF相结合,形成没有DNA结合能力的单体并脱离DNA。例如,受热后,果蝇细胞内热激因子HSF与hsp70基因 TATA 区上游60bp处的HSE相结合,诱发Hsp70mRNA转录,转录水平可提高1000倍
原文地址:https://zhuanlan.zhihu.com/p/503321150 |
|
 /3
/3 